生长调节剂ALA对盆栽百合生长和生理的影响
2021-05-06麦焕欣王晗璇胡云鹏韩婉盈李志美庞振培周厚高
麦焕欣 王晗璇 胡云鹏 韩婉盈 李志美 庞振培 周厚高
摘要:以盆栽百合品种秋瑞(Curie)为试材,研究不同质量浓度(30、40、50、60mg/L)的5-氨基乙酰丙酸(ALA)以及稳定剂添加与否对百合植株生长和生理的影响。结果表明,叶面喷施30~60mg/LALA均能促进植株生长,不同程度地提高百合叶片中叶绿素、可溶性糖、可溶性蛋白的含量和过氧化物酶活性。其中,喷施40mg/LALA显著提高了可溶性蛋白含量;喷施含稳定剂的60mg/LALA显著提高了叶绿素和可溶性糖的含量,显著提高了过氧化物酶活性,显著增加了生物量。总之,叶面喷施外源ALA能显著提高盆栽百合的品质,以ALA质量浓度60mg/L+稳定剂的处理效果最佳。
关键词:盆栽百合;5-氨基乙酰丙酸(ALA);生理性状;稳定剂;秋瑞百合
中图分类号:S628.2+65.04文献标志码:A
文章编号:1002-1302(2021)04-0099-05
作者简介:麦焕欣(1995—),女,广东佛山人,硕士研究生,主要从事植物栽培与育种研究。E-mail:837199011@qq.com。
通信作者:周厚高,博士,教授,博士生导师,主要从事花卉栽培与育种研究。E-mail:1031785076@qq.com。
百合是世界名花之一,有很高的观赏价值,盆栽百合近年在我国逐渐兴起成为重要的盆花。5-氨基乙酰丙酸(ALA)是一种含有氧、氮元素的5碳链小分子化合物,是生物体内各种卟啉类化合物生物合成的关键前体[1],同时也是叶绿素等四吡咯环色素形成的第1个直接前体,更是一种广泛存在于植物、动物、真菌、细菌等生物机体活细胞中的非蛋白氨基酸[2],很早就受到重视。近年来的大量研究发现,ALA在低浓度下可大幅度提高多种作物产量、品质、抗逆性,并具有显著调节植物生长发育的功能,被认为是一种新型的植物生长调节物质[3-7]。研究表明,ALA对花卉各部分生物量均有促进作用,提高了月季[8]、红掌[9]等植物叶片的光合效率,促使切花菊[10]植物叶片可溶性糖含量增加,提高了植物对低温的抗性。叶面喷施ALA能明显改善彩色马蹄莲种球及其生产盆花[11]、牡丹[12]、甜叶菊[13]、紫花苜蓿[14]、月季[15-16]等花卉植物的品质与产量,提高植株生物量,对有效调控以及延长花期有较大的影响。切花百合的相关研究表明,在切花百合展叶期和花蕾初期喷施ALA可以促进百合的营养生长,增加总叶绿素含量,延长花期,提高花卉质量和级别[17-18]。百合栽培前期需要遮荫处理,ALA具有提高光合作用效率的效果,因此探索ALA对盆栽百合优质生产的作用具有重要的实践意义。
本试验通过不同浓度的ALA喷施百合叶面处理,研究其对百合生长及主要生理指标的影响,以此为盆栽百合生长发育调节和优质生产提供参考。
1材料與方法
1.1试验材料
试验于2016年10月在仲恺农业工程学院试验基地进行。供试盆栽百合品种秋瑞(Curie)由广东佛山里水万顷园艺世界恒隆农业有限公司提供,是荷兰进口一代种球(种球周径规格14~16cm)。ALA药品由中国农业科学院提供。
1.2试验方法
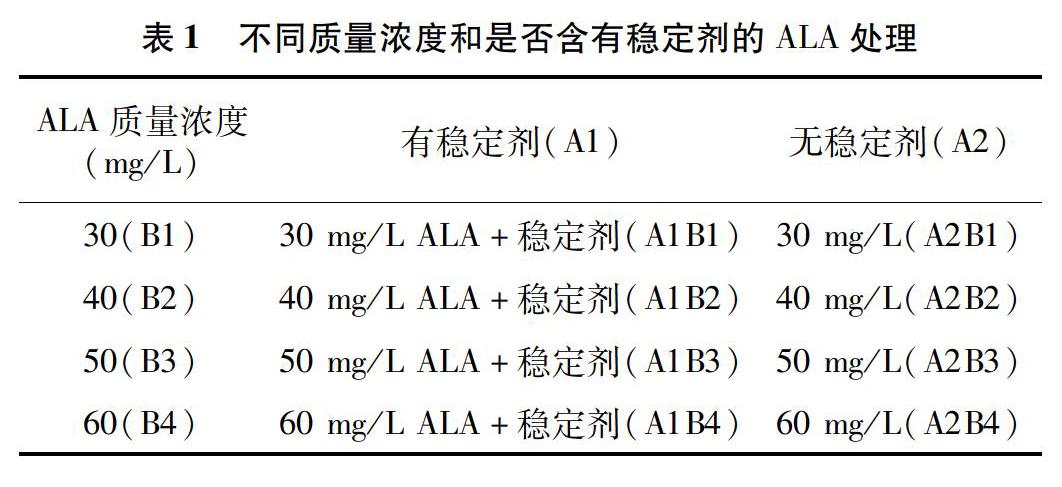
本试验采用2因子4水平随机区组设计进行叶面喷施ALA处理(表1),每个处理3次重复,每个重复30盆,每盆3株。设30、40、50、60mg/LALA4个质量浓度梯度,以及是否含有稳定剂,共8个处理,以喷施等量清水为对照(CK)。
定植25d,株高25~30cm,完全展叶时,第1次喷施ALA;现蕾时,第2次喷施ALA。喷施时间为17:00以后,调节水溶液pH值为6.0~6.5,避免阳光直射喷洒,下雨不喷洒。喷施量以全株湿润、叶两面均湿润但不滴液为度,常规水肥管理。
1.3项目测定
1.3.1植物生长指标的测定
在百合盆花采收期测量株高、茎粗、鲜质量和干质量。
1.3.2理化指标的测定
叶绿素含量采用张志良等的分光光度法[19]测定;叶片抗氧化酶活性采用张蜀秋等的方法[20]测定;可溶性糖含量采用蒽酮比色法测定;可溶性蛋白含量采用考马斯亮蓝G-250染色法[19]测定。
2结果与分析
2.1ALA对百合生长的影响
2.1.1ALA和稳定剂对百合鲜、干质量的影响
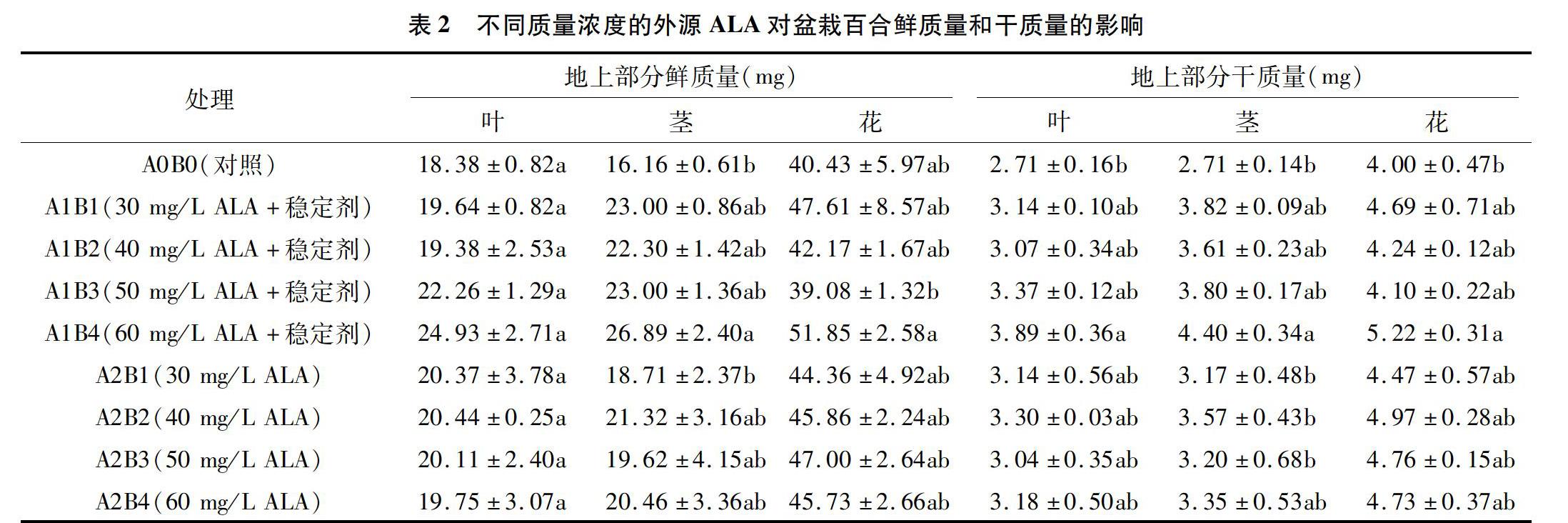
鲜质量和干质量是百合生长状况和盆花质量的重要指标。由表2可知,ALA叶面喷施处理的盆栽百合植株的地上部分鲜质量和干质量呈现明显增加的趋势,添加稳定剂比不添加的处理表现出更好的鲜质量和干质量增加效果(30、40mg/LALA处理的叶鲜质量和干质量除外)。质量浓度为60mg/L含有稳定剂的ALA处理表现出最佳的促进效果,30mg/L含有稳定剂的ALA处理次之。
2.1.2ALA和稳定剂对百合株高、茎粗的影响
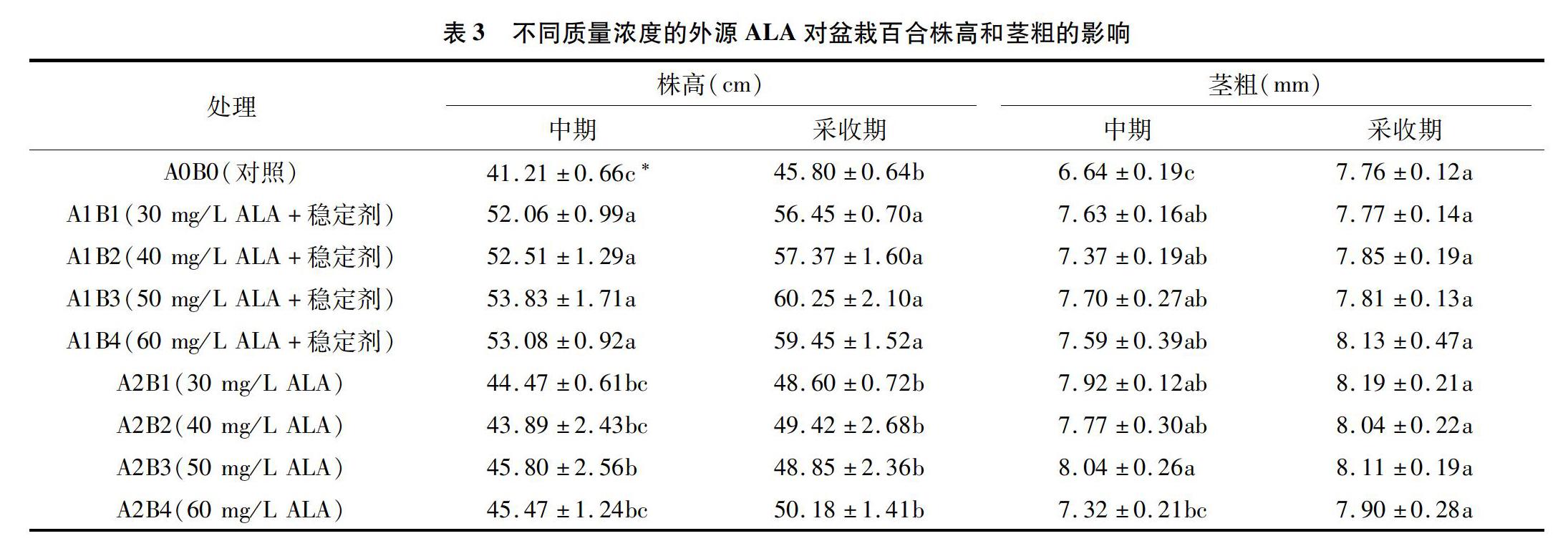
由表3可知,喷施ALA处理的盆栽百合株高和茎粗在生长中期(2017年2月28日测定)和采收期(2017年3月23日测定)均呈增加趋势。在不含稳定剂的ALA处理中,生长中期对株高和茎粗促进作用最佳的是50mg/LALA处理(A2B3)。在含有稳定剂的ALA处理中,生长中期和采收期对株高和茎粗促进作用最佳的是50mg/LALA处理(A1B3),其次是60mg/LALA处理(A1B4)。对有无稳定剂的2类处理比较分析可以发现,含有稳定剂的质量浓度为50mg/L的ALA处理对百合的增高生长促进效果最明显。
2.1.3ALA和稳定剂对百合花苞数量和花蕾长度的影响从表4可以看出,不同质量浓度的外源ALA对盆栽百合花苞数量的影响不明显。不同质量浓度的外源ALA能在一定程度上提高盆栽百合花蕾长度。含有稳定剂的60mg/LALA处理(A1B4)的平均花蕾长度最大(13.37cm),显著大于其他处理(A2B1处理除外)。
2.2ALA和稳定剂对百合主要生理性状的影响
2.2.1ALA和稳定剂对百合抗氧化酶活性的影响
活性氧清除系统中酶促系统的重要保护酶主要包括超氧化物歧化酶(SOD)、过氧化氢酶(CAT)和过氧化物酶(POD),植物在逆境条件下提高生存能力的重要途径就是提高植物体内抗氧化酶活性和增强抗氧化代谢的水平。
由表5可知,不同质量浓度的外源ALA处理对盆栽百合叶片中超氧化歧化酶活性有一定的抑制作用,除了A1B2处理外,其他处理与对照均差异显著。30~50mg/L的ALA处理中,不含稳定剂的ALA处理比有稳定剂的处理抑制效果更明显。
与对照相比,不同質量浓度的外源ALA对盆栽百合叶片中CAT活性没有显著影响。在含有稳定剂的ALA处理中,不同浓度处理的效应有一定的差异,其中含有稳定剂质量浓度为50mg/L处理(A1B3)的CAT活性最高,达到458.33U/g,与大部分处理差异显著(对照和A2B4处理除外)。
与对照相比,不同质量浓度的外源ALA处理对盆栽百合叶片中POD活性有促进作用,大部分处理效应达到了显著差异。在有稳定剂和无稳定剂的处理中,随着ALA质量浓度提高,POD活性均呈递增的趋势,在质量浓度最大的60mg/LALA处理中,POD活性最高,分别为3.45、3.58U/(g·min),与对照处理的2.71U/(g·min)有显著差异。
2.2.2叶面喷施ALA对百合叶片叶绿素含量的影响
由表6可知,不同质量浓度的外源ALA处理对盆栽百合叶片叶绿素含量的增加均有明显的促进作用,与对照处理相比,绝大部分处理的叶绿素增加效应达到了显著差异。外源ALA处理后,百合叶绿素a、叶绿素b含量以及叶绿素a+叶绿素b含量的变化趋势基本一致,含有稳定剂的处理明显比没有稳定剂的ALA处理效果更好一些(低浓度的A1B1和A2B1处理除外),浓度与叶绿素含量增加正相关更明显。值得注意的是,ALA处理对叶绿素a含量/叶绿素b含量的影响不大,绝大部分处理与对照没有显著差异,只有质量浓度为60mg/L的ALA不含稳定剂处理达到最大值(2.91),且与对照处理差异显著。
盆栽百合叶片中叶绿素a+叶绿素b含量的变化趋势,与叶绿素a、叶绿素b含量的变化趋势一致。叶绿素a+叶绿素b含量在含有稳定剂质量浓度为60mg/L的ALA处理中,达到最大值(2.090mg/g),且与对照处理比较差异显著。
2.2.3ALA和稳定剂对百合可溶性糖和可溶性蛋白含量的影响可溶性糖不仅是光合作用的主要产物,还是碳水化合物代谢和暂时储能的主要形式[11,21],不同叶位的可溶性糖含量差异可能与光合能力有关。蛋白质是生命的基础物质。植物在逆境条件下通过增加可溶性蛋白的合成,直接参与其适应逆境的过程[22]。可溶性糖、可溶性蛋白是植物细胞重要的渗透调节物质[23-24],在植物代谢中举足轻重,其含量可以反映植物对非生物胁迫的耐受能力[25-26]。
由表7可知,不同质量浓度的ALA处理对盆栽百合秋穗叶片中的可溶性糖含量提升均有显著的促进效果。在含有稳定剂的ALA处理中,可溶性糖含量与对照相比均显著增加,正相关趋势明显,在质量浓度为60mg/L时,含量达到最高值(0.811mg/g);在不含稳定剂的ALA处理中,其效果与含有稳定剂的处理基本一致,ALA质量浓度50mg/L处理的可溶性糖含量达到最高(0.800mg/g)。
不同质量浓度的ALA处理对盆栽百合叶片中的可溶性蛋白含量提升都有一定的效果(A1B4处理除外),部分处理与对照达到显著差异。在含有稳定剂和不含稳定剂的ALA处理中,可溶性蛋白含量均在ALA质量浓度为40mg/L时达到最大值,分别为10.030、9.710mg/g,且均与对照差异显著。
3结论与讨论
本试验以盆栽百合品种秋瑞为试材,研究不同质量浓度(30、40、50、60mg/L)的5-氨基乙酰丙酸以及稳定剂添加与否对百合植株生长与生理的影响。结果表明,叶面喷施30~60mg/LALA均能促进植株生长,不同程度地提高百合叶片中叶绿素、可溶性糖、可溶性蛋白的含量和抑制SOD的活性,其中喷施40mg/LALA显著提高了可溶性蛋白含量;喷施含稳定剂的60mg/LALA显著提高了叶绿素和可溶性糖的含量,显著抑制了SOD活性。总之,叶面喷施外源ALA能显著提高百合盆花的品质,以含稳定剂质量浓度60mg/L的处理效果最佳。
外源ALA处理能够增加百合叶片中的总叶绿素含量,该研究结果与ALA处理能增加切花月季(Rosahybrida)和红掌幼苗总叶绿素含量的研究结果[27-28]一致。试验表明,不同质量浓度的外源ALA可以促进植物主茎的横向加粗生长和伸长生长以及物质的量的积累,含有稳定剂的质量浓度为50mg/L的ALA原药对盆栽百合秋穗的伸长生长和增粗生长效果最佳,提高生物量的积累。ALA能明显提高百合地上部分干物质量,适宜质量浓度的ALA处理可以提高切花和盆栽百合的生物量,含有稳定剂的质量浓度为60mg/L的ALA对提高盆栽百合叶、茎、花的生物量积累效果显著,这是因为ALA能够促进光合作用,提高植物抗逆性,促进根系的生长发育,提高植物体内代谢酶的活性[27]。含有稳定剂的质量浓度为60mg/L的ALA对盆栽百合秋穗的叶绿素a、叶绿素a+叶绿素b含量的提升效果最佳,且对叶绿素a、叶绿素b和总叶绿素的含量提升效果一致。含有稳定剂的质量浓度为60mg/L的ALA对盆栽百合秋穗中可溶性糖含量的提高效果显著。适宜浓度的ALA处理可以提高百合的抗旱性,但其是影响可溶性糖的生成还是分解,还需要进一步研究。含有稳定剂的质量浓度40mg/L的ALA对盆栽百合秋穗中可溶性蛋白含量的提高效果显著。
综合该试验结果可以得出,在盆栽百合秋穗生长期,叶面喷施含有稳定剂60mg/L的ALA溶液能有效提高叶绿素含量、可溶性糖含量,抑制SOD活性,促进生物量积累,有效提高百合秋穗的盆花品质。
参考文献:
[1]汪良驹,姜卫兵,章镇,等.5-氨基乙酰丙酸生物合成生理活性及其在农业上的潜在应用[J].植物生理学通讯,2003,39(3):185-192.
[2]PorraRJ.Recentprogressinporphyrinandchlorophyllbiosynthesis[J].Photochemistry&Photobiology,1997,65(3):492-516.
[3]刘晖.5-氨基乙酰丙酸(ALA)的化学合成及其提高草莓和西瓜耐盐性效应的研究[D].南京:南京农业大学,2005.
[4]黄芳,李茂富,汪良驹,等.外源ALA对低温胁迫下巴西蕉幼苗抗冷性的影响[J].南方农业学报,2012,43(7):918-923.
[5]肖晓梅.ALA和MgSO4处理对红掌光合特性及干物质积累的影响[J].热带农业科学,2014,34(12):9-13.
[6]俞建良,郭孝孝,熊结青.5-氨基乙酰丙酸的应用研究进展[J].化学与生物工程,2015,32(9):10-15.
[7]李小玲,华智锐,张丹婷.5-氨基乙酰丙酸(ALA)对秦岭高山杜鹃耐热性的诱导效应[J].江苏农业科学,2017,45(20):176-179.
[8]任忠秀,聂立水,张强,等.含5-氨基乙酰丙酸等養分水溶肥料对月季生长、开花及体内养分元素含量的影响[J].中国土壤与肥料,2011(4):59-64.
[9]康博文,李文华,刘建军,等.ALA对红掌叶片光合作用及叶绿素荧光参数的影响[J].西北农林科技大学学报(自然科学版),2009,37(4):97-102.
[10]张严玮,房伟民,黄素华,等.外源ALA对低温胁迫下切花菊光合作用及生理特性的影响[J].南京农业大学学报,2014,37(1):47-52.
[11]郭彦兵,屈德洪,吴景芝,等.叶面喷施ALA对彩色马蹄莲种球及盆花品质的影响[J].南方农业学报,2018,49(1):109-115.
[12]石颜通.温室环境与ALA对牡丹促成栽培成花的影响[D].北京:中国农业科学院,2012.
[13]陈叶,李番,马秀萍,等.5-氨基乙酰丙酸对甜叶菊产量和糖含量的影响[J].中国糖料,2017,39(2):36-38.
[14]李丹丹,梁宗锁,杨宗岐,等.5-氨基乙酰丙酸对紫花苜蓿生理特性的影响[J].草业科学,2019,36(11):2847-2853.
[15]吴鹏夫,张应红,赵慧瑛,等.叶面喷施5-氨基乙酰丙酸对切花月季‘卡罗拉花枝产量及品质的影响[J].园艺学报,2012,39(增刊):2745.
[16]肖月,周楚奇,吴景芝,等.ALA对月季切花生产的影响[J].南方农业学报,2018,49(9):1816-1820.
[17]张帅,姜慧茹,何俊娜,等.叶面喷施5-氨基乙酰丙酸对百合生长发育和切花质量的影响[J].园艺学报,2015,42(增刊1):2776.
[18]胡云鹏,康念,李宇辉,等.5-氨基乙酰丙酸对百合生长发育的影响[J].仲恺农业工程学院学报,2017,30(2):1-5.
[19]张志良,瞿伟菁,李小芳.植物生理学实验指导[M].北京:高等教育出版社,1999.
[20]张蜀秋,李云.植物生理学实验技术教程[M].北京:科学出版社,2011.[HJ2mm]
[21]徐惠风,金研铭,张春祥,等.向日葵叶片可溶性糖含量的研究[J].吉林农业大学学报,2000,22(1):23-25.
[22]张明生,谢波,谈锋,等.甘薯可溶性蛋白、叶绿素及ATP含量变化与品种抗旱性关系的研究[J].中国农业科学,2003,36(1):13-16.
[23]武香,倪建伟,张华新,等.盐胁迫下不同盐生植物渗透调节的生理响应[J].东北林业大学学报,2012,40(8):29-33.
[24]沙伟,刘焕婷,谭大海,等.低温胁迫对扎龙芦苇SOD、POD活性和可溶性蛋白含量的影响[J].齐齐哈尔大学学报,2008,24(2):1-4.
[25]朱政,蒋家月,江昌俊,等.低温胁迫对茶树叶片SOD、可溶性蛋白和可溶性糖含量的影响[J].安徽农业大学学报,2011,38(1):24-26.
[26]王晓宇,张艳娥,张林生.4种非生物胁迫下小麦幼苗表型及可溶性蛋白含量的变化[J].干旱地区农业研究,2018,36(2):113-117.
[27]吴鹏夫.叶面喷施ALA对切花月季‘卡罗拉花枝品质及产量的影响[D].湖南:湖南农业大学,2013.
[28]肖晓梅.喷施ALA对红掌幼苗生长的影响[J].热带农业科学,2012,32(1):8-11.
