乳腺导管原位癌分子分型与影像特征和病理特征的相关性研究
2021-05-06顾海玉龚良庚徐新红王小英
顾海玉 龚良庚 徐新红 王小英


【摘要】 目的:探討乳腺导管原位癌(DCIS)分子分型与影像特征和病理特征的相关性,比较其差异。方法:选取2018年1月-2020年6月经术后病理确诊为乳腺单纯DCIS患者90例。应用乳腺影像报告数据系统(BI-RADS)对乳腺癌X线摄影表现进行规范化的描述分析,根据超声BI-RADS分级标准对超声图像进行分类,采用免疫组织化学法(IHC)检测ER、PR、HER-2、Ki-67、p53的表达。结果:ER阳性型发病年龄大于HER-2阳性型;HER-2阳性型患者中中-高核级、Ki-67高表达、p53阳性常见,而ER阳性型反之;ER阳性型中肿块(或腺体结构紊乱)较常见,导管扩张并充盈缺损常见;而HER-2阳性型中肿块(或腺体结构紊乱)伴钙化较常见,导管扩张少见;伴钙化DCIS中HER-2阳性型、Ki-67高表达及中、高核级更为常见,差异均有统计学意义(P<0.05)。影响DCIS病理核分级的因素中,低核级多表现ER阳性型,Ki-67低表达,肿块(或腺体结构紊乱),少伴钙化,多伴有导管扩张并充盈缺损;而中、高核级多表现为HER-2阳性型,Ki-67高表达,肿块(或腺体结构紊乱)伴钙化,少伴导管扩张。二元logistic回归显示,Ki-67表达是DCIS分子分型的影响因素,Ki-67低表达更表现为ER阳性型。结论:HER-2阳性型患者发病年龄较ER阳性型者小,且中-高核级、Ki-67高表达、p53阳性常见,肿块(或腺体结构紊乱)常伴有钙化,导管扩张较少见,预示其预后较差,发展为浸润性癌的风险及局部复发率较高,ER阳性型则反之。
【关键词】 导管原位癌 分子分型 影像特征 病理核分级
Correlation between Molecular Typing and Imaging and Pathological Features of Ductal Carcinoma in Situ/GU Haiyu, GONG Lianggeng, XU Xinhong, WANG Xiaoying. //Medical Innovation of China, 2021, 18(07): 0-028
[Abstract] Objective: To investigate the correlation between molecular classification of ductal carcinoma in situ (DCIS) and imaging and pathological features of the breast, and to compare the differences. Method: From January 2018 to June 2020, 90 patients with simple breast DCIS were selected pathologically after menstruation. The breast imaging report data system (BI-RADS) was used to standardize the description and analysis of breast cancer X-ray photographs. The ultrasound images were classified according to the ultrasound BI-RADS classification standards. The expression of ER, PR, HER-2, Ki-67 and p53 were detected by immunohistochemistry (IHC).Result: The age of onset of the ER-positive type was greater than that of the HER-2 positive type; Here-2 positive patients had intermediate and high pathological grading, Ki-67 high expression, and p53 positive were common, while the ER-positive type was the opposite; in the ER-positive type, mass (or gland structure disorder) was more common, and the duct dilation and filling defect were common, while the HER-2 positive type mass (or gland structure disorder) with calcification is more common, and duct dilation was rare; HER-2 positive type, with calcification DCIS, Ki-67 high expression and intermediate and high pathological grading were more common,the differences were statistically significant(P<0.05). Among the factors affect the pathological grading of DCIS, low pathological grades were mostly ER-positive, Ki-67 low expression, masses (or glandular structural disorders), less accompanied by calcification, and more accompanied by ductal dilation and filling defects; high pathological grade was mostly HER-2 positive, Ki-67 was highly expressed, masses (or glandular structural disorders) were accompanied bycalcification, and rarely accompanied by duct dilation. Binary Logistic regression showed that Ki-67
expression was an imaging factor of DCIS molecular typing, and low Ki-67 expression was more ER-positive. Conclusion: The age of onset of HER-2 positive patients is younger than that of ER-positive patients, and it is common to have intermediate and high pathological grading, high Ki-67 expression, and p53 positive. Masses (or structural disorders of glands) are often accompanied by calcification, and duct dilation is rare.It indicates a poor prognosis, a higher risk of developing invasive cancer and a higher rate of local recurrence. The opposite is true for ER positive type.
[Key words] Ductal carcinoma in situ Molecular typing Imaging features Pathological grading
First-authors address: The Second Affiliated Hospital of Nanchang University, Nanchang 330006, China
doi:10.3969/j.issn.1674-4985.2021.07.006
導管原位癌(ductal carcinoma in situ,DCIS)是指肿瘤组织局限于乳腺导管内,未突破基底膜,但低核级和高核级DCIS可能源自两个完全不同的发生途径。基因表达微阵列技术证实DCIS是一种异质性病变,并且根据其分子特征提出了新的分型,即非典型导管增生(atypical ductal hyperplasia,ADH)、DCIS、低核级IDC有相同的基因表达谱,为雌激素受体(estrogen receptor,ER)表达型,而高核级DCIS和高核级的IDC具有相同的基因表达谱,与核分裂活性和细胞周期相关。买志福等[1]认为,低核级DCIS经过一个很长的潜伏期后可发展为分化良好的浸润性导管癌(invasive ductal carcinoma,IDC),而高核级DCIS病变经过一个比较短的时间则进展为分化差的IDC。本研究主要探讨不同分子分型DCIS与影像特征及病理特征的相关性,为临床治疗DCIS患者提供一定的参考依据,现报道如下。
1 资料与方法
1.1 一般资料 选取2018年1月-2020年6月南昌市第三医院90例乳腺DCIS患者临床资料。(1)纳入标准:①均经手术病理诊断明确;②钼靶及超声资料完整;③均为女性。(2)排除标准:①DCIS伴微浸润;②既往有乳腺疾病史;③既往有恶性肿瘤史;④有其他重度疾病者。入选90例患者资料均为女性,年龄27~77岁,平均(52.7±11.3)岁。该研究已经伦理学委员会批准,患者知情同意。
1.2 方法
1.2.1 X线摄影检查 采用德国Siemens公司生产的MAM-MOMAT3000全数字化乳腺X线机行乳腺摄影,常规采用双乳头尾位(CC位)和内外斜位(MLO位)。由两名(其中一名副主任及以上)医师应用乳腺影像报告数据系统(BI-RADS)对乳腺癌X线摄影表现进行规范化的描述分析[2]。
1.2.2 超声检查 患者取俯卧位,采用彩色超声诊断仪日立HV900、GE Healthcare、SEMENZS2000,探头频率为5~18 MHz,扫描横轴位、矢状位、冠状位,观察有无病灶、病灶形态、病灶的内部血流阻力指数(RI)值、周围组织改变情况,根据超声BI-RADS分级标准对超声图像进行分类[3]。
1.2.3 分子分型 采用免疫组织化学法(IHC)检测ER、PR、HER-2、Ki-67、p53的表达。根据2015版中国ER、PR检测指南:ER检测中有循证医学证据的是ERα抗体,建议将ER、PR免疫组织化学检测的阳性阈值定为≥1%[4]。HER-2的判定标准参照2019版中国HER-2检测指南:IHC3+为HER-2阳性,IHC0/IHC1+为HER-2阴性;IHC2+为HER-2不确定病例,需进一步行FISH检测,由于本院导管原位癌IHC2+未行FISH检测,故排除IHC2+的患者[5]。Ki-67以对癌细胞核中阳性染色细胞所占的百分比进行报告,大部分中国专家认同<15%为低表达,≥15%为高表达[6]。p53蛋白阳性的表达以≥10%作为判定标准,排除免疫组化染色观察不确定的标本[7]。组织学分级病理标本均行HE染色切片,必要时加用免疫组化分析,由2名有经验的病理科医师进行诊断,并将DCIS根据组织学核级别分为低核级别和中、高核级别。根据免疫组织化学结果将DCIS分为以下3型:(1)ER阳性型(HER-2-,PR任何水平);(2)HER-2阳性型(ER、PR任何水平);(3)三阴性型(ER-、PR-、HER-2-)。
1.3 统计学处理 采用SPSS 23统计软件进行分析,计量资料以(x±s)表示,比较采用t检验,计数资料以例(%)表示,比较采用字2检验或Fisher确切概率法。以P<0.05为差异有统计学意义。
2 结果
2.1 基线资料 90例单纯DCIS患者中ER阳性型38例(42.2%),HER-2阳性型50例(55.6%),三阴性型2例(2.2%)。50例HER-2阳性型中HR阳性22例,HR阴性28例。影像特征:钙化16例(17.8%),肿块(或腺体结构紊乱)35例(38.9%),肿块(或腺体结构紊乱)伴钙化39例(43.3%);导管扩张(伴充盈缺损)23例(25.6%)。
2.2 DCIS分子分型与病理特征的关系 因三阴性型病例2例,病例不足,故剔除。ER阳性型、HER-2阳性型患者的年龄、病理核分级、Ki-67表达、p53表达比较,差异均有统计学意义(P<0.05)。ER阳性型发病年龄较HER-2阳性型大,HER-2阳性型患者中-高核级、Ki-67高表达、p53阳性比ER阳性型更常见(P<0.05)。见表1。
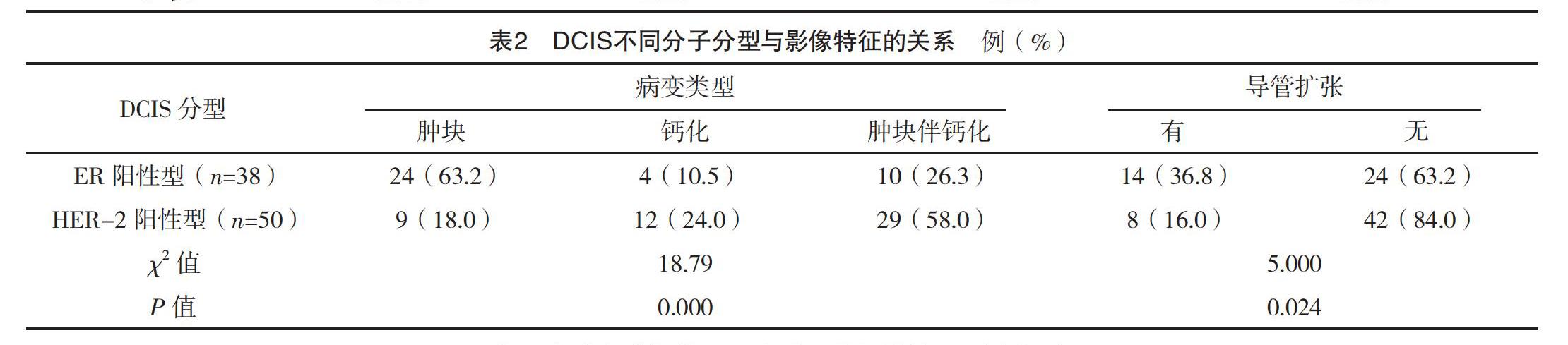
2.3 DCIS分子分型与影像特征的关系 ER阳性型、HER-2阳性型中病变类型、导管扩张比较,差异均有统计学意义(P<0.05)。ER阳性型中肿块型较常见,而HER-2阳性型中肿块伴钙化较常见,ER阳性型伴导管扩张更常见。见表2。
2.4 钙化与非钙化型DCIS与病理特征的关系 伴钙化DCIS常表现为HER-2阳性型、Ki-67高表达、中高核级(P=0.000);而钙化在ER、PR、p53表达上比较,差异均无统计学意义(P>0.05)。见表3。
2.5 影响DCIS病理核分级的因素分析 不同病理核分级影像特征比较,差异有统计学意义(P=0.000)。低核级多表现为肿块型,多伴有导管扩张;中、高核级多半表现为肿块型伴钙化,不伴导管扩张。分子分型比较差异有统计学意义(P=0.040),低核级多表现为ER阳性型、Ki-67低表达,中-高核级多表现为HER-2阳性型、Ki-67高表达。不同病理核分级p53比较,差异无统计学意义(P=0.400)。见表4。
2.6 DCIS分子分型多因素分析 二元logistic回归显示,Ki-67表达是DCIS分子分型影响因素(P=0.000),Ki-67低表达更表现为ER阳性型;而年龄、钙化、病理核分级及p53表达不是独立影响因素(P>0.05)。见表5。典型例图见图1、2。
注:患者,女性,40岁,体检发现左乳钙化灶1 d。A示钼靶CC位,B示钼靶ML0位,左乳内上象限见大量密集钙化灶,沿导管分布。C示导管造影示,乳内上一只导管扩张,导管内见多发充盈缺损,导管走形僵直。D示乳腺超声,左乳内上腺体结构紊乱,其内回声分布不均匀,体内可见多数细小钙化灶,CDFI血流信号Ⅰ级。病理诊断为导管原位癌中-高级别。
3 讨论
随着乳腺X线检查技术的进步及普及,DCIS的检出率逐年升高,占所有新发乳腺癌的20%~25%[8]。DCIS患者术前准确预测病变复发风險,对于治疗方案的选择及预后的随诊复查有关,从而尽量保证患者的生活质量。
研究显示,高级别、ER表达低、HER-2阳性率高的DCIS患者更易发生微浸润。ER阳性时病变预后较好,同时提示临床上可以使用内分泌治疗,内分泌治疗有效率可>80%[9-11]。袁明明等[12]研究显示,组织学分级越高,p53表达率越高,而p53在ER阴性组、PR阴性组、HER-2阳性组及Ki-67高表达组中表达率较高。易清清等[13]研究显示,p53高表达者对化疗的敏感性及5年生存率均明显低于p53低表达者,而p53高表达者的复发率、转移率明显高于p53低表达者。本研究中HER-2阳性型患者更多表现为中-高核级,Ki-67高表达,p53阳性,说明HER-2阳性型的侵袭性及局部复发率更高。
乳腺DCIS常表现为肿块(或腺体结构紊乱)、单纯钙化、肿块(或腺体结构紊乱)伴钙化,部分导管扩张伴充盈缺损。乳腺内钙化形成的可能因素与肿瘤组织的退行性变,坏死或是细胞活性增加,分泌增加等有关,这提示钙化DCIS较无钙化DCIS更有侵袭性。马发鹏等[14]研究表明,恶性钙化形态大多是微钙化(<0.5 mm)、泥沙样钙化、分支样、多形性和不定型钙化。蔡斌等[15]认为,恶性钙化形态是由于病理上DCIS肿瘤细胞易坏死产生大量粉刺状物质并沿乳腺腺叶的一支或多支导管分布,在此基础上产生钙化有关。周敬勉等[16]研究,发现DCIS有4种超声类型,分别是肿块型、增生型、导管型及单纯微钙化型。本研究结果显示,ER阳性型中肿块型较常见,而HER-2阳性型中肿块型伴钙化较常见,伴钙化DCIS中HER-2+阳性型、Ki-67高表达及中、高核级更为常见,这与相关文献[17-19]报道一致。另外,ER阳性型中导管扩张伴充盈缺损较常见,HER-2阳性型中导管扩张较少见,而此类的相关文献不多。
本研究显示,ER阳性型发病年龄(57.7±12.3)岁比HER-2阳性型(48.4±8.3)岁大,差异有统计学意义(P<0.05),这与文献[20]不一致,考虑可能与患者样本量少或样本仅来源于一个医院有关。本研究有一定的局限性。首先,本研究为回顾性研究,样本量较少,得出的结论有一定的偏差;其次,样本均来源于南昌市第三医院,可能出现选择偏差。这两个问题需要在今后的研究中扩大样本量,并多院区合作进一步解决。
综上所述,DCIS患者多为ER阳性型及HER-2阳性型,并且ER阳性型发病年龄大于HER-2阳性型。HER-2阳性型患者中-高核级、Ki-67高表达、p53阳性常见,肿块(或腺体结构紊乱)常伴有钙化,导管扩张较少见,预示其预后较差,发展为浸润性癌的风险及局部复发率较高。
参考文献
[1]买志福,郭文家,柴晓波.乳腺导管原位癌研究进展[J].检验医学与临床,2018,15(20):3142-3145.
[2] American College of Radiology.Illustrated breast imaging reporting and data system(BI-RADS)[M].Reston,VA:American College of Radiology,2013.
[3] de Almeida J R,Gomes A B,Barros T P,et al.Predictive performance of BI-RADS magnetic resonance imaging descriptors in the context of suspicious(category 4) findings[J].Radiologia Brasileira,2016,49(3):137-143.
[4]《乳腺癌雌、孕激素受體免疫组织化学检测指南》编写组.乳腺癌雌、孕激素受体免疫组织化学检测指南[J].中华病理学杂志,2015,44(4):237-239.
[5]《乳腺癌HER2检测指南(2019版)》编写组.乳腺癌HER2检测指南(2019版)[J].中华病理学杂志,2019,48(3):169-175.
[6]邬万新,张怡,郭志琴,等.Ki67检测结果与乳腺癌临床病理指标的相关性分析[J].中华病理学杂志,2015,44(9):657-658.
[7]王自豪,李玉龙,彭德峰,等.乳腺导管原位癌的病理分级与分子表达的相关性研究[J].医学理论与实践,2020,33(4):527-529.
[8]王肖寒,于理想,余之刚,等.乳腺导管原位癌浸润转化及预后的研究进展[J].中国肿瘤外科杂志,2020,12(4):311-315.
[9]郭瑶,权毅.乳腺导管原位癌发生微浸润的影响因素分析[J].山东医药,2017,57(24):86-88.
[10]孙亚冬,李连方,刘山青,等.乳腺导管原位癌与导管原位癌伴微浸润的临床病理特点及预后对比分析[J].中国实验诊断学,2019,23(5):818-822.
[11] ?ztürk M,Polat A V,Süllü Y,et al.Background parenchymal enhancement and fibroglandular tissue proportion on breast MRI:correlation weth hormone receptor expression and molecular subtypes of breast cancer[J].J Breast Health,2017,13(1):27-33.
[12]袁明明,任晓燕,陶玉梅,等.P53在浸润性乳腺癌中的表达及意义[J].天津医药,2019,47(2):167-170,227.
[13]易清清,杨荣,梁冬雨,等.P53表达与乳腺癌患者复发转移及预后的关系[J].检验医学,2019,34(12):1107-1110.
[14]马发鹏,常宝,王时茂,等.乳腺导管原位癌X线特征与病理核分级及不同肿瘤因子表达相关性[J].放射学实践,2020,35(6):731-735.
[15]蔡斌,张曦,李莉,等.乳腺X线检查中浸润性导管癌与导管原位癌钙化的组织病理学特征[J].新疆医科大学学报,2013(1):62-65.
[16]周敬勉,黄枢,姚丽婷,等.超声对乳腺导管原位癌的早期诊断价值[J].肿瘤影像学,2019,28(3):161-164.
[17] Wang L C,Sullivan M,Du H,et al.US appearance of ductal carcinoma in situ[J].Radiographics,2013,33(1):213-228.
[18]余蓉,李胜利,陈琮瑛,等.钙化和无钙化乳腺导管原位癌超声及组织病理学特征差异分析[J].中华超声影像学杂志,2016,6(25):P506-509.
[19] Mun H S,Shin H J,Kim H H,et al.Screening-detected calcified and non-calcified ductal carcinoma in situ:differences in the imaging and histopathological features[J].Clin Radiol,2013,68(1):e27-35.
[20]陈文静,张江宇,陈中扬,等.乳腺导管原位癌分子分型的临床研究[J].中华乳腺病杂志,2017,11(5):262-265.
(收稿日期:2020-12-23) (本文编辑:周亚杰)
