超滤-高效液相色谱法研究米卡芬净对头孢曲松血浆蛋白结合率的影响
2021-05-06吴瑕马颖超刘秀菊杨秀岭董维冲殷立新河北医科大学第二医院药学部石家庄050000
吴瑕,马颖超,刘秀菊,杨秀岭,董维冲,殷立新(河北医科大学第二医院药学部,石家庄 050000)
头孢曲松为第三代头孢菌素,对大肠埃希菌、肺炎克雷伯菌、流感嗜血杆菌等革兰氏阴性菌,及甲氧西林敏感金黄色葡萄球菌、肺炎链球菌等革兰氏阳性菌均具有良好抗菌活性[1]。棘白菌素类抗真菌药,用于治疗曲霉菌属、念珠菌属等引起的深部真菌感染[2]。临床治疗病原菌不明的严重感染时常需联合使用抗细菌、真菌药物以求对致病菌的广覆盖[3],头孢曲松与米卡芬净联合应用可作为一种抗感染治疗方案应用于临床。
头孢曲松和米卡芬净具有相似的药动学(pharmacokinetics,PK)特征,血浆蛋白结合率(plasma protein binding,PPB)高、表观分布容积小、半衰期长[4],高PPB 的药物合用可能因竞争血浆蛋白而增加游离型药物浓度,同时也增加表观分布容积[5],使药物PK 发生改变。目前国内外尚无两药合用时头孢曲松PPB 变化的报道,本试验采用超滤-高效液相色谱法测定正常人血浆中头孢曲松的游离药物浓度及PPB,并进一步考察米卡芬净对头孢曲松体外PPB 的影响。
1 材料
1.1 仪器
Waters e2695 高效液相色谱仪(配2489 型紫外检测器),Diamonsil C18(150 mm×4.6 mm,5 μm)色谱柱;超滤离心管(0.5 mL,10 kD,美国 Millipore公司);离心机(ABBOTT,德国);涡旋混合器(XW-80A,上海医科大学仪器厂);低温冰箱(MDF-U2086S,日本三洋);冷藏柜(YC-180,澳柯玛);电子分析天平(CPA225D,德国 Sartorius);pH 计(pH213,意大利 HANNA)。
1.2 试药
头孢曲松对照品(批号:130480-201704,含量:83.9%)、内标头孢呋辛对照品(批号:130493-201706,含量:91.9%)(中国食品药品检定研究院);注射用米卡芬净钠(批号:027880,Astellas Pharma Tech Co.,Ltd.Takaoka Plant);人血浆由河北省血液中心提供;乙腈(分析纯,赛默飞世尔科技有限公司);其他试剂均为分析纯;水为蒸馏水。
2 方法与结果
2.1 色谱条件
色谱柱:Diamonsil C18(150 mm×4.6 mm,5 μm);流动相:乙腈-0.03 mol·L-1磷酸二氢钾溶液(12∶88,V/V,三乙胺调pH 7.5);流速:1.0 mL·min-1;柱温:30℃;检测波长:254 nm;进样量:10 μL。
2.2 溶液的配制
① 分别精密称取头孢曲松、米卡芬净钠11.92 mg、25 mg,分别置于10 mL 量瓶中,用水溶解定容,配制成1 mg·mL-1头孢曲松对照品溶液、2.5 mg·mL-1米卡芬净药品溶液,4℃冰箱储存备用。
② 精密称取内标头孢呋辛对照品10.88 mg置于50 mL 量瓶中,用水溶解定容,配制成200 μg·mL-1内标溶液,4℃冰箱储存备用。
2.3 血浆样品处理
2.3.1 游离型药物浓度测定的样本处理 取血浆500 μL 加入到超滤离心管内管中,室温12 639 r·min-1离心10 min,弃去超滤液,将内管中的血浆加至500 μL,重复上述操作1 次,取超滤液进行分析。
2.3.2 总血药浓度测定的样本处理 参考文献[6]的方法并进行改良,于1.5 mL 离心管中加入200 μL 血浆及20 μL 内标头孢呋辛溶液,加入300 μL甲醇沉淀蛋白,涡旋1 min,13 000 r·min-1离心10 min,取上清液进行分析。
2.4 方法专属性
取人空白血浆、人空白血浆+头孢曲松对照品+注射用米卡芬净钠、人空白血浆+头孢曲松对照品+内标头孢呋辛对照品,分别按“2.3.1”项下方法处理后进行分析并记录色谱图。头孢曲松和内标的保留时间分别为7.36 min、20.41 min,峰形良好,米卡芬净在监控时间30 min 内未洗脱,人血浆中的内源物质不干扰测定,结果见图1。
图1 头孢曲松高效液相色谱图Fig 1 HPLC chromatogram of ceftriaxone
2.5 方法学考察
2.5.1 游离型药物浓度测定 用人空白血浆超滤液逐步稀释头孢曲松对照品溶液,制得质量浓度为0.5、1、5、10、20、50、100 μg·mL-1系列样品溶液进行分析。以质量浓度为横坐标(x),峰面积为纵坐标(y)作线性回归分析(权重因子1/c2),标准曲线方程为y=2.18×104x-4.45×103,r=0.9999,表明头孢曲松游离质量浓度在0.5 ~100 μg·mL-1与峰面积线性关系良好。检测限(S/N=3)为0.05 μg·mL-1,定量限(S/N=10)为0.1 μg·mL-1。
2.5.2 总血药浓度测定 将不同质量浓度的头孢曲松对照品溶液置于1.5 mL 离心管中常温氮气吹干,加入空白血浆,制成质量浓度为5、10、50、100、200、500 μg·mL-1的头孢曲松血浆样品,按“2.3.2”项下方法处理,取上清液进行分析。以待测物质量浓度为横坐标(x),待测物与内标物峰面积比值为纵坐标(y)作线性回归分析(权重因子1/c2),标准曲线方程为y=0.0539x+0.0463,r=0.9998,表明头孢曲松总质量浓度在5 ~500 μg·mL-1与峰面积线性关系良好。
2.5.3 精密度试验 取人空白血浆超滤液配制低、中、高质量浓度(1、10、80 μg·mL-1)的头孢曲松对照品溶液各5 份,在1 d 内分析,按随行标准曲线计算日内精密度;再连续5 d 分析,计算日间精密度。结果低、中、高浓度日内精密度RSD分别为1.6%、2.4%和 2.1%,日间精密度RSD分别为1.9%、2.9%和 2.7%。
2.5.4 稳定性试验 取人空白血浆配制低、中、高质量浓度(10、200、400 μg·mL-1)的头孢曲松血浆样品各5 份,涡旋混匀,37 ℃水浴0.5 h,按“2.3.2”项下方法处理后4℃冰箱放置0、1、2、4 h 后进行测定,考察处理后4℃放置稳定性;血浆样品于-40℃冰箱低温保存5 d,考察低温保存稳定性;血浆样品反复冻融3 次,考察反复冻融稳定性。结果RSD均<10%,表明在上述条件下相关样品均稳定。
2.5.5 超滤膜回收率 将低、中、高质量浓度(1、10、80 μg·mL-1)的头孢曲松对照品溶液进行超滤离心,考察超滤离心次数对超滤膜回收率的影响。试验表明经1 次超滤离心后待测物的回收率还较低(低、中、高浓度分别为86.40%、83.26%、82.89%);经2 次超滤离心后待测物的回收率提高(低、中、高浓度分别为97.09%、95.64%、96.82%),第3 次超滤离心回收率无明显增加(低、中、高浓度分别为98.52%、95.43%、97.01%),因此确定经2 次超滤离心后的超滤液用于分析,非特异性吸附造成的待测物浓度损失可忽略。
2.5.6 平衡时间的考察 用人空白血浆配制低、中、高质量浓度(10、100、300 μg·mL-1)的头孢曲松血浆样品,涡旋混匀,37 ℃水浴0.5、1、1.5、2 h,考察头孢曲松与血浆白蛋白达到平衡所需的时间。结果表明37 ℃水浴0.5 h 头孢曲松游离浓度维持稳定。
2.5.7 超滤离心时间的考察 以不漏蛋白且超滤液体积与超滤前血浆总体积的比值在0.3 ~0.6 为标准[7],考察最佳的超滤离心条件为室温12 639 r·min-1,离心10 min。
2.6 米卡芬净对头孢曲松PPB 的影响
配制100、300、500 μg·mL-1的头孢曲松血浆样品,涡旋混匀,37℃水浴0.5 h,每个质量浓度分别取适量按照“2.3.2”项下方法测定总血药浓度(Ct),剩余血浆按照“2.3.1”项下方法测定游离浓度(Cf),计算头孢曲松PPB =[(Ct-Cf)/Ct]×100%。
在上述血浆样品中加入不同质量浓度的注射用米卡芬净钠溶液,得到约含2、10、20 μg·mL-1米卡芬净的头孢曲松血浆样品,考察米卡芬净对头孢曲松PPB 的影响。
用SPSS 20.0 软件配对样本t检验进行统计分析,结果发现,随着血浆中头孢曲松浓度的升高,其体外PPB 下降明显(P<0.05)。低、中、高质量浓度(2、10、20 μg·mL-1)米卡芬净对头孢曲松的PPB 均无显著影响。结果见表1。
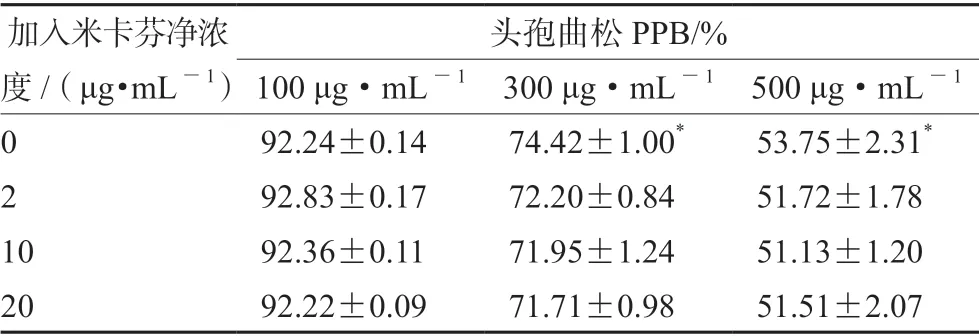
表1 米卡芬净对头孢曲松PPB 的影响(n =3)Tab 1 Effect of micafungin on the plasma protein binding rate of ceftriaxone (n =3)
3 讨论
头孢曲松为亲水性抗菌药物,不易透过脂质细胞膜,主要分布于血液和体液中,PPB 约为85%~95%,评价该药的药动/药效学指数为抗菌药物游离浓度超过最低抑菌浓度(minimal inhibitory concentration,MIC)的时间(time,T)占给药间隔的比率,即f%T>MIC[8],因为只有游离型药物才能从血液向组织中转运,在感染部位发挥抗菌作用。当患者处于某些特殊病生理状态时,如低蛋白血症、肝炎、肝硬化、尿毒症、肾病综合征等,PPB 会发生改变而影响游离药物浓度[9]。本研究建立了超滤-高效液相色谱法测定头孢曲松游离药物浓度,较传统的平衡透析法操作简单、耗时短,可用于临床样本的测定。
超滤离心管滤膜孔径的选择,头孢曲松主要与人血清白蛋白(HSA)结合,白蛋白分子量为66.3 kD,选择常用的截留分子量为10 kD 的超滤离心管可满足测定要求。
头孢曲松在体内不被代谢,试验测定无需考虑代谢产物的影响。健康人群静脉滴注头孢曲松0.5、1、2 g,稳态时Cmax分别为80、150、250 μg·mL-1,临床治疗中度敏感菌引起的感染或细菌性脑膜炎时,单次剂量最大可给予4 g,因此本研究考察了头孢曲松血药浓度为100、300、500 μg·mL-1时的PPB 值。有研究给予健康人群静脉滴注米卡芬净50、100、150 mg,Cmax分别为2.68、5.53、8.26 μg·mL-1,临床治疗严重或难治性曲霉菌病时单次剂量可增至300 mg,Cmax与给药剂量基本呈线性关系[10],因此本研究考察了2、10、20 μg·mL-1米卡芬净对不同浓度头孢曲松PPB 的影响。
头孢曲松可在HSA 的位点Ⅰ(华法林结合位点)上通过氢键和范德华力可逆性结合[11],且结合具有饱和性,随着药物浓度增加,蛋白上的结合位点趋于饱和,导致游离药物比率加大,本试验也验证了随着头孢曲松血药浓度的升高PPB明显下降,但下降幅度与 Perry 等[12]报道的随着头孢曲松血清浓度从0.5 mg·L-1升高至300 mg·L-1,游离部分从4%增加到17%存在一定差异。由于体外试验无法完全模拟药物在体内分布和消除的动态过程,需进一步开展体内研究。
试验证明米卡芬净对头孢曲松PPB 影响小,仅可使高浓度头孢曲松的PPB 下降约4%,这是因为头孢曲松结合常数(Ka)大,为3.67×104M-1[13],与HSA 的结合能力强,不易被米卡芬净置换;头孢曲松治疗窗较宽,安全性好,推测两药合用时不会因为头孢曲松游离浓度的少量升高而引起不良反应,但这一结论仍有待临床进一步观察验证。
