磁共振T1、T2 值在脑胶质瘤分级及细胞增殖活性预测中的临床价值
2021-05-06谢佳培张卫东朱婧怡吴业君杨帆肖亮
谢佳培,张卫东,朱婧怡,吴业君,杨帆,肖亮*
作者单位:1.中国医科大学附属第四医院,沈阳110000;2.中国医科大学附属第一医院,沈阳110000
脑胶质瘤是颅内最常见的原发肿瘤,可分为高级别胶质瘤(high grade glioma,HGG)和低级别胶质瘤(low grade glioma,LGG)两类。不同级别的脑胶质瘤,其增殖活性及恶性程度不同,HGG和LGG的区分,有助于治疗方案制定和预后评估[1-2]。Ki-67是一种增殖细胞相关的核抗原,可以反映肿瘤细胞的增殖活性[3],与肿瘤的分化程度、浸润和预后密切相关[4-5]。然而,脑胶质瘤的分级和Ki-67标记指数(Ki-67 LI)的检测有赖于组织活检或手术切除组织,因此,术前无创预测脑胶质瘤分级及Ki-67表达水平具有重要的临床意义。
磁共振成像为诊断脑胶质瘤主要的影像学检查,而常规MRI缺乏标准的、可量化的参数,对脑胶质瘤分级及增殖活性的评估有一定的局限性。测量T1、T2 值的方法很早就有,但由于采集时间长等原因,多用于实验研究,尚未应用于临床。多对比度一站式弛豫定量技术(magnetic resonance imaging compilation,Magic)可以从一次扫描中得到多种不同对比度的图像,大大减少了扫描时间,同时可以获得具有组织弛豫特性的定量指标T1、T2 值[6-7],从而为疾病的定量诊断提供更多的信息。研究表明,Magic 序列具有可与常规扫描相媲美的图像质量[7],然而,T1、T2 值对于脑胶质瘤分级及增殖活性的预测少有报道。本研究中,对脑胶质瘤患者进行Magic扫描,定量分析T1、T2 值,评价其在病理分级及细胞增殖活性预测中的诊断价值。
1 材料与方法
1.1 一般材料
收集2018年10月至2020年8月于中国医科大学附属第一医院放射科进行颅脑MRI扫描,经手术病理证实为脑胶质瘤的患者36例,其中男19例,女17例,年龄29~69岁,平均年龄为52.4岁。纳入标准:(1)患者术前接受Magic 序列扫描;(2)患者在行MRI 检查前未接受与肿瘤相关的任何治疗;(3)术后病理证实为胶质瘤患者,免疫组化结果可获得;(4)所有患者的MRI 检查与手术间隔均小于1 周。排除标准:(1)脑胶质瘤复发患者;(2)图像伪影重,影响结果评估。按照2007 年WHO 分级标准[8],其中高级别(Ⅲ、Ⅳ级)有21 例,低级别(Ⅰ、Ⅱ级)有15 例。伦理委员会免除伦理审查。所有病例均签署磁共振检查知情同意书。
1.2 数据采集
所有患者均在带有21 通道头部线圈的3.0 T MRI系统(GE公司3.0 T Pioneer,美国)上进行MRI扫描。Magic 序列取轴位,增强前后各扫一次,其扫描参数均为:TR 4000 ms,TE 19ms,层厚5 mm,FOV 220 mm×220 mm,矩阵320×192,回波长度16,激励次数2,扫描时间4 min 32 s。对比剂为钆特酸葡胺,剂量为0.1 mmol/kg,经肘静脉注入。注射对比剂后8 min进行Magic对比增强扫描。
1.3 图像后处理及参数测量
Magic 序列直接在主扫描控制台处理,自动生成T1 mapping、T2 mapping,在增强后的T1WI 图像上,选择肿瘤实质内强化明显且均匀的部分(若无强化,选择T2 FLAIR 上等或高信号区域),及对侧镜像部位的正常脑白质,并避开坏死、出血、囊变和钙化等区域,病变及对侧分别勾画3~5 个感兴趣区(region of interest,ROI),其大小、数量均保持一致。测量各ROI 增强前T1 值(T1-pre)、T2 值(T2-pre)及增强后的T1 值(T1-Gd),取平均值,并计算增强前后的T1 差值(ΔT1)、T1 值 变化 百 分比(ΔT1/T1-pre×100%)。对Magic定量参数进行校正处理,用肿瘤区参数值除对侧镜像部位正常脑组织参数值,得到增强前T1 比值(ratio of T1-pre,rT1-pre)、T2 比 值(ratio of T2-pre, rT2-pre) 及增强后T1 比值(ratio of T1-Gd,rT1-Gd)。
1.4 病理检查
术后取脑胶质瘤标本实质部分进行HE 染色及Ki-67 免疫组化染色,作出病理诊断。使用Ki-67 抗体进行Ki-67蛋白的免疫组化分析,细胞核内出现棕褐色染色颗粒表示Ki-67染色阳性,对阳性细胞染色最高的区域进行计数。根据5 个高倍镜视野的平均阳性细胞率,以百分数表示Ki-67 LI,代表肿瘤细胞的增殖活性。
1.5 统计学分析
所有数据均采用SPSS 20.0软件进行分析,各组进行正态分布及方差齐性检验,符合正态分布及方差齐者以±s表示,不符合正态分布的用中位数(上、下四分位数)表示。用Spearson 相关分析分析各项Magic参数值及Ki-67 LI之间的相关性;采用独立样本t 检验或Mann-Whitney U 检验分析脑胶质瘤高低级别组间Magic 参数值及Ki-67 LI 之间的差别。当P<0.05 时,具有统计学差异。对差异具有统计学意义的MRI 参数进行ROC 曲线分析得出最佳诊断阈值,从而获得诊断的敏感度、特异度及曲线下面积。
2 结果
2.1 高低级别组间Magic定量参数及Ki-67 LI的差异
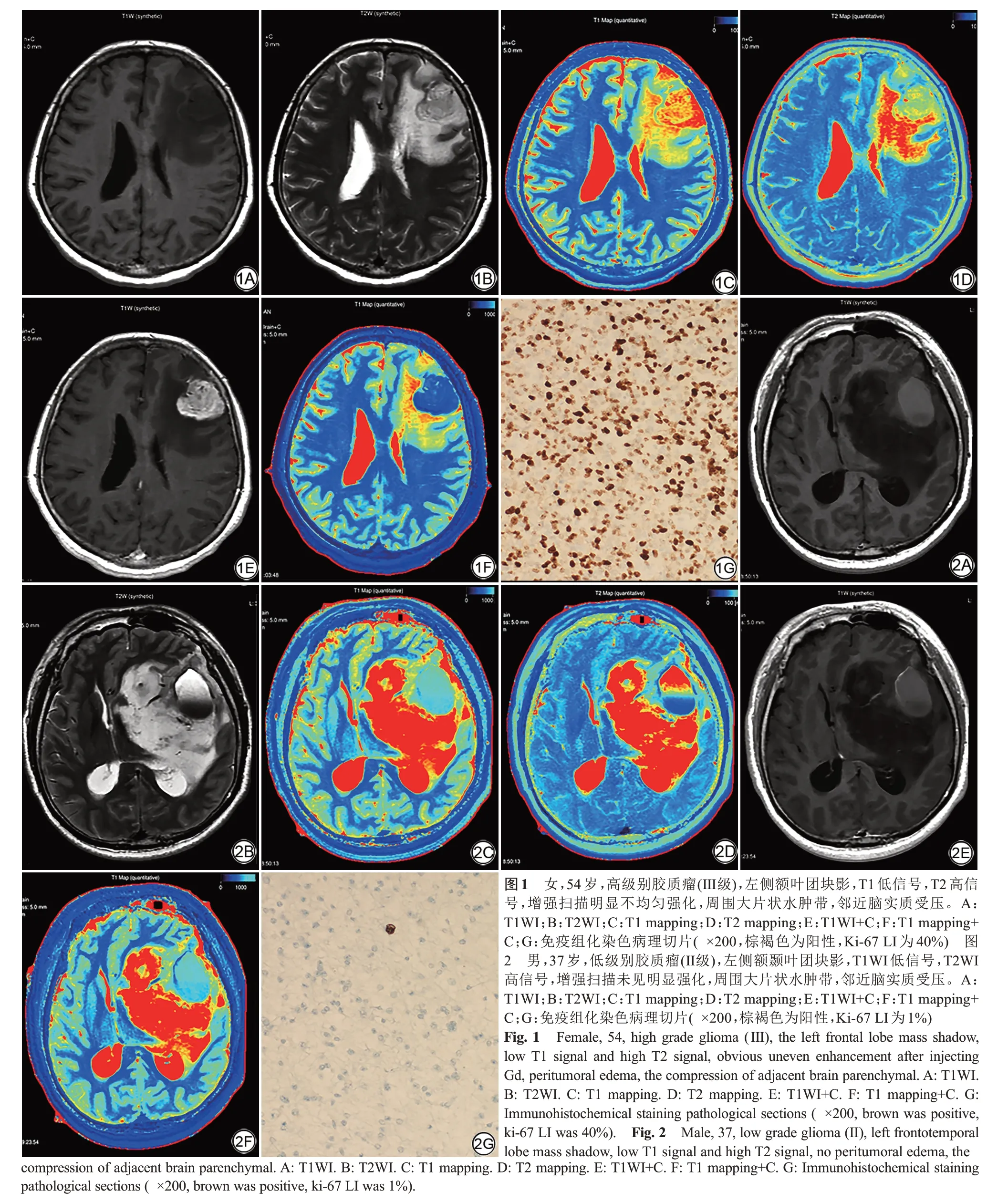
高级别组胶质瘤T1-pre (P=0.006)、ΔT1 (P=0.001)、T1 值变化百分比(P=0.003)、Ki-67 LI (P=0.000)明显高于低级别组,T1-Gd (P=0.006)、rT1-Gd(P=0.007)低于低级别组,差异均具有统计学意义。rT1-pre、T2-pre、rT2-pre 在两组之间无明显差异(表1)。ROC 曲线分析可得T1-pre、T1-Gd、rT1-Gd、ΔT1、T1 值变化百分比曲线下面积分别为0.759、0.752、0.746、0.816、0.790 (表2),其中ΔT1 对区分高、低级别胶质瘤的效能最好,其最佳诊断阈值为373.25 ms,敏感度为90.5%,特异度为60%,P=0.001。高、低级别胶质瘤的常规MRI、T1 mapping、T2 mapping及免疫组化病理切片如图1、2所示。
2.2 脑胶质瘤Magic定量参数与Ki-67 LI间的相关性
T1-pre (r=0.502,P=0.002)、rT1-pre (r=0.331,P=0.048)、T1-Gd (r=-0.351,P=0.036)、ΔT1 (r=0.537,P=0.001)、T1 值变化百分比(r=0.473,P=0.004)均与Ki-67 LI 具有显著相关性,均具有统计学意义。此外,其余各项参数与Ki-67 LI 无明显相关性,详见表3。
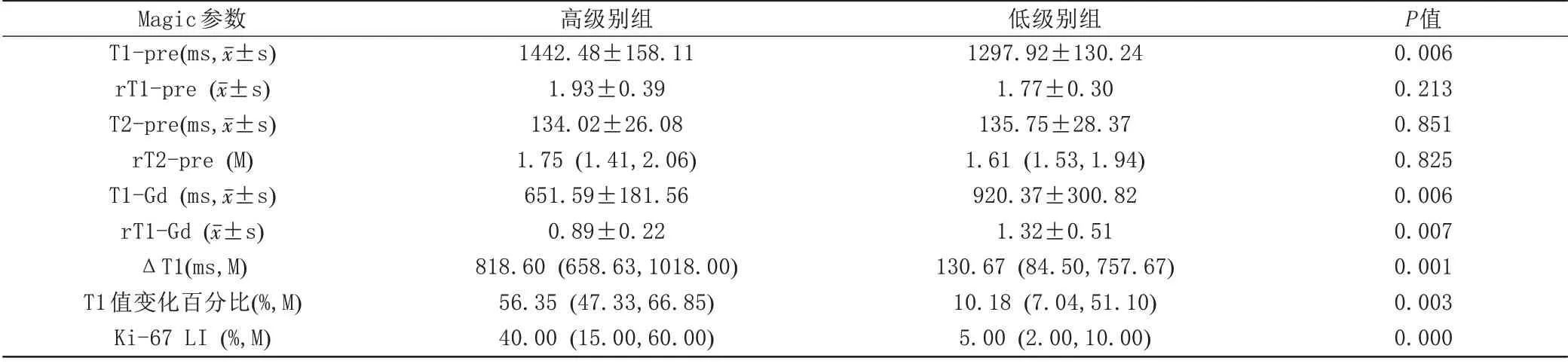
表1 高、低级别胶质瘤Magic参数及Ki-67 LI的比较结果Tab.1 Comparison of Magic parameters and Ki-67 LI between high and low grade glioma
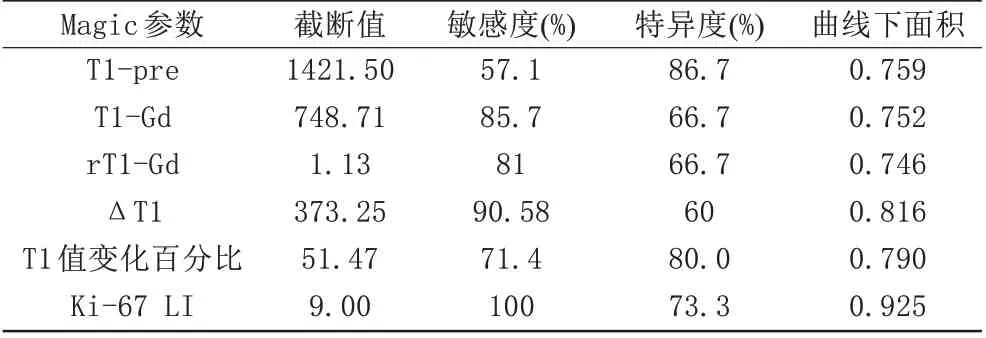
表2 Magic参数及Ki-67 LI在最佳截断值区分高、低级别胶质瘤的敏感度、特异度、曲线下面积Tab.2 Sensitivity,specificity and area under the curve of Magic parameters and Ki-67 LI for distinguishing high and low grade gliomas under the optimal truncation value
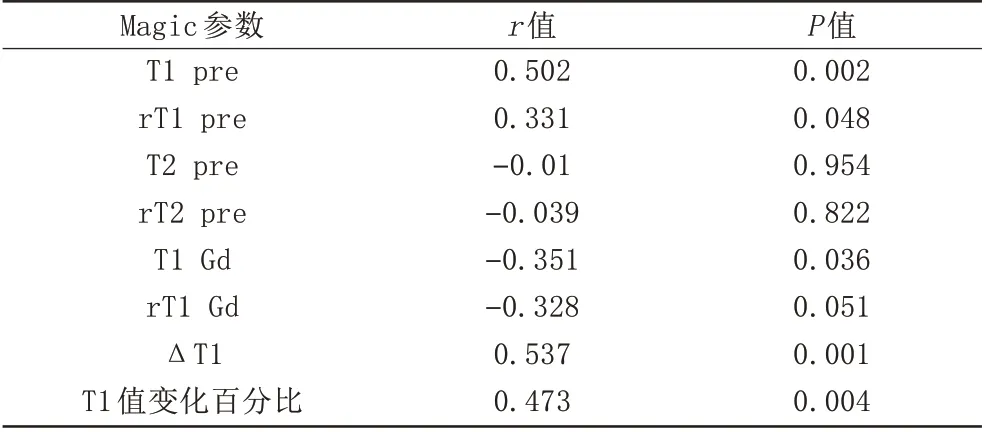
表3 Magic参数与KI-67 LI的相关性Tab.3 Correlation between Magic parameters and KI-67 LI
3 讨论
3.1 影像学检查在脑胶质瘤分级及肿瘤细胞增殖活性预测中的应用
磁共振成像是临床常用的影像学检查,其信号强度受很多因素影响,直接测量信号强度的绝对值并不能精确地反映组织特性。常规的MRI 无法获得组织的T1、T2值,对脑胶质瘤分级的评估具有一定的主观性。Law 等[9]对160 例胶质瘤患者的常规MRI 进行了分析,包括八个指标:对比剂增强、边界清晰度、肿块效应、信号强度的不均一性、出血、坏死、水肿程度、累及胼胝体或越过中线。综合分析发现常规MRI检测HGG 的敏感度为72.5%,特异度为65.0%。此外,功能磁共振技术可以对脑胶质瘤进行分级及预测肿瘤细胞的增殖活性。Bai 等[10]对69 例胶质瘤患者进行扩散加权成像和扩散峰度成像,发现平均峰度值(mean kurtosis,MK)在鉴别HGG 与LGG 方面具有更显著的诊断效能,可作为胶质瘤分级的最佳扩散参数。Zhang等[11]发现MK与Ki-67 LI显著相关(r=0.791,P<0.001),在无创性评估肿瘤细胞增殖方面有很大的潜力。Fudaba 等[12]发现Cho/Cr、Lac/Cr 与Ki-67 LI 成正相关(r=0.461、0.418),两者可对HGG 与LGG 进行区分差异具有统计学意义。Jain 等[13]采用动态对比增强MRI 对脑胶质瘤患者进行扫描并测量相对脑血容量(relative CBV,rCBV),结果发现rCBV 可以鉴别HGG 与LGG,并 与Ki-67 LI 正 相 关(r=0.580)。Suh等[14]进行了一项Meta 分析,发现酰胺质子转移成像的信号强度与Ki-67 LI 的相关系数在0.430~0.597 之间,呈中度相关。但这些成像方法存在扫描时间长或图像后处理复杂等问题,具有一定的限度。
3.2 定量T1、T2值在脑胶质瘤分级中的应用
高级别脑胶质瘤相较于低级别其恶性程度更高,恶性程度高的肿瘤具有更多的异质性组织结构[15],两者组织成分的比例不同,相应的T1、T2 值也可能存在差异,定量测量T1、T2值对评估脑胶质瘤分级可能具有一定的临床价值。
T1弛豫时间是MRI的一个基本的物理量,主要受间质含水量的影响[16]。本研究发现,高级别胶质瘤的T1-pre、ΔT1、T1 值变化百分比高于低级别胶质瘤,T1-Gd、rT1-Gd 低于低级别胶质瘤。这与王佳男等[17]的研究结果基本一致,他们发现增强后T1 值及增强后T1 值变化的百分比可以区分HGG 与LGG,但他们发现增强前T1值在区分高低级别胶质瘤时无统计学意义,这可能是与病例样本量较少有关。经ROC曲线分析得到ΔT1 对区分HGG、LGG 的效能最高,当ΔT1≥373.25 ms 时,倾向于高级别胶质瘤的诊断。因此ΔT1可以作为胶质瘤分级诊断的最佳指标。
Hattingen等[18]强调了T2 mapping的重要性,他们发现相比于常规MRI,T2 mapping 可以通过T2 弛豫时间的变化,更早的检测到肿瘤的进展。然而,在鉴别高、低级别脑胶质瘤方面尚未发现T2 值的应用价值,Kern等[19]对定量T2 mapping进行了研究,发现Ⅲ级胶质瘤的T2 值高于Ⅱ级胶质瘤,但无显著性差异。这与本研究结果一致,本研究结果显示T2-pre、rT2-pre 在高、低级别胶质瘤组间无差异,王佳男等[17]的研究也未发现T2 值在鉴别高、低级别胶质瘤上的价值。因此,目前尚不能根据T2 值来区分高低级别胶质瘤。
此外,本组结果显示Ki-67 LI 可以区分HGG、LGG,这与以往的研究一致[20-21],可见Ki-67 LI 对脑胶质瘤的分级也有一定的临床意义。
3.3 定量T1、T2 值在脑胶质瘤细胞增殖预测中的应用
在脑胶质瘤中,Ki-67 常作为表达肿瘤细胞增殖活性的生物标志物,Ki-67 LI 越高,肿瘤细胞的增殖活性越高[21]。肿瘤的增殖活性不同,其组织间水分含量也有不同,T1 弛豫时间主要受组织间水分含量的影响[22]。因此,不同增殖活性的脑胶质瘤,所引起的T1值的变化存在一定的差异。
在以往的研究中,Olsen 等[23]采用自旋回波脉冲序列1H-MRI 对人类黑色素瘤异种移植株A-07、D-12、R-18、U-25 的T1、T2 弛豫时间进行了研究,以肿瘤体积倍增时间(volume doubling time,Tvol)、潜在倍增时间(potential doubling time,Tpot)及S 期肿瘤细胞的比例表示增殖活性,发现高增殖活性肿瘤的T1、T2 弛豫时间高于低增殖活性肿瘤。这与我们的研究基本一致,本研究发现T1-pre、rT1-pre 与Ki-67 LI 呈正相关,T1-pre、rT1-pre 与脑胶质瘤的增殖活性正相关,这在以往的研究中鲜有报道。然而本研究发现T2-pre、rT2-pre 与Ki-67 LI 之间无相关性,这可能是由于胶质瘤为恶性肿瘤,肿瘤内的成分较复杂,而T2 值尚不足以区分出两者的差别。静脉注入对比剂后,可通过受损的血脑屏障进入脑内病变组织,或滞留于病灶内缓慢的血流中。病灶是否强化以及强化的程度,与病变组织血供是否丰富以及血脑屏障被破坏的程度有关。因此,高度恶性的胶质瘤血脑屏障破坏严重,T1 缩短比低度恶性胶质瘤明显。本研究结果显示ΔT1 与Ki-67 LI 呈正相关,T1-Gd 与Ki-67 LI 呈负相关,表明增殖活性越强,T1 缩短越多,T1-Gd 越低,增强前后T1 值变化越大。由此可见ΔT1值有望成为表达肿瘤细胞增殖活性的影像学指标。
因此,定量测量T1 值在脑胶质瘤细胞增殖预测中有一定的意义。此外,传统的活检方法其准确性会受到抽样误差的影响[24-25],并且由于肿瘤的异质性,组织病理学检查只能反映所取标本的生物学特性,而不能反映整个肿瘤的生物学特性[26],导致肿瘤分级不准确。本研究结果ΔT1 与Ki-67 LI 呈正相关,在临床上可为穿刺活检的确定提供一定的帮助;同时也可指导放射治疗照射野范围的确定。
3.4 研究的局限性
本研究存在的不足:本研究的样本量较少,尤其是低级别胶质瘤的患者数量较少,需要进一步扩大样本量;本研究ROI 的选择采取多层面采样,并取平均值,尽可能与Ki-67 LI一致,然而未能做到与病理标本的取材一一对应,因此所得结果可能出现一定的偏差。本研究对所取ROI的平均值进行了研究,忽略了肿瘤的异质性,Matsuda 等[27]发现在乳腺癌患者中,增强后T1 值的标准差对预测Ki-67 的表达水平有一定的帮助,这种关系可能在脑胶质瘤中也存在,需要进一步的研究。
3.5 结论
综上所述,Magic 扫描可以从一次扫描中得到多种不同对比度的图像,明显缩短扫描时间,使定量测量T1、T2 弛豫时间应用于临床成为可能。T1 弛豫时间与脑胶质瘤的分级、增殖活性之间存在相关性,可以预判脑胶质瘤的分级及增殖活性,有助于临床治疗方案的制订及预后判断。
作者利益冲突声明:全体作者均声明无利益冲突。
