生猪废水处理和磷回收工艺中抗生素和耐药细菌的削减特征
2021-05-02王蕾黄栩
王蕾,黄栩
(1. 厦门华厦学院环境与公共健康学院,福建 厦门 361024;2. 中国科学院城市环境研究所,福建 厦门 361021)
我国的城镇化进程推动着现代农业养殖向规模化和标准化发展。然而规模化养殖条件使得病原细菌更容易在养殖动物间相互传染,给动物疾病预防和治疗带来困难。为了保证预防和治疗效果,养殖户经常加大抗生素用量或者交叉使用抗生素。抗生素滥用造成的环境影响包括:1)大部分抗生素未能被动物体完全转化而随着排泄物排出进入农田和鱼塘等[1];2)动物肠道在抗生素诱导作用下会导致细菌耐药,并能通过质粒水平转移等方式将一些耐药基因转移给受纳环境中的土著微生物[2]。这些肠道耐药病原菌通过施肥和浇灌附生于农作物[3],并可能流入市场给公众健康带来巨大的威胁。面对细菌耐药事件频发,规模化养殖场一方面需要加强兽药管理,另一方面需要优化废水处理工艺条件,减少肠道耐药细菌的环境释放。因此,研究生猪养殖废水处理过程抗生素和耐药细菌变化趋势对于保护区域生态环境和居民健康具有重要科学意义。
规模化养殖场动物的排泄物,通常先经过固液分离之后,固体部分堆肥还田[4],废水部分经厌氧消解[5-6],然后通过生物氧化塘、人工湿地[7-8]和土壤渗滤等生态技术处理后排放。近年来,生猪废水中资源回收技术受到更多青睐,其中包括厌氧产沼[9]和磷酸铵镁(MAP)法磷回收[10]。生猪废水含有高浓度的氮磷元素,而磷素具有不可再生性,从生猪废水回收磷素资源既可降低环境水体富营养化风险,获得的MAP可用作缓释肥料具有较高经济价值[11]。目前,已有一些研究开展了上述废弃物处理环节中抗生素、病原菌和抗性基因的变化特征研究[2,5],其中单个环节研究较多,两个或者多个环节组合研究较少,堆肥和厌氧消解研究较多,其他环节特别磷回收工艺研究较少。因此,本文选择厦门市翔安区某生猪养殖场,根据其现有养殖废水处理设施,选择厌氧消化池、氧化池、磷回收流化床和人工湿地为取样环节。通过对养殖废水处理和资源化设施中常规水质指标、抗生素、耐药细菌削减规律的调查和分析,为养殖场耐药细菌控制的工艺强化和工艺组合措施的改进提供一定的理论依据。
1 材料与方法
1.1 样品采集和预处理
样品于2017年夏采集自厦门市翔安区中等规模生猪养殖场,该养殖场生猪常年存栏量约3 000头,日废水产生量约60 m3/d,所设废水处理设施除了常规的厌氧消化池(anaerobic digester,AD)和氧化池(oxidation pond,OP)之外,还专门配备一套磷酸铵镁(MAP)磷回收流化床装置(fluidized bed,FB),日处理量12 m3/d。实验分别采集了养殖废水原水(OW)以及厌氧消化池、氧化池和流化床的出水样品,及时运送到实验室进行预处理。除此之外,运送取自氧化池的废水回实验室,在温室条件下,以稳定运行的垂直潜流人工湿地(CW)小试装置(水力负荷10 cm/d)进行为期1个月的废水处理,期间采集出水样品。部分水样放置于4 ℃,用于水质分析、抗生素检测和耐药菌计数等常规检测,1~2天内完成;另有部分水样经过离心收集沉淀,放置于-20 ℃,用于DNA提取和微生物群落的高通量测序。实验涉及的采样工艺节点示意图参考图1。
1.2 水质分析
废水的pH值通过专门的pH值探头检测获得。水质参数包括NH4+-N、TP、TN和COD等的测定方法参考《水和废水监测分析方法(第四版)》。其中测试NH4+-N时先将水样过滤,用于TP、TN检测的水样不过滤需消解,分别添加专有试剂,用紫外分光光度计检测。用于COD检测的水样不过滤,添加试剂消解后用COD快速检测仪检测。
1.3 抗生素提取和检测
本研究选择四环素类、喹诺酮类和磺胺类抗生素中的代表,结合养殖场抗生素使用情况,最后选定OTC、CIP和SM2为目标抗生素。
抗生素提取方法:取50 ml的水样加入0.1 g Na2EDTA,用盐酸调节pH至3.0,准备固相萃取。Oasis HLB固相萃取小柱(6 mL,200 mg)在使用前依次用丙酮、甲醇和0.5%甲酸水溶液各6 mL预处理。然后将上述水样以10 mL/min左右的速度过柱,再用6.0 mL 0.5%甲酸水溶液冲淋。抽真空干燥30 min后用6.0 mL的甲醇将目标化合物洗脱到氮吹管中,用温和的氮气流将甲醇吹干。最后用1.0 mL 20%的甲醇水溶液定容,定容后溶液用0.45 μm有机滤膜过滤,4 ℃保存等待上机。
1.4 耐药菌计数
配制LB和麦康凯固体培养基,往这两种培养基里添加三种不同的抗生素:CIP(8 μg/mL)、OTC(16 μg/mL)和SM2(256 μg/mL),同时以不加抗生素为对照,制备不同的选择培养基。抗生素浓度参考抗微生物药物敏感性试验执行标准(CLSI 2014)中对各种抗生素微生物耐药水平的认定。
将上述采集的水样用0.9%的生理盐水稀释成不同的浓度梯度,然后取100 μL涂布于上述平板,28 ℃培养2天后,选菌落数适宜的平板进行计数。在LB培养基上生长的细菌代表总可培养细菌;麦康凯培养基上生长的细菌代表总可培养阴性菌,其中红色菌落主要由大肠埃希氏菌和粪链球菌组成,无色菌落由奇异变形杆菌、鼠伤寒沙门氏菌和宋内氏志贺氏菌组成。
1.5 微生物群落分析
DNA提取:水样用0.2 μm硝酸纤维滤膜过滤后用E.Z.M.A. DNA提取试剂盒(美国Omega 生物技术公司),按照说明书提取微生物基因组DNA。用微量紫外可见分光光度计(Nanodrop 2000)测定DNA样品的浓度,根据OD260/OD280和OD260/OD230判断核酸纯度。获得的DNA样品放置于-20℃备用。
基因扩增和测序:以引物515F:5‘-GTGCCAG CMGCCGCGGTAA-3’和806R:5‘-GGACTACHVGGG TWTCTAAT-3’,扩增16S rRNA基因的V4区[13],引物5’端加上独特的barcode以区别不同的样品。配制50 μL的PCR体系,以上述提取的DNA为模板,每个样品各3个重复反应。PCR过程退火温度为53℃,30个循环。将样品的3个重复反应产物合并后,用Quant-iT PicoGreen dsDNA Assay kit(Invitrogen,美国)测定DNA浓度。然后以总量相等的方式,每21~24个样品取样合并成一个文库。最后将合并后的文库用PCR产物纯化试剂盒纯化,并用QuantiT PicoGreen dsDNA Assay kit、Nanodrop 2000 和琼脂糖凝胶电泳分析纯化后DNA的浓度和质量。最后送北京诺禾致源公司测序,采用的高通量测序技术为Illumina Hiseq 2500。
测序结果分析:将获得的clean tags用Quantitative Insights Into Microbial Ecology (QIIME 1.9.0) 软件分析[14],以97%的相似性提取可操作分类单元(OTUs),获得样品中细菌和古菌从门到属的分类信息、α多样性指数(chao1, Shannon等)和β多样性分析结果。
1.6 统计分析
文中数据用Excel 2013进行基础计算,用Origin 9.0制图,以指标浓度梯级变化量占原始浓度的百分比来计算各工艺阶段对指标去除的贡献率。微生物群落的主成分分析(PCA)用Canoco 5.0软件来执行。
2 结果与分析
2.1 水质指标变化
在生猪废水处理过程中,pH值波动较为平缓,流化床提升了废水pH值,而人工湿地降低了废水pH值,主要的水质指标包括COD、TP、NH4+-N和TN呈现出总体下降的趋势(表1)。通过计算每个阶段对主要水质指标去除的贡献,发现TP的去除率最大,各节点的贡献率依次为人工湿地(53.33%)>流化床(49.94%)>氧化池(24.82%)>厌氧消化(15.13%)。人工湿地和流化床工艺都有较好的TP去除效果,但是两者的作用机制完全不同,前者主要通过填料吸附和植物吸收,后者是通过添加化学试剂实现磷回收。COD的去除率次之,各节点的贡献率依次为厌氧消化(40.28%)>人工湿地(36.30%)>流化床(18.99%)>氧化池(7.75%),说明厌氧消化是生猪废水COD降解的主要环节。人工湿地也具有较高的COD去除能力,其主要通过填料截留和微生物降解来实现。NH4+-N和TN的去除率相对要低,各节点对NH4+-N的贡献率依次为人工湿地(67.64%)>氧化池(10.26%)>流化床(8.46%)>厌氧消化(7.56%),对TN的贡献率依次为人工湿地(54.74%)>流化床(16.97%)>氧化池(7.68%)>厌氧消化(4.71%),可以看出厌氧消化对NH4+-N和TN的去除能力有限,这与生猪养殖废水具有相对较低的碳氮比有关。相比之下,人工湿地对NH4+-N和TN的去除贡献最大,主要是因为垂直流人工湿地具有较强的硝化能力。可能是由于氧化池的曝气量不足,其对NH4+-N的转化未达到较好的效果。氧化池的废水经过流化床处理后,COD已达到畜禽养殖业水污染物排放要求(400 mg/L),TP接近排放要求(8.0 mg/L),NH4+-N远未能达到排放要求(80 mg/L);而经过人工湿地处理后,COD和TP皆达到排放要求,NH4+-N接近排放要求。
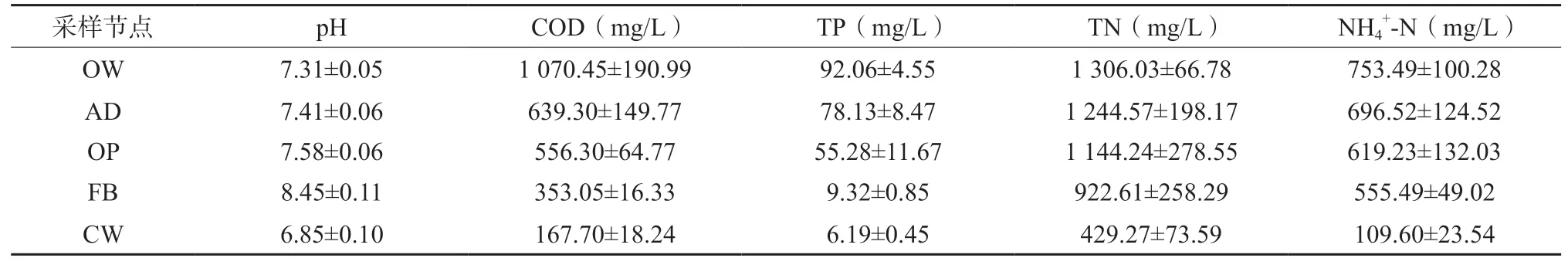
表1 生猪养殖废水处理过程水质指标的变化Table 1 The change of water quality parameters during swine wastewater treatment
2.2 抗生素浓度变化
抗生素检测数据显示:生猪废水中OTC浓度最高,达到34.60 μg/L,SM2和CIP浓度相对较低(表2),废水处理过程中抗生素浓度整体呈现出下降趋势。通过计算每个阶段对抗生素去除贡献,发现OTC和CIP具有相似的去除规律,厌氧消化池、流化床和人工湿地对两种抗生素都具有较高的去除能力,而氧化池的作用很有限。与之不同的是,厌氧消化池、氧化池和人工湿地对SM2具有较好的去除效果,但流化床的去除贡献很低。这可能与三种抗生素的化学吸附和生物降解特点有关。对比流化床,人工湿地对三种抗生素皆有较高的去除能力,而流化床对SM2的去除率很低。
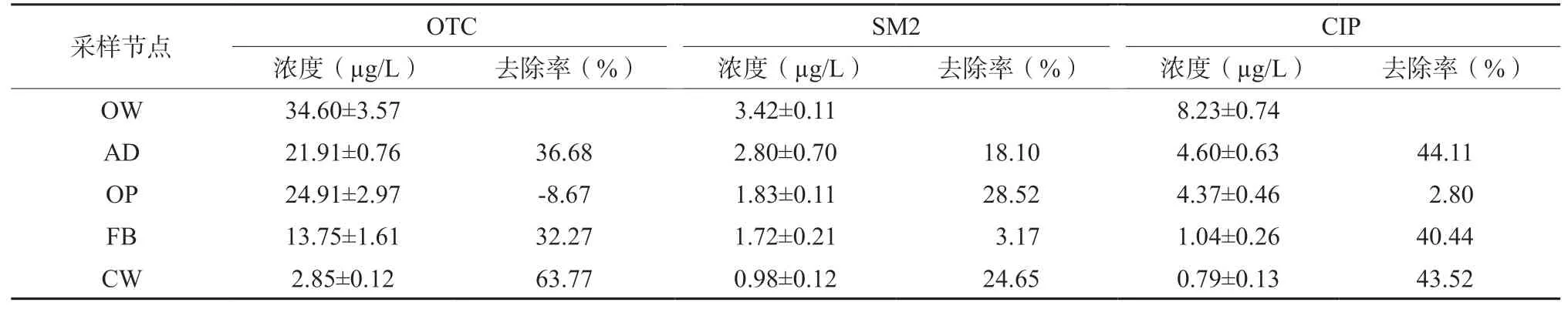
表2 生猪养殖废水处理过程抗生素浓度和去除率分析Table 2 Concentrations and removal efficiencies of three antibiotics during swine wastewater treatment
2.3 耐药细菌的鉴别和数量统计
图2展示了生猪养殖废水处理过程耐药细菌菌落丰度的变化。由于培养基的选择性,数据统计结果偶尔会出现总可培养阴性细菌数量大于总可培养细菌的情况。另外,由于部分细菌存在多重耐药,三种抗生素耐药菌的总和有可能大于总细菌数量。但这并不妨碍分析各个水处理阶段对代表性细菌去除的贡献。
我国从个人税收递延型商业养老保险开始试点,探索建立我国个人养老金体系。试点区域为上海市、福建省(含厦门市)和苏州工业园区,为期一年。我国个人养老金计划坚持账户多元化金融投资的方向,待试点结束后,还将根据试点情况有序扩大参与的金融机构和产品范围,将公募基金等产品纳入个人商业养老账户投资范围。
以大肠埃希氏菌和粪链球菌为主的红色菌落来看,在耐药细菌数量的比较上, OTC的耐药细菌数高于SM2,远高于CIP(差一个数量级)。无论是无抗条件下的细菌数还是耐药细菌数,在各废水处理环节中都是持续降低,其中厌氧消化池的贡献最大,超过80%,人工湿地的去除效果优于流化床。
从奇异变形杆菌、鼠伤寒沙门氏菌和宋内氏志贺氏菌为主的无色菌落来看,在耐药细菌数量的比较上,与红色菌落相似,同样是OTC的耐药细菌数最大,其次是SM2,再次是CIP,OTC的耐药细菌数要比CIP多一个数量级。在各处理环节的贡献方面,与红色菌落有所差异,厌氧消化对无抗条件下的细菌和OTC耐药菌的去除贡献占50%~60%以上,氧化池的去除贡献占25%以上。此外,无色菌落在流化床中去除效果不显著,但在人工湿地中仍具有不同程度的去除。
根据红色菌落和无色菌落平板计数的结果,对总可培养阴性细菌进行统计。可以看出,OTC的阴性耐药细菌与无抗条件下的阴性细菌数量很接近,说明大部分阴性细菌都具有OTC耐药性。而CIP的阴性耐药细菌数要比它们低1个数量级,说明仅有10%的可培养阴性菌具有CIP耐药性。厌氧消化对OTC的阴性耐药细菌的去除贡献大于60%,对SM2的阴性耐药细菌的去除贡献大于80%,对CIP阴性耐药细菌的去除贡献大于90%。而氧化池对OTC的阴性耐药菌的去除贡献大于20%,这是另外两种抗生素的阴性耐药菌所不具备的。若以氧化池的数据为起始计算,人工湿地对3种抗生素阴性耐药细菌后续去除率大于80%;而流化床仅对CIP的阴性耐药细菌的去除率接近30%。
总可培养细菌的计数结果显示,在无抗LB培养基上总可培养细菌的数量要大于耐药菌;相较总可培养阴性耐药细菌,三种抗生素之间总可培养耐药细菌的数量差距比较小,说明CIP的总可培养耐药细菌是以革兰氏阳性菌为主。比较各处理阶段,厌氧消化是细菌数量降低的主要环节,去除贡献都达到90%以上。若以氧化池的数据为起始计算,人工湿地对3种抗生素耐药细菌的后续去除率达到60%~80%;而流化床对OTC和SM2的耐药细菌的去除率分别近30%和80%,但CIP的耐药细菌数量反而有所升高。
2.4 微生物群落组成变化和病原菌的消减
在废水处理过程中,由于水质参数的变化,微生物群落也在发生巨大的变化。如图3所示,在门水平上,尽管原水、厌氧消化池和氧化池的主要微生物组成相似,但可以看出拟杆菌门(Bacteroides)的占比在逐渐上升,而厚壁菌门(Firmicutes)的占比在逐步下降。在流化床阶段,变型菌门(Proteobacteria)的占比大幅上升,厚壁菌门的占比小幅上升,而拟杆菌门的占比大幅下降。与氧化池相比,人工湿地环节的拟杆菌门和厚壁菌门占比都下降,而变型菌门和古菌Parvarchaeota明显增加。这些结果说明随着处理层级的增加,微生物群落变化越来越大,尤其是到了流化床和人工湿地阶段。
在门水平上,我们继续对生猪废水处理过程各环节的微生物群落进行主成分分析(PCA),探查主要微生物门类在各个环节的分布情况(图4)。从图上可以清楚看出,原水、厌氧消化池和氧化池样品的微生物群落相似度较高,遗传距离接近,相比之下,流化床和人工湿地样品微生物群落与他们存在非常大的差异,并流化床和人工湿地之间也存在微生物群落的巨大差异。主要的微生物门类中,拟杆菌门、疣微菌门(Verrucomicrobia)和螺旋体门(Spirochaetes)主要分布在原水、厌氧消化池和氧化池样品中;蓝细菌门(Cyanobacteria)、浮霉菌门(Planctomycetes)、Parvarchaeota、黏胶球形菌门(Lentisphaerae)主要分布在人工湿地样品中;变型菌门更多分布于流化床样品中;此外,厚壁菌门在除了人工湿地外的样品均有较多的分布。PCA分析结果直观明了地显示出废水处理各个环节微生物群落分布的差异。
根据毒力因子数据库网站(http://www.mgc.ac.cn/cgi-bin/VFs/jsif/main.cgi)提供的病原细菌菌属信息,对各个环节废水中病原菌的占比进行统计,分析生猪废水处理过程中病原细菌的变化趋势(图5)。原水中占比较大的病原菌依次为梭菌属(Clostridium)>假单胞菌属(Pseudomonas)>链球菌属(Streptococcus)>不动细菌属(Acinetobacter)。随着废水处理的进行,从原水到流化床,梭菌属、链球菌属和不动细菌属都经历逐渐的下降过程,病原细菌总量有近50%幅度的下降。从原水到人工湿地,病原细菌总量下降幅度更大,超过85%,而且病原菌各分类的占比也发生巨大的改变,梭菌属和假单胞菌属的占比大幅度下降,但不动细菌属和芽孢杆菌属(Bacillus)的占比有些上升。
3 讨论
水质达标排放是生猪废水处理工艺设计和运行的首要目标。厌氧消化能将可降解有机质分解为CH4和CO2。在本调查研究中,厌氧消化池对COD的去除贡献最大,达到40.28%(表1)。尽管人工湿地也能较大程度降低COD,但未能实现有机质能源化的目的。可见厌氧消化池确实是生猪废水资源化不可缺少的工艺环节。在TP的去除方面,尽管人工湿地对TP具有最好的去除效果,但其主要通过填料吸附[11]和植物吸收[16],在废水磷浓度高的情况下,容易出现吸附饱和。本研究中磷酸氨镁流化床工艺对TP的回收去除接近50%,该技术是通过化学结晶的方法,将PO43-和部分NH4+结晶化颗粒化[17],水体中的PO43-浓度越高越有利于结晶化,但厌氧消化和氧化池阶段,已经共近40%TP被悬浮物吸附沉降,影响到流化床技术的效率最大化。经过流化床处理后TP浓度仍有些微大于达标排放浓度,这与该技术结晶临界浓度有关,或许可通过技术改良得到解决。
本调查研究中,厌氧消化、氧化池和流化床对NH4+-N的去除贡献都不太理想,这里氧化池的NH4+-N转化率不高可能是因为曝气不足,氧化池末后端兼具沉淀池功能。如果不用人工湿地,要想NH4+-N达标排放,必须增加多级氧化或者NH4+-N吹脱工艺[18-19],但是必然会增加运行成本。从实验结果分析来看,若在流化床后再加人工湿地能够实现生猪废水的达标排放。经流化床处理后TP浓度下降,可减缓人工湿地的吸附饱和,而且人工湿地运行成本低但功能却比较全面。但经流化床后,废水中增加MgCl2的浓度,且提升了pH值,是否影响人工湿地运行需要进一步研究。
本调查研究在原水中三种抗生素检出浓度范围3.42~34.60 μg/L(表2),与Wei等[20]和Chen等[21]报道的生猪废水抗生素残留情况相吻合。生物降解、化学吸附以及水解和光解是废水处理工艺抗生素主要去除方式,另外在人工湿地中存在植物吸收和分解的过程[22]。在废水处理过程中OTC和CIP表现出相似的去除规律,与SM2的去除截然不同,这与抗生素的介质吸附能力(用吸附平衡常数Kd值表示)有关。根据文献统计,不同介质中四环素类、磺胺类和喹诺酮类抗生素的Kd值范围分别在290~1 620 L/kg、0.9~10 L/kg[23]和260~6 310 L/kg[24]之间。四环素类和喹诺酮类抗生素具有较强的介质吸附能力。厌氧消化对OTC和CIP的去除率高于SM2,除了生物降解外,污泥吸附也是很重要的原因。同理,流化床和人工湿地工艺对OTC和CIP的去除率也远高于SM2,流化床结晶出的磷酸铵镁颗粒和人工湿地的填料都是潜在的吸附介质[25-26],人工湿地可通过植物吸收和微生物降解实现抗生素的矿化,而磷酸铵镁富集的抗生素对施肥土壤的影响还需要进一步研究[27]。相比之下,由于SM2的介质吸附弱,其主要通过生物降解以及水解光解去除,尽管整体去除率要低些,但介质吸附的后续影响很小。有研究发现,环境中低浓度的抗生素也有可能通过多种抗生素的共选择再加基因的水平转移方式诱导微生物产生耐药[28]。因此,尽管目前养殖废水排放标准尚未针对抗生素设定,尽可能降低废水中的抗生素是废水处理工艺的基本方向。基于人工湿地优秀的抗生素吸附和降解能力,在废水排放之前经人工湿地处理是非常必要的。
耐药细菌作为宿主,对耐药基因的传播扩散起到决定性的作用。废水处理工艺对耐药基因的去除能力主要体现在对耐药细菌的消除和控制上[29]。根据检测结果可以看出厌氧消化对耐药细菌的去除贡献最大(图2),这一方面是因为厌氧消化是废水处理的首个环节,更主要的是厌氧过程伴随着产酸产甲烷,COD浓度大幅下降,环境改变使得部分耐药细菌无法适应,在竞争中逐步消退。此外,不管使用哪种培养基,流化床对以奇异变形杆菌、鼠伤寒沙门氏菌和宋内氏志贺氏菌为主的无色菌落没有明显去除,甚至有不同程度的提升,这直接影响到总可培养阴性细菌的统计。而且流化床对无抗和CIP选择下的总可培养细菌也表现出一定程度的提升。流化床阶段外源添加MgCl2,而且水力流态和供氧水平得到提升,这样的环境条件可能对部分耐药细菌有选择偏好,但其内在的机理尚不清楚。再者,经人工湿地处理后,不同耐药细菌的数量都表现出比较一致的下降。潜流型人工湿地首先起到渗滤的功能,废水中微生物会被人工湿地土壤和填料拦截,微生物量通常会大幅下降[30-31],而且潜流人工湿地属于典型的好氧系统,其与水体环境截然不同也加剧微生物类型的改变[32]。废水处理过程微生物群落的改变对于理解这个过程耐药细菌的变化有一定的帮助(图3)。从原水到厌氧消化再到氧化池,微生物群落组成变化的衔接性较好。然而从氧化池到流化床或者从氧化池到人工湿地,微生物群落变化都非常剧烈,与这两个工艺环节独特的微环境是分不开的。最后,废水处理各个环节病原菌数量占比统计结果也显示出潜流人工湿地在减少废水病原菌方面的巨大优势(图5),在生猪废水处理末端设置人工湿地是大幅降低养殖废水病原菌的可行方案。
4 结论
研究表明,厌氧消化在COD降解和耐药细菌削减上贡献较大,而磷酸铵镁流化床对于磷素回收具有良好的效果。然而采用厌氧消化—氧化池—流化床工艺组合处理后的废水,仍存在NH4+-N难以达标、抗生素残留浓度仍偏高、部分耐药细菌数据出现反弹等不足之处。研究发现潜流人工湿地水质处理能力比较全面,尤其是NH4+-N去除效果良好,同时能够进一步去除抗生素和耐药细菌,在降低病原细菌丰度方面优势也非常显著。因此,研究建议设置潜流人工湿地承接流化床出水可进一步深度处理生猪废水。
