阔韧带淋巴管肌瘤病误诊为低级别浆液性癌1例报道并文献复习
2021-04-30王立娟邹凌凤郭小红曹晓静王军大曾敏
王立娟,邹凌凤,郭小红,曹晓静,王军大,曾敏
0 引言
淋巴管肌瘤病(lymphangioleiomyomatosis,LAM)是一种由淋巴管及其周围增生的淋巴管肌细胞所组成的肿瘤,可见淋巴细胞聚集灶,局灶性的病变称为淋巴管肌瘤,广泛累及淋巴管链伴或不伴有肺实质累及,称为淋巴管肌瘤病[1],于1937年由Von Stossel首次报道。2002年版WHO分类中将该肿瘤归类到PEComa家族。此病好发于肺内,多见于育龄期及绝经前期女性,查阅国内外文献,发生在肺外的LAM罕见,有发生于腹腔[2]、肠系膜[3]、盆腔[4]及子宫[5]等部位的个案报道,本文对发生在肺外阔韧带的LAMs伴有苗勒管上皮旺炽性增生的1例病例进行回顾性分析,并复习相关文献,分析误诊原因,以供同行参考。
1 资料与方法
1.1 一般资料
患者女性,43岁,彩超发现右附件区囊肿6年,肿物为混合性包块,大小为5.6 cm×4.5 cm,无回声,混有高回声区,患者无特殊不适,给予服药(具体方案不详)治疗1月后包块无改变。入院后MRI提示:子宫右侧单房囊性占位,考虑囊肿可能,囊腺瘤不能除外,请结合临床及其他相关检查,病灶左侧可疑卵巢影像,见图1。入院胸部CT提示:(1)考虑间质性肺炎,建议治疗后复查。(2)双侧胸腔少许积液。实验室检查:糖类抗原CA-125 142.8 u/ml(↑),绝经前卵巢肿瘤风险指数ROMA为11.4%(↑),绝经后卵巢肿瘤风险指数ROMA为43.9%(↑),余无特殊异常。术中所见:右侧阔韧带见10.0 cm×7.0 cm×5.0 cm的囊性肿物,质软,张力小,位置固定,钝性剥离囊肿过程中发生破裂,流出淡牛奶样白色囊液,见囊壁内广泛分布乳头样颗粒,盐粒大小、质硬砂砾感。术后3月患者出现乳糜胸,予外院治疗,具体治疗方案不详。
1.2 方法
1.2.1 免疫组织化学方法(1)标本常规制片,光学显微镜观察;(2)苏木精-伊红染色法(HE染色法);(3)免疫组织化学采用Compact polymer法。一抗购自福州迈新试剂公司,二抗购自瑞士罗氏公司。
1.2.2 病理检查 大体观:灰白灰褐色囊壁样组织,11 cm×7 cm×0.2 cm,囊壁稍粗糙,局灶砂砾感,内容物流失,厚约0.1~0.4 cm。镜检:纤维囊壁组织水肿出血,囊壁组织被覆柱状上皮细胞,核呈杆状,有异型,局灶呈复层及乳头状结构,囊壁组织内多处见增生的腺样结构,且多处见钙化灶,囊壁组织内可见呈束状、粗梁索状及乳头状生长肌样梭形细胞和衬附扁平内皮的网状或窦隙样腔隙,部分区域可见梭形细胞沿着苗勒管上皮生长,灶性区域可见淋巴细胞聚集,见图2~3。免疫组织化学结果:苗勒管上皮阳性表达蛋白:WT-1、PAX-8、CA125、ER(见图4)、PR、P53、Ki-67、CK7;梭形肌样细胞阳性表达蛋白:HMB45(见图5)、SMA、MelanA、β-Catenin、Desmin、ER(见图4)、PR;扁平内皮细胞阳性表达蛋白:D2-40、CD31(见图6);三者均阴性表达蛋白:TTF-1、S100、SOX-10。
2 讨论
LAM是一种低度恶性肿瘤,主要通过淋巴管扩散。好发于育龄期和绝经期女性,平均发病年龄39岁[6],男性少见报道[7-8]。LAM分为两种类型,即散发性淋巴管肌瘤病(sporadic lymphangioleiomyomatosis,S-LAM)和遗传性结节性硬化症相关淋巴管肌瘤病(tuberous sclerosis lymphangioleiomyomatosis,TSC-LAM)。TSC是一种常染色体显性遗传病,主要由位于9q34.3的TSC1基因和位于16p13.3的TSC2基因突变所致,研究[9]显示大约40%的TSC患者同时伴发LAM,且在TSC-LAMs的患者中存在TSC1基因和TSC2基因的突变,而在S-LAM患者中仅发现TSC2基因突变。LAM患者累及肺部时常出现进行性呼吸困难、自发性气胸、乳糜液、咳嗽及咯血等症状,气胸和乳糜液多为自发性,反复发作,发生在肺外时常因体检或意外发现。
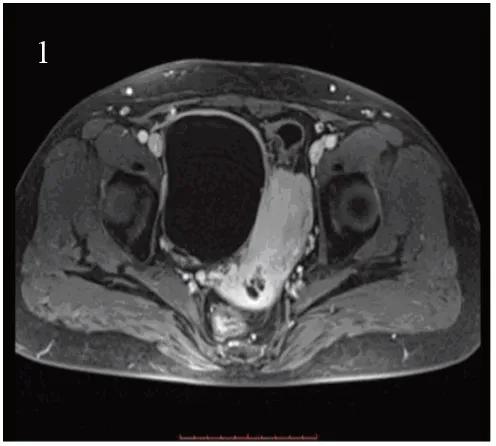
图1 MRI显示右侧阔韧带囊性占位 Figure 1 MRI showed cystic mass in the right broad ligament

图2 苗勒氏上皮呈乳头状增生 (HE ×200) Figure 2 Papillary hyperplasia of Mullerian epithelium (HE ×200)

图3 肌样细胞增生 (HE ×200) Figure 3 Myoid cell proliferation (HE ×200)

图4 ER增生的上皮及肌样细胞免疫组织化学染色均阳性结果 (Compact polymer ×200)Figure 4 Immunohistochemical staining showed ER positive both in hyperplasia epithelial and myoid cells (Compact polymer ×200)

图5 HMB45肌样细胞免疫组织化学阳性染色结果 (Compact polymer ×200)Figure 5 Immunohistochemical staining showed HMB45 positive in myoid cells (Compact polymer ×200)
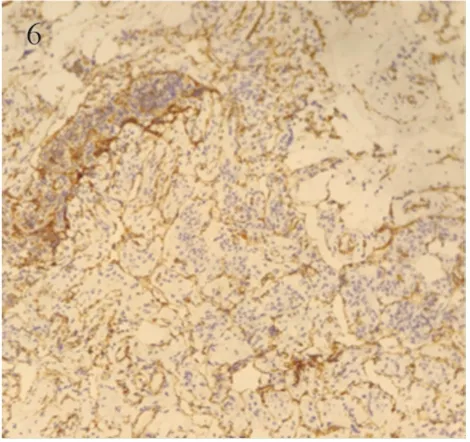
图6 CD31在肌样细胞间的扁平内皮细胞中免疫组织化学阳性染色结果 (Compact polymer ×200)Figure 6 Immunohistochemical staining showed CD31 was positive in flat endothelial cells between myoid cells (Compact polymer ×200)
本例淋巴管肌瘤病患者做B型超声时意外发现阔韧带包块6年,此后每年复查显示包块缓慢长大。术中冰冻镜下显示囊壁被覆腺上皮增生较明显,有异型性,且囊壁内也见增生旺盛的腺体,冰冻诊断为浆液性肿瘤伴广泛钙化。术后石蜡切片除了冰冻时镜下的特征,局灶囊壁被覆上皮呈复层及乳头状结构,囊壁组织内可见肌样梭形细胞和衬附扁平内皮的网状或窦隙样腔隙,灶性区域可见淋巴细胞聚集。术后第一次免疫组织化学:腺上皮阳性表达WT-1、PAX-8、CA125、ER、PR、CK7、P53弱阳性表达,Ki-67活跃区(+约25%),由于腺上皮增生明显,忽略了细胞质红染的肌样细胞,第一次石蜡病理诊断结果:(阔韧带)低级别浆液性癌。临床医生得知病理检查结果后和病理科医生沟通临床病史及术中所见,并且告知囊肿内流出淡牛奶样白色囊液,目前患者出现了咳嗽的症状,结合入院CT提示双肺呈蜂窝状改变的影像学特征,加做了免疫组织化学,结果显示细胞质红染的肌样细胞阳性表达HMB45、SMA、MelanA、β-Catenin、Desmin,网状及窦隙样腔隙衬附的扁平内皮细胞阳性表达D2-40、CD31,但TTF-1、S100、SOX-10阴性表达,修正病理诊断报告为淋巴管肌瘤病伴苗勒氏管上皮旺炽性增生。文献报道[10]WT-1在良性苗勒氏上皮中有阳性表达,LAM表达色素细胞标志物,包括HMB45、MelanA等,一般不表达S100,且报道显示HMB45的阳性表达率达90%以上[11-13],MelanA阳性率在80%以上,同时发现男性LAM的HMB45阴性表达率比女性高[7-8]。此外还表达肌源性标志物Desmin、SMA等,有文献报道LAM可以表达ER、PR、E-Cadherin、β-Catenin、抗缩氨酸抗体(Apep13h)及cathepsin K[14-16],且ER和PR的阳性表达率有差异,PR表达率约57%,明显高于ER的21%[17],本文报道病例肌样细胞ER、PR均为阳性,和文献报道相符。
误诊原因分析:第一:病理诊断时未能和临床及时沟通病史和术中所见,忽略了临床特征对病理诊断的重要性;第二:此例患者镜下可见旺炽性增生的苗勒氏管上皮,细胞有异型性,多处囊壁内可见增生的腺体,局灶呈乳头状增生,多处可见钙化灶,且围绕上皮生长的肌样细胞成分相对较少,诊断的重点放到了上皮,忽略了患者较长的病史,且钙化是坏死细胞和细胞碎片未能被及时吸收而发生的钙盐和其他矿物质的沉积,不是浆液性癌的特异性诊断要点。镜下见肌样特征的肿瘤细胞基本都是围绕上皮生长,且部分腺体位于淋巴细胞团中,笔者认为上皮细胞长期受淋巴细胞及肿瘤细胞生长的刺激,可能会呈现一种旺炽生长的状态;第三:免疫组织化学的项目做得不够全面,且WT-1、PAX-8阳性表达及Ki-67的较高表达误导了病理诊断的思考方向。
按照2010年欧洲呼吸学会(ERS)的临床指南,LAM的诊断标准除了胸部高分辨率CT呈现典型LAM囊性改变,同时伴有以下任何一项临床特征即可诊断:(1)病理诊断为淋巴管肌瘤;(2)胸腔或腹腔乳糜性积液;(3)合并TSC;(4)肾脏AML。2016年美国胸科协会(ATS)与日本呼吸学会(JRS)的联合指南把血清标志物VEGF-D纳入诊断标准,只要符合LAM肺部囊性病变的女性患者,血清VEGF-D高于800 ng/L即可诊断LAM[18]。而此指南只是针对出现肺部病变的患者,发生在肺外的LAM没有出现此类临床症状时是否适用此标准,还有待进一步总结,笔者认为,发生在肺外的LAM,病理诊断应该是金标准。
淋巴管肌瘤病需要和以下疾病鉴别:(1)腺瘤样瘤:腺瘤样瘤可以有假血管样腔隙、肥大的平滑肌细胞及数量不等的淋巴细胞,但腺瘤样瘤是间皮来源,表达Calretinin(CR)等间皮标志物,不表达HMB45、MelanA,并且大部分以实性为主;(2)淋巴管瘤:海绵状淋巴管瘤可以由大小不等的腔隙组成,腔内可见淋巴细胞,并且腔隙周围也可见不完整的平滑肌,但是淋巴管瘤表达D2-40、CD31,不表达HMB45、MelanA,并且成人比较少见,以儿童为主;(3)低级别浆液性癌:当淋巴管肌瘤病伴苗勒氏管旺炽性增生时,容易和低级别浆液性癌混淆,免疫组织化学HMB45、MelanA可以鉴别,并且大体标本囊内液体不一样,浆液性癌呈囊性时,囊内常为清亮液体,淋巴管肌瘤病则为乳糜液;(4)来源于苗勒氏管和Wolff管残件的囊肿,这类囊肿可以有少量薄层的平滑肌细胞,但上皮来源不一样,WT-1和PAX-8阳性表达,而淋巴管肌瘤病被覆的扁平上皮表达D2-40和CD31,并且肌样细胞表达HMB45和MelanA。
目前,LAM还没有发现完全治愈的方法,部分研究发现LAM和雌激素有关,内分泌调解药、抗雌激素治疗及手术切除卵巢已经成为广泛的治疗手段,但是经过多项回顾性研究发现,抗雌激素的联合治疗总体上并没有明显疗效。对于肺功能异常或肺功能恶化的LAM患者,目前推荐西罗莫司作为一线治疗,包括对反复乳糜性及气胸的患者也有明显疗效[18-19]。无论是S-LAM还是TSCLAM,都和TSC1/TSC2基因突变有关,TSC1/TSC2基因突变引起(mTOR)通路活化,继而导致LAM细胞异常增殖,西罗莫司是一种选择性靶向小分子,可以和mTOR特异性结合阻断通路的活化。对于晚期患者肺移植治疗是唯一选择,双肺移植是首选手术方法[20]。总之,LAM目前缺乏有效治疗方法,预后较差,早期缺乏典型的临床表现,当发生在少见部位时容易误诊。
