藁本内酯药理作用及机制研究进展
2021-04-30何树苗陈元堃曾奥李春梅卢群
何树苗,陈元堃,曾奥,李春梅,卢群
(广东药科大学生命科学与生物制药学院,广东广州510006)
当归与川芎在我国各地分布较为丰富,在我国传统中药治疗中,具有悠久的入药历史。藁本内酯(ligustilide,LIG)是传统中药当归、川芎中含量较高的活性成分之一,药理作用众多,极具开发价值。近年来,中外学者对藁本内酯及对其各种药理作用研究日益深入,本文对近年藁本内酯的研究进行综述,为藁本内酯进一步的开发研究以及对我国中药宝库的挖掘利用提供参考。
1 理化性质和药理特性
藁本内酯是一种具有特殊香味的淡黄色油状液体,1960年由Mitsuhashi首次分离,可溶于甲醇、乙醇、乙醚等有机溶剂,沸点为168~169 ℃,相对分子质量为190.24,分子式为C12H14O2,系统命名为3-丁烯基-4,5-二氢-1(3H)-异苯并呋喃酮。藁本内酯为不饱和的苯酞结构,C-3 位由丁烯基取代,因而其稳定性极差,容易发生脱氢、氧化、水解、降解等化学反应,极易转化为与其结构相似的其他苯酞类化合物。藁本内酯结构中还有环外双键,可分为(Z)-ligustilide 和(E)-ligustilide 顺反两种异构体,Z 型结构作为空间优势构象,与E 型相较结构更加稳定,在中药材中含量远远高于E 型[1]。藁本内酯口服利用度(oral bioavailability,OB)为53.72 %,药物半衰期(t1/2)为5.61 h,血脑屏障系数(blood-brain barrier coefficient,BBB)为1.25,类药性指数(drug like index,DL)为0.07,分子的极性表面积(polar surface area,PSA)为30.21(小于60 表示其在渗透细胞膜时表现良好)。以上参数表明藁本内酯生物利用度较高,穿透力强,是药物开发的良好候选者,其化学结构见图1。
2 藁本内酯抗炎机制
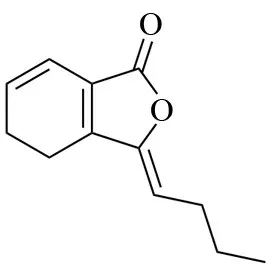
图1 藁本内酯化学结构Table 1 Chemical structure of ligustilide
炎症的发生由多种炎性细胞或免疫细胞激活调节。在炎症过程中,巨噬细胞被吸收并黏附在血管内皮细胞的脆弱部位,然后渗透到内皮细胞层。巨噬细胞的炎性黏附和浸润由细胞黏附分子(cell adhesion molecules,CAMs)介导,活化的巨噬细胞可产生各类炎性黏附介质[2],如一氧化氮(nitric oxide,NO)、前列腺素E2(prostaglandins E2,PGE2)、白细胞介素-6(interleukin-6,IL-6)和肿瘤坏死因子-α(tumor necrosis factor,TNF-α)等。这些炎性介质的过度生成与多种疾病有关,包括哮喘、慢性肝炎、类风湿关节炎和动脉粥样硬化[3-5]。研究发现,LIG 对NO、PGE2、IL-6和TNF-α的产生具有很强的抑制作用[6]。依照炎症作用的发展过程,LIG可从以下几个方面发挥其抗炎作用。
2.1 抑制巨噬细胞的黏附
CAMs的表达由各类炎性细胞因子启动,活性氧物质(reactive oxygen species, ROS)或NF-κB 信号必不可少。LIG 通过抑制NF-κB 和ROS 的产生,抑制CAMs 的表达和巨噬细胞的黏附从而减轻血管炎症[7]。LIG对NF-κB的抑制功能可由Nrf2 激活介导;Nrf2 转录因子可调节多种抗氧化相关基因,通过生成抗氧化剂血红素加氧酶-1(Heme oxygenase-1,HO-1),防御氧化应激和不利炎症反应,诱导HO-1生成对炎症等应激状态的反应有益。LIG 在蛋白质合成水平上是有效的HO-1 诱导剂[8]。Wu 等[9-10]研究还发现,LIG 通过Nrf2 途径激活对苯并芘诱导的CYP1A1 上调具有显著的保护作用,通过抑制NF-κB 信号通路保护角质形成细胞免受UVB诱导的炎症[9]。
2.2 抑制NF-κB介导的趋化因子的产生
Zhao 等[11]发现腹腔注射完全弗氏佐剂或鞘内注射脂多糖可引起疼痛超敏反应,并增加了脊髓中角质形成细胞源性趋化因子(keratinocyte-derived chemokine,KC)和单核细胞趋化蛋白-1(monocyte chemoattractant protein-1,MCP-1)的表达,而LIG 对KC 和MCP-1 的表达有抑制作用,提示LIG 可能是通过调节KC 和MCP-1 介导的脊髓中枢致敏作用来减轻炎症性疼痛。
2.3 抑制MyD88/TLR4/NF-κB信号通路
TOLL 样受体(Toll-like receptor,TLR)家族成员通过招募“万能受体”——髓样分化因子(MyD88),活化其下游信号分子NF-κB,继而诱导多种炎症因子和趋化因子表达。外源性重组过氧化物酶(peroxidase,Prx)的3 个成员Prx1、Prx2 和Prx4 也可增加促炎介质NO、TNF-α 和IL-6 等的产生[12],诱导巨噬细胞活化。LIG 可以显著抑制TLR4与Prx表达,抑制NF-κB 的激活。MyD88/TLR4/NF-κB 是巨噬细胞发生炎症反应的关键信号通路,LIG可能通过抑制该信号通路发挥抗炎作用[13]。
3 藁本内酯干预疾病机制研究
3.1 动脉粥样硬化
动脉粥样硬化(atherosclerosis,As)是一种慢性炎症性疾病,AS 病变首先累及动脉内膜,继而发展为粥样斑块等种病变并存,最后可因斑块脱落引起血管栓塞而出现脑梗死等心脑血管并发症,因此动脉粥样硬化是多数心血管疾病的潜在病理学基础,比如冠心病就始于动脉粥样硬化斑块的形成[14],AS 及其并发症仍是导致全球人口死亡的主要原因[15]。藁本内酯作为当归、川芎的主要活性物质,可预防并治疗多种心血管并发症。其抗动脉粥样硬化机制如下。
3.1.1 减轻细胞损伤和内皮功能障碍
ROS 诱导的内皮功能障碍作为初始阶段,在AS 进程中起着关键作用[16]。成熟心肌细胞拥有大量线粒体,对心肌细胞的动态、存活以及维持心脏功能至关重要。质子泄漏是线粒体解偶联的标志,LIG能显著地诱导质子泄漏[17],减少ROS 的生成,并在缺血损伤模型中显示细胞保护作用。LIG 通过刺激Nrf2/ARE 途径,提高了各种抗氧化基因的表达,抑制ROS的产生,从而减轻各种因素引起的氧化应激和细胞损伤[18],同时诱导谷胱甘肽生成,谷胱甘肽不仅具有抗氧化与整合解毒作用,还可帮助机体保持正常的免疫系统功能[19]。
3.1.2 抑制血管平滑肌细胞增殖与迁移
LIG通过干预血管平滑肌细胞(vascular smooth muscle cells,VSMCs)增殖迁移而缓解或抑制AS 的形成与进展。本课题组[20-22]前期研究发现,LIG 通过抑制ROS 生成,下调p38、EPK、JNK 表达而阻断MAPK 信号通路,从而有效抑制VSMCs 增生,通过抑制c-Myc/MMP2 与R-OCK/JNK信号通路抑制血管平滑肌细胞的迁移,从而延缓动脉粥样硬化斑块的发展。基质金属蛋白酶(matrix metalloproteinase,MMP)能降解细胞外基质,从而使VSMCs更易发生迁移,c-Myc 为MMP2 的上游分子,是一种促进细胞分裂、可使细胞无限增殖的基因,通过调节表型标志蛋白α-SMA,将血管平滑肌细胞从稳定的收缩状态转换为合成表型,表型转化与AS 斑块的形成关系密切[23];RhoA/R-OCK 信号也可调节平滑肌表型调节和血管重塑,研究发现,LIG 可减弱c-Myc/MMP2 和ROCK-JNK 信号通路从而产生对病理性血管内膜增厚的保护作用[24]。
3.1.3 免疫调节作用
CD137 作为肿瘤坏死因子(tumor necrosis family,TNF)超家族的共刺激受体分子,可介导T 细胞活化从而增强机体免疫反应,LIG 通过干扰AP-1 和AKT/NF-κB 信号通路的表达[25],有效地抑制了AS 斑块不稳定性诊断生物标志物CD137的表达。
3.1.4 抑制脂质积累
研究发现当归可抑制小鼠血管内脂质积累,而正是LIG介导了其对脂肪酸吸收和酯化的影响。Lee等[26]发现藁本内酯通过抑制脂肪酸转运体摄取脂肪酸和酯化作用,并下调与脂肪生成相关基因的表达,脂肪酸转运蛋白-5(fatty acid transport protein-5,FATP5)与二酯酰甘油酰基转移酶-2(diacylglycerol acyltransferase-2,DGAT2)分别在脂肪酸转运和脂质合成中发挥重要作用,LIG抑制FATP5和DGAT2的表达减少脂质积累。
3.1.5 调节细胞内钙浓度及血清游离脂肪酸水平
细胞内[Ca2+]i浓度可以调节心血管疾病中的血管阻力和改善压力诱导的收缩[27],LIG 能有效地阻断电压依赖性钙通道,拮抗细胞内钙的积累[27],减少血管钙化。Liu等[28]实验表明,LIG 能明显抑制FFA 代谢紊乱,显著降低血清乳酸水平与血清游离脂肪酸水平,减少脂质沉积。
3.2 抗脑血管疾病
藁本内酯可透过血脑屏障,抑制炎症反应、抗氧化损伤、改善脑微循环,并可提高胆碱乙酰转移酶活性,对脑缺血、脑出血、脑血栓等脑血管疾病有改善作用。LIG 抗脑血管疾病机制如下。
3.2.1 增加血脑屏障通透性
研究证明,LIG 能够有效改善血脑屏障通透性,减少神经细胞坏死,改善脑出血大鼠的神经功能[29]。LIG 通过调节HIF-1α/VEGF 途径和下调AQP-4[31]以及紧密连接蛋白claudin-5 和zo-1 的表达[30],降低血脑屏障通透性,从而更加有效发挥脑部相关疾病的治疗作用。
3.2.2 促进血管生成
新生血管的生成可减轻脑缺血造成的脑损伤。Ren等证明LIG 可促进局部血管生成,增加脑血管数量,减轻缺血性脑损伤[31],并且发现小鼠在LIG 给药后,缺血半球中VEGF表达和eNOS激活明显增加。
3.2.3 减少免疫炎症损伤
Prx1是过氧化物酶家族中的一员,可激活TLR4/NF-κB 信号通路,进而引起神经炎症损伤和功能缺损。LIG 及其代谢分子能抑制Prx1/TLR4/NF-κB 信号传导和由此引起的免疫炎症损伤,抑制胶质细胞的活化、外周血白细胞侵入浸润以及TNF-α、IL-6 等炎症因子的产生,对脑出血具有神经保护作用[32]。
3.2.4 调节氧化应激和细胞生存。
PI3-K/Akt信号级联是神经元激活的一个关键促生存途径。LIG 可能通过激活PI3-K/Akt 信号通路[33]、抑制Akt/FoxO1 通路与p38 信号生成减少氧化应激,对脑缺血小鼠具有神经保护作用,发现LIG 逆转了密集的核浓缩和分裂以及亚G1DNA 含量积累,推测LIG 可能是通过一种抗凋亡的方式来实现神经保护作用的。LIG 还可通过ERK 信号途径促进促红细胞生成素的转录[34],抑制应激诱导蛋白RTP801 的表达,提高细胞活力,可作为防治缺血性疾病的治疗药物。
3.3 抗阿尔茨海默病
阿尔茨海默病(Alzheimer disease,AD)是一种与年龄相关的神经退行性疾病,其病理特征是高磷酸化tau 蛋白的细胞内积聚和β-淀粉样(Aβ)纤维的细胞外沉积,以及大脑海马和皮层区域的功能神经元的逐渐丧失[35],因此,具有神经保护作用的化合物LIG 在治疗AD 中可能具有价值。LIG治疗AD机制如下。
3.3.1 降低Aβ水平及其累积毒性
LIG 既能抑制Aβ的形成,又能通过调节小鼠脑内Aβ降解酶的水平而促进Aβ 的降解,从而降低APP/PS1 小鼠海马和皮层的Aβ 水平[36]。研究发现,LIG 可显著阻断Aβ诱导的细胞核浓缩和亚G1 细胞聚集,通过抑制p38 和激活PI3-K/Akt 信号通路、调节TNF-α 激活的NF-κB 信号转导通路来对抗Aβ引起的神经毒性[37-38]。
3.3.2 上调Klotho水平
Kuang 等[39-40]发现衰老抑制基因Klotho表达与AD 表型呈负相关,并提出慢性服用LIG 可以预防Aβ 样神经病变的发展和衰老过程中的记忆障碍。LIG 可以增加脉络丛klotho 的表达[44],诱导胰岛素生长因子-1(IGF-1)信号抑制和叉头转录因子(FoxO1)激活,改善大脑氧化应激,发挥抗AD作用。
3.3.3 神经元保护与重构
LIG可增加细胞活力,释放乳酸脱氢酶和减少细胞内ROS 积累,通过改善磷tau 和Aβ 病理学,预防淀粉样斑块和神经纤维缠结的发生,从而保护大脑神经元,改善模型小鼠的记忆障碍[41]。神经生长相关蛋白GAP-43 参与神经细胞突触发育形成和再生,是神经元发芽的标志物。LIG 能恢复GAP-43 的表达,促进损伤神经元的结构突触重组,降低caspase-3和星形胶质细胞的活化,减轻模型小鼠脑内的氧化损伤[42],从而对小鼠学习记忆障碍具有保护作用。
3.4 骨关节炎
骨关节炎(osteoarthritis,OA)是一种退行性关节疾病,引起慢性疼痛、关节结构完整性破坏和功能丧失等症状。其特征是软骨退变和软骨细胞炎症反应[50]。LIG 可从这两方面干预骨关节炎发展。
3.4.1 抑制软骨退变
软骨是由软骨细胞和细胞外基质(extracellular matrix,ECM)组成的一种无血管、无淋巴的基质,主要成分是Ⅱ型胶原和软骨蛋白聚糖。软骨退变包括ECM退变和软骨组织破坏。软骨细胞凋亡是导致软骨退变的主要因素,也是OA 治疗的可能靶点。LIG 通过抑制JNK 和p38 MAPK 途径保护软骨细胞免受刺激诱导的凋亡和关节软骨退变[43]。还可通过PI3K/AKT 途径激活NF-κB,抑制ECM降解[44]。
3.4.2 减轻软骨细胞炎症
白细胞介素(IL-1β)是一种致炎细胞因子,广泛参与了人体组织破坏、水肿形成等多种病理损伤过程,IL-1β显著诱导了IKKα/β、IκBα 和NF-κB p65 的磷酸化。LIG通过抑制软骨细胞NF-κB 信号传导,在基因水平上抑制了IL-1β刺激后PGE2、TNF-α和IL-6等炎症因子的过度分泌,而同时在基因和蛋白水平上抑制了COX-2 和iNOS,减轻软骨细胞炎症反应[45]。
3.5 骨质疏松
骨质疏松症(osteoporosis)是由多种因素引发的一组代谢性骨病变。发展前期骨量逐渐减少、骨的微观结构退化,最终导致骨脆性增加,容易引发骨骼疼痛甚至发生骨折。任何年龄均可发生骨质疏松症,绝经后女性和老年男性为高发人群。骨质量的调节依赖于骨形成和骨吸收之间的动态平衡,骨吸收则受成骨细胞(osteoblasts,OBs)与破骨细胞(Osteoclast,OCs)激活的影响[46]。
OBs 是骨形成的主要细胞,在维持骨量方面起着不可替代的作用。LIG 可能通过GPR30/EGFR 途径对氧化应激下OBs 的存活和凋亡进行复杂的调控[47]。雌激素调节骨生长中起关键作用。GPR30 作为一种G 蛋白偶联的雌激素受体,可激活表皮生长受体因子(epidermal growth receptor factor,EGFR)。EGFR 在OBs 分 化 过 程 中 通 过 负性调节mTOR 信号调节成骨祖细胞的增殖与凋亡来刺激骨形成,显著增加OBs 的数量[48]。转基因小鼠由于缺乏成熟的OCs 而表现出轻微的骨质疏松症。NF-κB 受体活化因子配体(RANKL)在成骨细胞中表达可激活OCs。NFATc1 是参与OCs 分化和成熟的重要基因,缺失导致OCs 功能障碍。Wang 等[49]已证实LIG 通过抑制NF-κB/ERK/p38/ITAM 信号通路,抑制RANKL 表达,下调下游NFATc1和c-Fos的表达及OCs特异基因的转录,影响OCs的分化和活性[50]。
4 总结与展望
藁本内酯作为传统中药当归、川芎中的主要活性成分,具有抗炎、抗氧化、抗凋亡和神经保护等作用,对动脉粥样硬化、冠心病等心血管疾病、脑出血、脑缺血等脑血管疾病、阿尔茨海默病、骨质疏松、骨关节炎等均有不错的治疗效果。藁本内酯对疾病的治疗机理与其抗炎、抗氧化的作用密切相关,NF-κB 信号通路与抑制ROS 生成、调节细胞自噬与凋亡等功能与在多种疾病的治疗中发挥关键作用。
传统中医学中,川芎、当归均有“益气补血”之功效,现代医学认为,“益气补血”即改善微循环,提高机体免疫调节的能力,这似乎对藁本内酯对多种疾病有广泛的药理作用有所解释。当归及川芎多年来在治疗心脑血管疾病、偏头痛及女性痛经等病症中应用广泛且效果良好,利用藁本内酯的优势进行新药开发及临床应用具有非常广阔的空间。中药配伍成分极其复杂及潜在肝肾毒性等,限制了中药在临床的广泛应用,利用现代先进技术加强藁本内酯基础研究,同时结合我国资源现状,加强工业产业中藁本内酯的提取分离及纯化研究,为临床用药及新药研发提供理论依据,对发展具有我国特色的天然创新药品、提高我国医药行业竞争力具有重要意义。
