薯蓣粥对2型糖尿病大鼠肝脏糖异生的影响
2021-04-29罗宗婷庞书勤周建陈芳洪雪珮陈锦秀葛莉戴燕铃李霞王雅立
罗宗婷 庞书勤 周建 陈芳 洪雪珮 陈锦秀 葛莉 戴燕铃 李霞 王雅立

〔摘要〕 目的 观察薯蓣粥对2型糖尿病(type 2 diabetes mellitus, T2DM)大鼠磷酸烯醇式丙酮酸羧激酶(phosphoenolpyruvate carboxykinase, PEPCK)、葡萄糖-6-磷酸酶(glucose-6-phosphatase, G6Pase)、腫瘤坏死因子-α(tumor necrosis factor-α, TNF-α)、白细胞介素-6(interleukin-6,IL-6)、C-反应蛋白(C-reactive protein, CRP)和脂联素(adiponectin, APN)等与肝脏糖异生相关指标的变化,从肝脏糖异生角度探讨薯蓣粥的降糖机制,为薯蓣粥的临床应用提供科学依据。方法 60只Wistar大鼠随机分为空白组10只和造模组50只。造模组采用高糖高脂饲料联合腹腔注射小剂量链脲佐菌素(streptozotocin, STZ)制备T2DM大鼠模型,将造模成功的40只大鼠随机分为模型组、薯蓣粥组、二甲双胍组和联合治疗组,各组10只。每组给予相应药物连续灌胃给药6周后,全自动生化分析仪检测空腹血糖(fasting blood glucose, FBG);ELISA检测血清TNF-α、IL-6、CRP和APN含量;RT-qPCR检测PEPCK和G6Pase基因(mRNA)表达;免疫组化检测PEPCK和G6Pase蛋白表达。结果 与空白组比较,模型组大鼠FBG显著升高(P<0.01);血清TNF-α、IL-6、CRP 水平上升,APN 水平下降(P<0.01);肝组织PEPCK、G6Pase mRNA及蛋白表达均增加(P<0.01)。与模型组比较,薯蓣粥组、二甲双胍组和联合治疗组FBG显著降低(P<0.01);血清TNF-α、IL-6、CRP水平下降,APN水平上升(P<0.05);肝组织PEPCK、G6Pase mRNA及蛋白表达均减少(P<0.01);且联合治疗组较薯蓣粥组应用效果更优(P<0.05)。结论 薯蓣粥能够降低T2DM大鼠FBG水平,其作用机制可能与下调T2DM大鼠血清TNF-α、IL-6、CRP水平和上调APN水平,进而减少肝组织PEPCK、G6Pase mRNA及蛋白的表达,减弱肝脏糖异生有关。
〔关键词〕 2型糖尿病;肝脏糖异生;薯蓣粥;空腹血糖
〔中图分类号〕R285.5 〔文献标志码〕A 〔文章编号〕doi:10.3969/j.issn.1674-070X.2021.01.009
〔Abstract〕 Objective To observe the effects of yam gruel on phosphoenolpyruvate carboxykinase (PEPCK), glucose-6-phosphatase (G6Pase), tumor necrosis factor-α (TNF-α), interleukin-6 (IL-6), C-reactive protein (CRP), adiponectin (APN) and other indicators related to hepatic gluconeogenesis in rats with type 2 diabetes(T2DM), and to explore the hypoglycemic mechanism of yam gruel from the perspective of hepatic gluconeogenesis, so as to provide a scientific basis for the clinical application of yam gruel. Methods 60 Wistar rats were randomly divided into the control group (n=10) and model groups (n=50). Rats in model groups were fed with high-sugar/high-fat diet, and combined with an intraperitoneal injection of low-dose streptozotocin (STZ) to induce T2DM rats model. T2DM rats were selected and randomly divided into the model group, the yam gruel group, the metformin group, and the combined treatment group. Ten rats in each group. After 6 weeks of continuous gavage of the corresponding drug in each group, an automatic biochemical analyzer was used to detect fasting blood glucose (FBG) levels. ELISA kits were used to detect the concentrations of serum TNF-α, IL-6, CRP and APN. The mRNA expressions of PEPCK and G6Pase were detected by RT-qPCR. The protein expressions of PEPCK and G6Pase were detected by immunohistochemical. Results Compared with the control group, the FBG levels in the model group were significantly increased (P<0.01), the serum levels of TNF-α, IL-6 and CRP were increased while the serum levels of APN were decreased in the model group (P<0.01), both mRNA and protein levels of PEPCK and G6Pase in the liver tissues were significantly elevated in the model group (P<0.01). Compared with the model group, the FBG levels were significantly decreased in the yam gruel group, the metformin group and the combined treatment group (P<0.01), the serum levels of TNF-α, IL-6 and CRP were decreased, while the serum levels of APN were increased in the yam gruel group, the metformin group and the combined treatment group (P<0.05), both mRNA and protein levels of PEPCK and G6Pase in the liver tissues were significantly decreased in the yam gruel group, the metformin group and the combined treatment group (P<0.01). And the combined treatment group showed better efficacy than the yam gruel group (P<0.01). Conclusion Yam gruel has an effect on lowering FBG in T2DM rats, and its mechanism may be related to the down-regulation of serum TNF-α, IL-6, CRP, and the up-regulation of APN levels in T2DM rats, and then reducing the expressions of mRNA and protein levels of PEPCK and G6pase to inhibit excessive hepatic gluconeogenesis.
〔Keywords〕 type 2 diabetes; hepatic gluconeogenesis; yam gruel; fasting blood glucose
糖尿病是当前威胁人类健康最主要的慢性非传染性疾病之一。据国际糖尿病联盟统计,2019年全球糖尿病患者达4.63亿,中国糖尿病患病人数约1.16亿,其中2型糖尿病(type 2 diabetes mellitus, T2DM)所占比例超过90%[1-2]。T2DM发病率高,并发症多而重,给患者、家庭及社会带来沉重的经济负担和照护负担[3-5]。糖代谢紊乱是T2DM重要的病理基础,其中肝脏糖异生增强是其最明显的特点[6]。已有文献报道,T2DM患者及模型动物体内普遍存在肝脏过度糖异生[7-8]。肝脏糖异生异常活跃时,肝糖输出量急剧增加,导致FBG升高。最新研究发现,肠道菌群的变化与肝脏糖异生密切相关[9]。在T2DM患者及模型动物中,肠道益生菌相对丰度下降,血清炎性因子肿瘤坏死因子-α(tumor necrosis factor-α, TNF-α)、白细胞介素-6(interleukin-6, IL-6)、C-反应蛋白(C-reactive protein, CRP)等释放增加,通过PI3K/Akt/FoxO1或AMPK途径直接促进糖异生关键酶PEPCK和G6Pase的表达,使肝脏糖异生增强[10-11]。可见,从肠道菌群的角度干预肝脏糖异生将成为T2DM防治的新靶点。
饮食是肠道菌群结构的主要影响因素之一[12],同时也是糖尿病管理最为重要的基础措施。中医药膳是特殊的饮食干预,具有药食同源的双重疗效。薯蓣粥是张锡纯所著《医学衷中参西录》中的经典药膳方[13],课题组前期研究显示,薯蓣粥能够促进T2DM患者及大鼠模型肠道内双歧杆菌的生长、增加短链脂肪酸(short-chain fatty acids, SCFAs)的含量,降低血糖水平[14-16],但其具体降糖机制尚不清楚。本研究在前期研究基础上,观察薯蓣粥对T2DM大鼠肝脏糖异生关键酶(PEPCK、G6Pase)mRNA、蛋白及TNF-α、IL-6、CRP、脂联素(adiponectin, APN)和空腹血糖(fasting blood glucose, FBG)的影响,进一步分析其降糖机制,为薯蓣粥的临床应用及推广提供科学依据。
1 材料与方法
1.1 实验动物
健康雄性Wistar大鼠60只,SPF级,体质量(150±10) g,购自上海斯莱克实验动物有限责任公司,饲养于福建中医药大学实验动物中心[许可证号:SYXK(闽)2014-0005],每笼5只,每日交替照明12 h,室温为(25±2) ℃,湿度保持55%±5%。普通饲料由福建中医药大学动物实验中心提供;高脂高糖饲料(配方如下:10.0%猪油、15.0%蔗糖、4%胆固醇、10%蛋黄粉、0.3%胆酸盐、60.7%基础饲料)由闽侯吴氏实验动物贸易有限公司提供,辐照后使用。
1.2 药材及主要试剂
生怀山药由课题组人员从河南焦作订购,经福建中医药大学药学院专家鉴定,整个实验过程中使用的生怀山药的量一次性购买后放置冰箱冷藏保存。STZ(美国Sigma公司);柠檬酸、柠檬酸钠(国药集团化学试剂有限公司);盐酸二甲双胍(中美上海施贵宝制药有限公司);PEPCK抗体(Immunoway公司);G6Pase抗体(Sabbiotech公司);DNA提取试剂盒,TNF-α、IL-6、CRP、APN酶联免疫试剂盒(杭州联科生物技术股份有限公司)。
1.3 主要仪器
九阳多功能料理机(九阳股份有限公司);AU5811全自动生化分析仪(美国贝克曼公司);脱水机(深圳达科为医疗科技有限公司);病理切片机(深圳达科为医疗科技有限公司);DNA扩增仪(美国ABI公司);荧光定量PCR仪(澳大利亚Corbett公司);ELX808型酶联免疫检测仪(美国BIO-TEK公司)。
1.4 造模及干预
1.4.1 动物造模及分组 60只大鼠适应性喂养1周后,随机选取10只作为空白组,给予普通饲料喂养;其余50只作为造模组,给予高脂高糖饲料喂养。6周后禁食过夜,次日清晨用电子天平称量大鼠体质量,造模组以25 mg/kg的剂量,腹腔注射2次1%STZ溶液(间隔2 d);空白组同步腹腔注射相同剂量的柠檬酸缓冲液。注射72 h后,经尾静脉采血,以非同日2次FBG≥11.1 mmol/L为T2DM大鼠成模标准[17]。
本次研究造模成功40只,成模率为80%。造模成功的大鼠再根据最后一次FBG值的高低进行编号,采用随机数字表法随机分为模型组、薯蓣粥组、二甲双胍组和联合治疗组,每组10只。
1.4.2 薯蓣粥的制备 参照《医学衷中参西录》中薯蓣粥的制作方法,并结合前期研究用量制备薯蓣粥[13-14]。每日取上述生懷山药150 g,去皮后剩下125 g,切片、入料理机,加水50 mL打成糊,250 mL凉水调入,中火煮沸,30 s后再文火煮沸,后再间隔30 s,连煮3次,过程中不间断地轻轻搅拌,最后成粥250 mL,薯蓣浓度为0.5 g/mL,冷却至37 ℃使用。
1.4.3 干预方法 干预期间,各组大鼠均以普通饲料饲养,自由进食、饮水,每日早上9时灌胃1次,持续给药6周。空白组和模型组给予生理盐水灌胃,薯蓣粥组给予薯蓣粥灌胃,二甲双胍组给予二甲双胍药液灌胃,联合治疗组给予薯蓣粥与二甲双胍混合物灌胃,灌胃剂量为15 mL/(kg·d)。其中,大鼠二甲双胍给药量按照100 mg/(kg·d)计算[18]。
1.5 标本采集
灌胃6周结束后,大鼠禁食不禁水12 h,2%戊巴比妥钠腹腔注射麻醉后,用真空采血管抽取各组大鼠腹主动脉血10 mL,一份保留全血用于FBG检测,一份离心后取血清于-80 ℃保存,用于TNF-α、IL-6、CRP、APN检测。取血后,迅速用无菌手术刀解剖大鼠,取肝脏组织100~200 mg,用4 ℃磷酸盐缓冲液冰上漂洗3遍,无菌滤纸吸干后,一份放入做好标记的1.5 mL EP管,投入液氮中速冻,再转移至
-80 ℃冰箱保存,用于PEPCK、G6Pase mRNA检测;一份固定于4%多聚甲醛溶液,用于PEPCK、G6Pase蛋白检测。
1.6 指标检测
1.6.1 PEPCK、G6Pase mRNA检测 RT-qPCR检测肝脏组织中PEPCK、G6Pase mRNA的相对表达量。从-80 ℃冰箱取出冻存的肝脏组织,研磨溶解后根据RNA提取试剂盒说明,提取样本总RNA,并对其进行浓度和纯度的检测。在NCBI数据库内查找大鼠PEPCK mRNA序列和G6Pase mRNA序列,运用Primer Premier 5.0设计目标基因和内参基因的特异性引物,Oligo 6.0检验其特异性,引物序列见表1。根据反转录试剂盒说明,合成cDNA第一链;采用7500实时荧光定量PCR系统进行定量PCR的扩增和检测,RT-qPCR反应条件如下:94 ℃预变性30 s,94 ℃变性5 s,60 ℃退火延伸34 s,共40个循环。记录各样本及GAPDH CT值,采用 2-△△Ct方法计算基因相对表达量。
1.6.2 PEPCK、G6Pase蛋白检测 免疫组化检测肝脏组织中PEPCK、G6Pase蛋白的相对表达量。操作步骤具体如下:肝脏组织经4%多聚甲醛固定后→包埋、切片→石蜡切片脱蜡至水→抗原修复(柠檬酸抗原修复缓冲液pH 6.0,高压沸腾2 min)→阻断内源性过氧化物酶(3%过氧化氢溶液,室温避光孵育25 min)→血清封闭(3% BSA,室温封闭30 min)→加一抗(PEPCK和G6Pase的稀释比例均为1∶100,4 ℃孵育过夜)→加二抗(HRP标记,室温孵育50 min)→DAB显色(阳性为棕黄色)→复染细胞核(苏木素复染3 min)→脱水封片→采集图像并用Image-Pro Plus 6.0软件进行分析,计算阳性细胞表达率。
1.6.3 TNF-α、IL-6、CRP、APN检测 参照ELISA试剂盒说明书,采用全自动酶标仪检测各组大鼠血清中TNF-α、IL-6、CRP、APN含量。
1.6.4 FBG检测 采用全自动生化分析仪测各组大鼠FBG水平。
1.7 统计学分析
采用SPSS 25.0统计学软件进行分析。以“x±s”表示计量资料结果。多组间比较,数据符合正态分布采用单因素方差分析,进一步两两比较时,方差齐采用LSD检测,方差不齐采用Dunnett's T3检测,不符合正态分布采用秩和检验。检验设定为P<0.05具有统计学意义。
2 结果
2.1 大鼠一般情况比较
在继续饲养及给药过程中,空白组大鼠毛发白净有光泽,自主活动正常;其他各组大鼠体形消瘦,精神萎靡、自主活动减少,毛发脏乱、发黄,摄食量、饮水量及尿液/粪便排出量均显著增加。
2.2 各组大鼠FBG比较
灌胃6周后,与空白组比较,模型组大鼠FBG显著升高(P<0.01);与模型组比较,薯蓣粥组、二甲双胍组和联合治疗组大鼠FBG显著降低(P<0.01);且联合治疗组大鼠FBG较薯蓣粥组降低更加明显(P<0.01)。见表2。
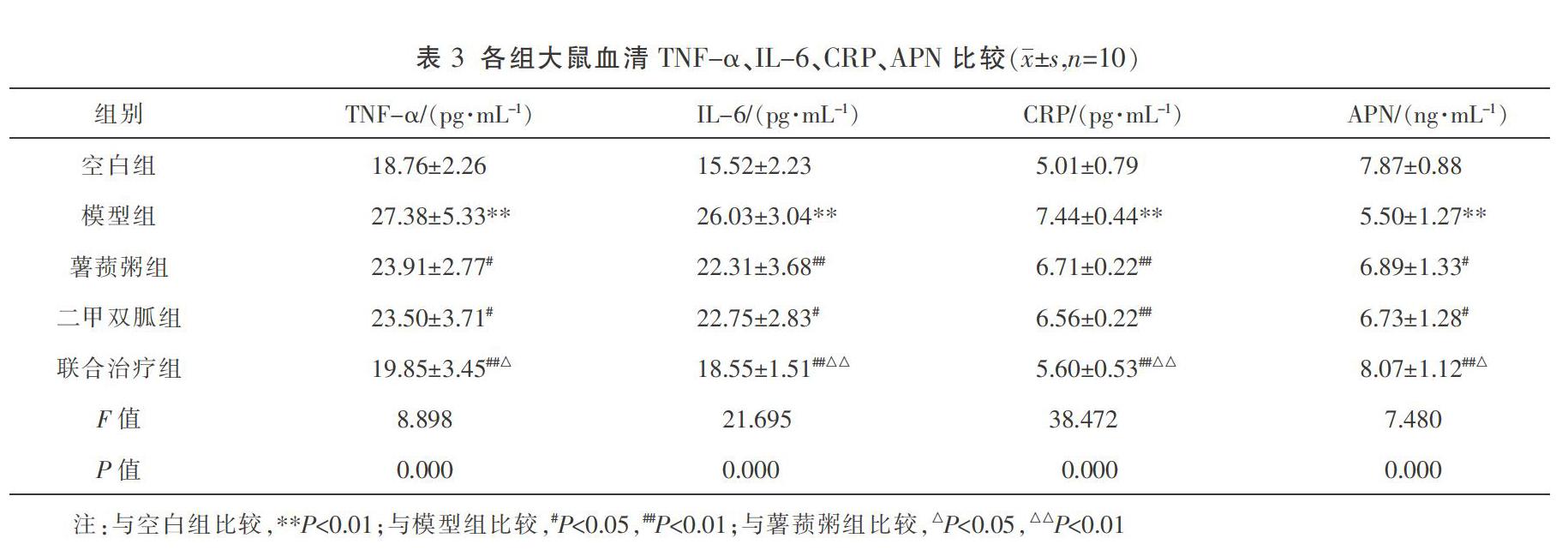
2.3 各组大鼠血清TNF-α、IL-6、CRP、APN比较
灌胃6周后,与空白组比较,模型组大鼠血清TNF-α、IL-6、CRP水平显著上升(P<0.01),APN水平明显下降(P<0.01);与模型组比较,薯蓣粥组、二甲双胍组和联合治疗组大鼠血清TNF-α、IL-6、CRP水平有效降低,同时APN水平被升高(P<0.05);且联合治疗组较薯蓣粥组应用效果更优(P<0.05)。见表3。
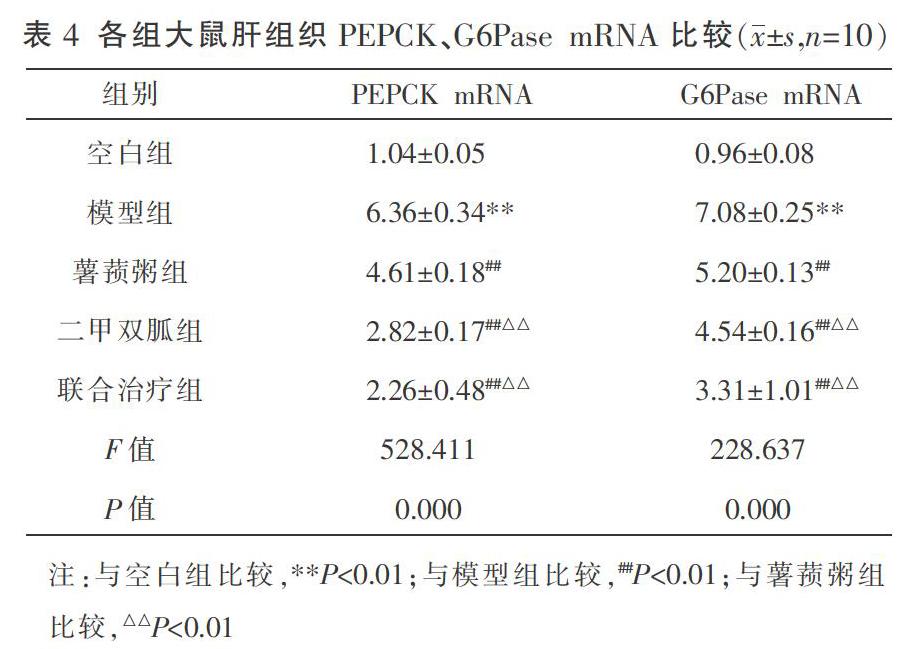
2.4 各组大鼠肝组织PEPCK、G6Pase mRNA比较
灌胃6周后,与空白组比较,模型组大鼠肝组织PEPCK、G6Pase mRNA表达水平显著上升(P<0.01);与模型组比较,薯蓣粥组、二甲双胍组和联合治疗组大鼠肝组织PEPCK、G6Pase mRNA表达水平均降低(P<0.01);且联合治疗组、二甲双胍组大鼠PEPCK、G6Pase mRNA表达水平较薯蓣粥组更低(P<0.01)。见表4。
2.5 各组大鼠肝组织PEPCK、G6Pase蛋白比较
灌胃6周后,与空白组比较,模型组大鼠肝组织PEPCK、G6Pase蛋白表达水平显著上升(P<0.01);与模型组比较,薯蓣粥组、二甲双胍组和联合治疗组大鼠肝组织PEPCK、G6Pase蛋白表达水平显著下降(P<0.01);且联合治疗组大鼠PEPCK、G6Pase蛋白表达水平较薯蓣粥组更低(P<0.05)。见表5,图1。
3 讨论
炎症反应参与了T2DM及其并发症的发生发展过程[19]。2016年的一项系统评价显示[20],TNF-α、IL-6、CRP水平的异常升高及APN水平的异常减少可增加T2DM發生的风险。本实验结果显示,薯蓣粥的干预能够降低T2DM大鼠血清TNF-α、IL-6、CRP水平,升高APN水平,并且与二甲双胍药物联合应用时效果更优。薯蓣粥是经典药膳方,组成为一味生怀山药。课题组前期实验及多项研究证明[14-16,21-22],山药干预具有调节肠道菌群的作用。益生菌及其代谢产物SCFAs已被证实能够减少TNF-α、IL-6、CRP等炎性因子的释放[23-24]。另外,蒋岚等[25]临床试验发现,在应用二甲双胍和阿卡波糖的基础上,补充益生菌治疗6周显著提高了T2DM患者血清APN浓度。可见,薯蓣粥可能通过调节肠道益生菌参与炎症反应的缓解过程。同时有研究表明,二甲双胍能减少炎性因子TNF-α、IL-6的表达,在一定程度上发挥抗炎作用[26]。因此,薯蓣粥与二甲双胍结合应用时,抗炎作用将进一步加强;而且更加符合临床T2DM患者在服药的基础上辅助食用薯蓣粥这一实际情况。
肝脏糖异生是机体葡萄糖利用及重大器官供能的主要来源。但是在T2DM等病理情况下,肝脏糖异生增强,血糖浓度升高。而PEPCK和G6Pase是肝脏糖异生的2个关键性限速酶[27],PEPCK和G6Pase过度表达会使肝脏糖异生的速度加快,促进肝葡萄糖的输出量提高。本实验结果显示,薯蓣粥的干预能显著降低肝组织PEPCK、G6Pase的基因和蛋白表达水平,且配合二甲双胍药物干预时降低更明显。分析原因可能与下调了T2DM大鼠血清TNF-α、IL-6、CRP水平和上调APN水平有关。可能机制[10-11]:(1)TNF-α、IL-6、CRP等炎性因子的增加会干扰IRS信号转导通路,抑制PI3K和Akt的磷酸化,进一步降低FoxO1蛋白磷酸化水平,从而上调PEPCK和G6Pase的表达,导致肝脏过度糖异生。(2)TNF-α、IL-6、CRP水平上升和APN水平下降均可降低AMPK活性,进而增加PEPCK和G6Pase的表达量,使肝脏糖异生增强。2018年的一项动物研究发现[28],药用植物可能通过缓解炎症反应对肝脏糖异生起到抑制作用。T2DM的常用药物二甲双胍亦以抑制肝脏糖异生为其主要降糖机制[29]。薯蓣粥由药食两用的生怀山药熬制而成,当与二甲双胍联合治疗时,将协同增强其抑制肝臟过度糖异生的能力。
降低FBG是T2DM的主要治疗目标之一。本实验结果显示,薯蓣粥干预6周能够有效降低FBG,这与周建[30]、陈芳[14]研究结果相一致。薯蓣粥仅由一味山药熬制而成,山药及其各药理成分在调节糖代谢异常中被广泛应用与研究。实验发现[31],山药提取物薯蓣皂苷以60 mg/kg的剂量连续干预8周能够明显降低T2DM出现的高血糖,进一步探讨,其分子机制与下调PEPCK、G6Pase的基因表达水平有关。该结论为山药以肝脏糖异生为作用靶点发挥降糖作用提供了可能。上述实验也反应出薯蓣粥的潜在优势,本研究薯蓣粥组每只大鼠每日灌胃薯蓣粥5 mL(含生怀山药2.5 g)即可下调PEPCK、G6Pase蛋白的表达,降低FBG水平。可能因为薯蓣粥提供的是山药中的多种成分,多种成分之间存在相辅相成的叠加效果,有待于今后分析薯蓣粥的有效成分、做进一步研究。二甲双胍作为治疗T2DM的一线药物,也被发现能够通过下调PEPCK和G6Pase的表达,降低血糖水平[29]。以上研究均提示,抑制肝脏过度糖异生有助于降低FBG。薯蓣粥与二甲双胍均对肝脏过度糖异生具有抑制作用,联合使用将使FBG下降程度更加明显。
综上所述,本实验研究表明,小剂量薯蓣粥连续干预6周即可有效降低T2DM大鼠FBG水平,并且推断其机制可能与下调T2DM大鼠血清TNF-α、IL-6、CRP水平和上调APN水平,进而减少肝组织PEPCK、G6Pase的基因和蛋白表达,抑制肝脏糖异生有关。同时发现,薯蓣粥联合二甲双胍药物可协同增强其降糖作用,符合临床T2DM患者在服用二甲双胍等降糖药的基础上辅助食用薯蓣粥的实际情况,为薯蓣粥更好的临床应用与推广提供了实验依据。
参考文献
[1] International Diabetes Federation. IDF diabetes atlas 9th edition(2019)[EB/OL].(2019-12-01)[2020-02-18]https://diabetesatlas.org/en/.
[2] CHO N H, SHAW J E, KARURANGA S, et al. IDF diabetes atlas: global estimates of diabetes prevalence for 2017 and projections for 2045[J]. Diabetes Research and Clinical Practice, 2018, 138: 271-281.
[3] HARDING J L, PAVKOV M E, MAGLIANO D J, et al. Global trends in diabetes complications: A review of current evidence[J]. Diabetologia, 2019, 62(1): 3-16.
[4] CHAPMAN D, FOXCROFT R, DALE-HARRIS L, et al. Insights for care: The healthcare utilisation and cost impact of managing type 2 diabetes-associated microvascular complications[J]. Diabetes Therapy, 2019, 10(2): 575-585.
[5] MENG J, CASCIANO R, LEE Y C, et al. Effect of diabetes treatment-related attributes on costs to type 2 diabetes patients in a real-world population[J]. Journal of Managed Care & Specialty Pharmacy, 2017, 23(4): 446-452.
[6] 郑铁生,鄢盛恺.临床生物化学检验[M].3版.北京:中国医药科技出版社,2015:111-132.
[7] 王春怡,高 颖,李 艳,等.黄芪散有效部位群对Ⅱ型糖尿病大鼠肝糖原及糖异生酶的影响[J].中药新药与临床药理,2018,29(1):1-7.
[8] 陈亚琼,王鹏飞,刘 浥.基于肝糖异生的降血糖药物研发进展[J]. 药学进展,2017,41(10):733-741.
[9] HU T G, WEN P, SHEN W Z, et al. Effect of 1-deoxynojirimycin isolated from mulberry leaves on glucose metabolism and gut microbiota in a streptozotocin-induced diabetic mouse model[J]. Journal of Natural Products, 2019, 82(8): 2189-2200.
[10] 宗久榆,孙蕊心,于 敏.脂肪组织对糖异生的调控作用[J].生命的化学,2017,37(5):842-848.
[11] 罗 旋,谭 伟,刘 军,等.慢性炎症加重肥胖小鼠肝糖代谢紊乱机制初探[J].重庆医科大学学报,2017,42(7):855-859.
[12] 聂启兴,胡婕伦,钟亚东,等.几类不同食物对肠道菌群调节作用的研究进展[J].食品科学,2019,40(11):321-330.
[13] 张锡纯.医学衷中参西录合订本[M].石家庄:河北人民出版社, 1977:73-74.
[14] 陈 芳.从肠道益生菌-IL-10/START3通路探讨薯蓣粥对T2DM大鼠的降糖机制[D].福州:福建中医药大学,2019.
[15] 卢桢妤.薯蓣粥对T2DM大鼠肠道内短链脂肪酸、脂多糖的影响[D].福州:福建中医药大学,2018.
[16] 庞书勤,辛惠明,刘玲玉,等.薯蓣粥对2型糖尿病肠道内双歧杆菌及血糖影响研究[J].中国实用内科杂志,2017,37(3):247-250.
[17] 李 才.人类疾病动物模型的复制[M].北京:人民卫生出版社, 2008:350-354.
[18] 徐淑云,卞如镰,陈 修.药理实验方法学第四版[M].北京:人民卫生出版社,2006:1861.
[19] VERMA S, MATHEW V, FARKOUH M E. Targeting inflammation in the prevention and treatment of type 2 diabetes: Insights from CANTOS[J]. Journal of the American College of Cardiology, 2018, 71(21): 2402-2404.
[20] LIU C X, FENG X, LI Q, et al. Adiponectin, TNF-α and inflammatory cytokines and risk of type 2 diabetes: A systematic review and meta-analysis[J]. Cytokine, 2016, 86: 100-109.
[21] SUN Y P, LIU T, SI Y P, et al. Integrated metabolomics and 16S rRNA sequencing to investigate the regulation of Chinese yam on antibiotic-induced intestinal dysbiosis in rats[J]. Artificial Cells, Nanomedicine, and Biotechnology, 2019, 47(1): 3382-3390.
[22] ZHANG N, LIANG T S, JIN Q, et al. Chinese yam (Dioscorea opposita Thunb.) alleviates antibiotic-associated diarrhea, modifies intestinal microbiota, and increases the level of short-chain fatty acids in mice[J]. Food Research International, 2019, 122: 191-198.
[23] KIM Y A, KEOGH J B, CLIFTON P M. Probiotics, prebiotics, synbiotics and insulin sensitivity[J]. Nutrition Research Reviews, 2018, 31(1): 35-51.
[24] LI M, VAN ESCH B C A M, HENRICKS P A J, et al. The anti-inflammatory effects of short chain fatty acids on lipopolysaccharide-or tumor necrosis factor α-stimulated endothelial cells via activation of GPR41/43 and inhibition of HDACs[J]. Frontiers in Pharmacology, 2018, 9: 533.
[25] 蔣 岚,陈 果,高陈林,等.益生菌对T2DM患者肠道菌群和脂联素的影响[J].中国现代医学杂志,2018,28(11):84-87.
[26] 刘 超,高慧婕,杨强强,等.二甲双胍对脂多糖致炎性反应小鼠的抗炎作用[J].基础医学与临床,2019,39(9):1248-1251.
[27] 陈金成,张 吟.AMPK与肝脏糖异生研究进展[J].中国现代应用药学,2017,34(7):1062-1067.
[28] LIU Q L, ZHANG L Y, ZHANG W, et al. Inhibition of NF-κB reduces renal inflammation and expression of PEPCK in type 2 diabetic mice[J]. Inflammation, 2018, 41(6): 2018-2029.
[29] 苏 青.二甲双胍降糖作用的分子机制[J].中华内分泌代谢杂志, 2016,32(9):716-722.
[30] 周 建.基于AMPK通路探讨薯蓣粥对T2DM大鼠胰腺自噬相关蛋白LC3-Ⅱ、p62的影响[D].福州:福建中医药大学,2019.
[31] XU L N, YIN L H, JIN Y, et al. Effect and possible mechanisms of dioscin on ameliorating metabolic glycolipid metabolic disorder in type-2-diabetes[J]. Phytomedicine, 2020, 67: 153139.
