老年嗜酸性肉芽肿性多血管炎患者临床特点及预后
2021-04-29张婷王芊霖彭敏饶可施举红
张婷,王芊霖,彭敏,饶可,施举红*
(1中国医学科学院北京协和医院呼吸与危重症医学科,北京 100730;2中国医学科学院北京协和医学院,北京 100730;3中日友好医院呼吸与危重症医学科,北京 100029)
ANCA相关性血管炎多见于中老年患者,且近20~30年来高峰发病年龄呈现进一步升高趋势[1]。针对GPA和MPA的研究显示,年龄是影响AAV患者预后的重要因素。相比年轻患者,老年患者在随访期间的血管炎损伤指数更高,严重感染等治疗相关并发症发生率更高[2]。与GPA、MPA相比,EGPA的发病年龄相对较轻(EGPA:38~54岁;GPA:45~65岁;MPA:55~75岁[3]),但年龄对于EGPA患者的预后仍然有重要影响。用于EGPA预后评估的2009版五因子评分(five factor score, FFS)[4]中,年龄>65岁、心功能不全、严重消化系统受累、肾功能不全及缺乏耳鼻喉受累,均为预后不良的预测因素。
目前,国内有关EGPA患者预后的研究较少,而针对老年EGPA患者临床及预后的研究更为缺乏,本研究针对老年EGPA患者的临床特征和预后进行分析,以了解老年EGPA患者在临床表现、器官受累、治疗及预后等方面与非老年EGPA患者的差异,并探讨影响老年EGPA患者预后的危险因素。
1 对象与方法
1.1 研究对象
本研究回顾性分析 2000 年1月至2015年12月就诊于北京协和医院并确诊为 EGPA 的门诊及住院患者,随访至 2019年12月。收集其人口学、基线临床资料及随访信息。纳入标准参考美国风湿病学会提出的EGPA分类标准[5]。
1.2 方法
1.2.1 分组方法 将所有入选患者按年龄分为2组:老年组(年龄≥60岁)和非老年组(年龄<60岁),比较2组患者临床症状、器官受累、实验室指标、疾病活动度、治疗方法及转归。
1.2.2 各器官受累界定 (1)肺受累:经CT扫描明确的肺实变、磨玻璃影、结节、小叶间隔增厚、胸腔积液以及肺泡出血(经肺泡灌洗液证实或存在与肺泡出血相匹配的临床及影像学);(2)耳鼻喉受累:经CT扫描、听力检查明确或由耳鼻喉专科医师诊断,包括鼻炎、鼻窦炎、鼻息肉、中耳炎及听力下降;(3)消化系统受累:包括消化道出血、消化道穿孔、肠梗阻、胰腺炎以及病理证实的消化道嗜酸性粒细胞浸润;(4)肾脏受累:包括蛋白尿(24 h尿蛋白>1 g)、镜下血尿、肾功能不全、肌酐(>150 μmol/L)或经病理证实;(5)心脏受累:临床表现符合且经心脏相关检查证实的心肌病变、心律失常、心包炎、心功能不全,经冠状动脉造影或CT血管造影证实的冠状动脉病变;(6)中枢神经系统受累:包括缺血性脑血管病、颅内出血、脊髄病变、颅神经麻痹、突发意识或认知功能障碍[4,6-8]。
1.2.3 疾病活动度评估 采用伯明翰血管炎活动度评分(Birmingham vasculitis activity score, BVAS)[9]。
1.2.4 疾病预后评估 采用2009版FFS进行评估。
1.3 统计学处理

动态规划(Dynamic Programming,DP)是运筹学的一个分支,是求解决策过程的最优化的数学方法,是一种强大的离散时间方法,可以为非凸最优控制问题提供全局解决方案[11].在实践中,需要对状态和控件进行离散化,从而产生一个网格,其中所涉及的变量只需要有限数量的离散值,对这些离散点进行成本计算.离散化越好,得到的解就越接近全局最优解.在离散化的情况下,用递归Bellman方程[12] (最优化原理)得到最优控制问题的解为
2 结 果
2.1 2组患者人口学资料、临床症状、实验室检查指标的比较
共纳入EGPA患者181例,其中男性110例,女性71例,中位年龄45(31,59)岁。老年组EGPA患者45例(24.9%),非老年组136例(75.1%)。
与非老年组相比,老年组患者血红蛋白(hemoglobin,HGB)水平较低,血沉 (erythrocyte sedimentation rate,ESR)和血清肌酐(serum creatinine,SCr) 水平较高,差异有统计学意义(P<0.05;表1)。
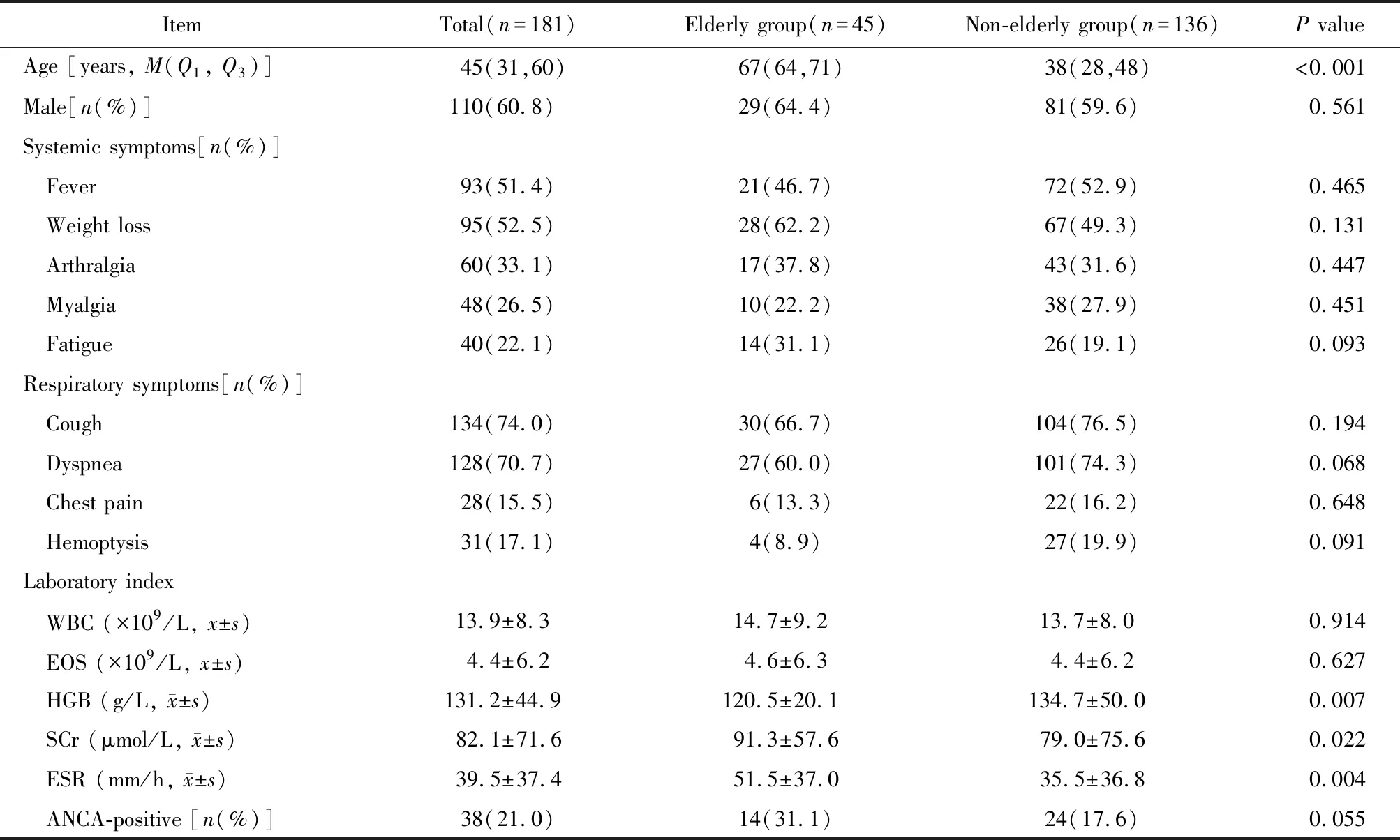
表1 老年组与非老年组EGPA患者人口学、临床症状、实验室检查指标的比较
2.2 2组患者器官受累、疾病活动度、治疗及转归的比较
哮喘、肺部浸润影为EGPA最常见的呼吸系统受累型式,肺泡出血少见,上述表现发生率2组间差异无统计学意义(P>0.05)。呼吸系统外器官受累中肾功能衰竭发生率2组间差异有统计学意义,以老年组更为常见(P<0.001;表2)。
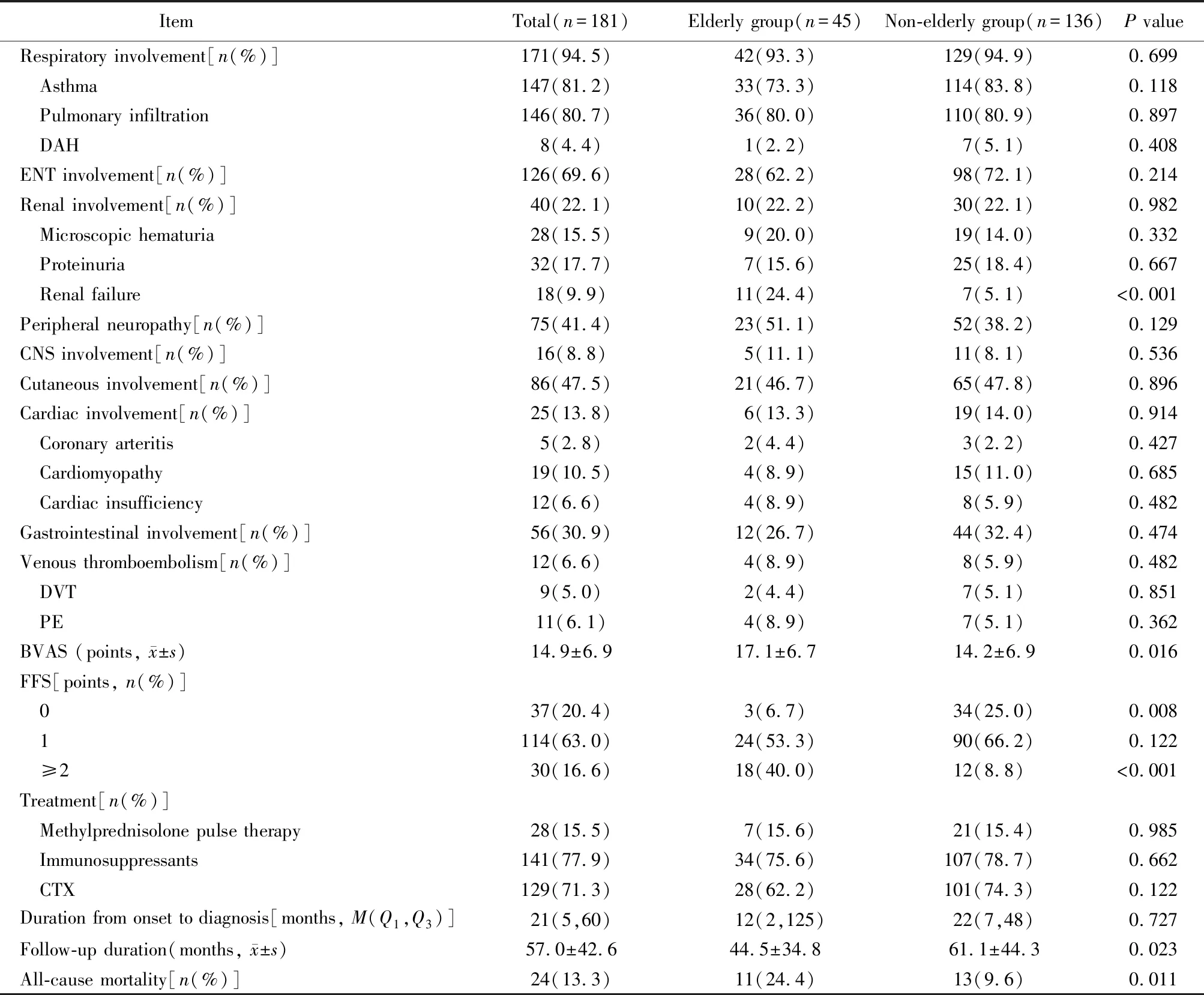
表2 老年组与非老年组器官受累、疾病活动度、治疗及生存的比较
与非老年组相比,老年组患者BVAS评分更高,FFS≥2分者比例更高,2组间差异有统计学意义(P<0.001;表2)。
所有患者均接受了激素治疗,其中激素冲击治疗2组间比例相近。70%以上患者接受了免疫抑制剂治疗,2组患者免疫抑制剂的总使用率无显著差异。患者随访至2019年12月,随访期(57.0±42.6)个月。随访期内,老年EGPA患者中有11例死亡,全因死亡率为24.4%,明显高于非老年组(P=0.011;表2)。
2.3 预后分析
先对181例EGPA患者进行单因素Cox回归分析,将结果显示为患者死亡的危险因素(表3)再纳入到多因素Cox回归分析,结果显示,年龄≥60岁、心肌病、中枢神经系统受累、消化道出血以及使用免疫抑制剂治疗为患者死亡的危险因素(表4)。
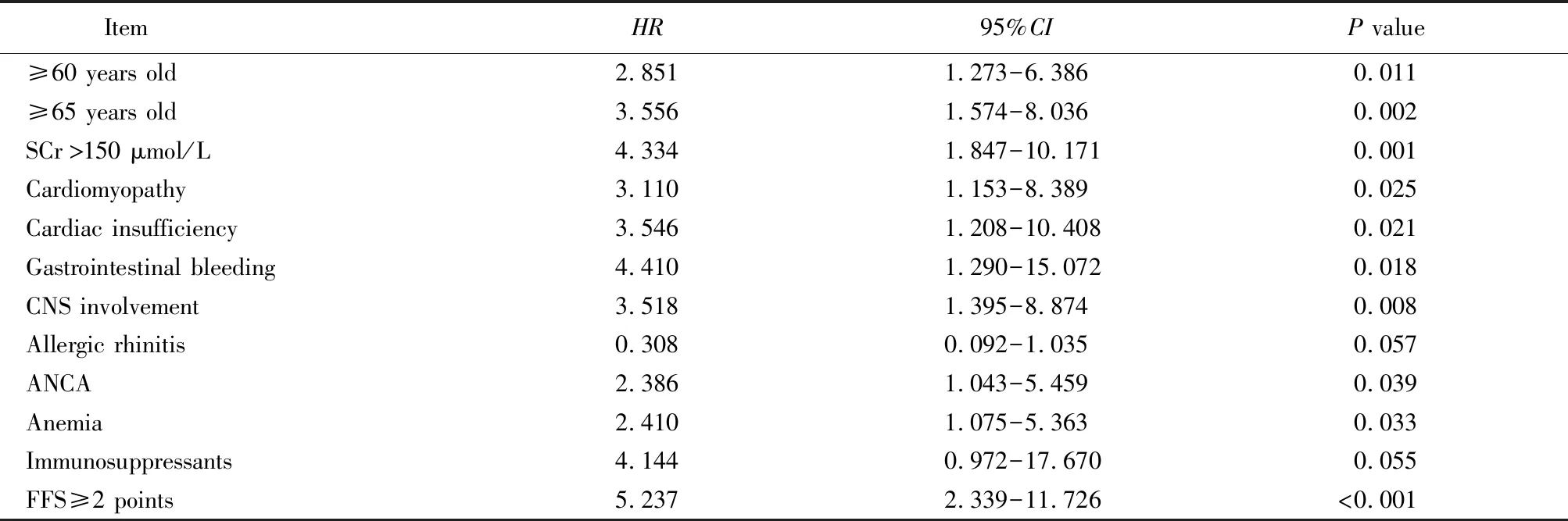
表3 单因素Cox回归分析预测EGPA患者死亡的因素
EGPA: eosinophilic granulomatosis with polyangiitis; SCr: serum creatinine; CNS: central nervous system; ANCA: anti-neutrophil cytoplasmic antibody; FFS: five-factor score.
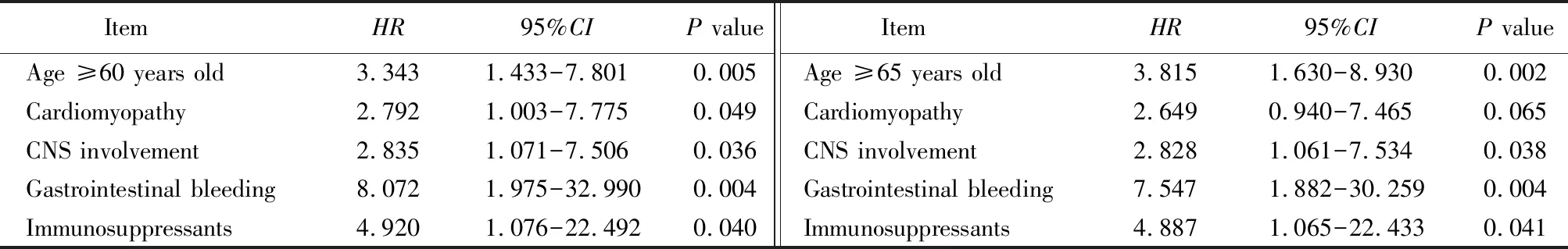
表4 多因素Cox回归分析预测EGPA患者死亡的因素
对老年组45例EGPA患者进行单因素Cox回归分析,结果显示,肺栓塞(pulmonary embolism, PE)、中枢神经系统受累、激素冲击治疗与死亡风险相关。多因素Cox回归分析结果显示,PE及激素冲击治疗是老年EGPA患者死亡的独立危险因素(表5)。
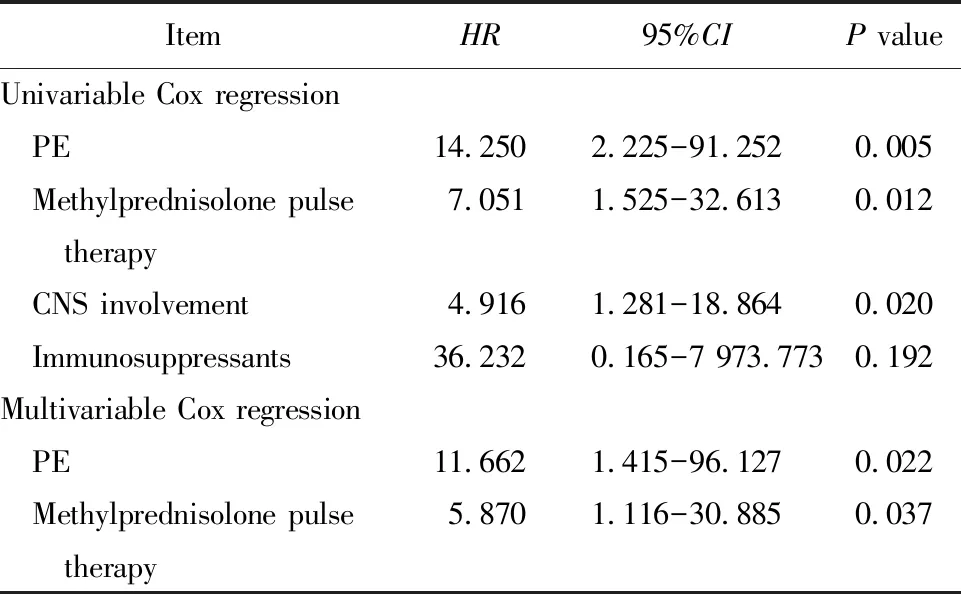
表5 老年EGPA患者死亡预测因素Cox回归分析
2.4 Kaplan-Meier生存曲线
采用Kaplan-Meier法绘制生存曲线,老年组与非老年组的生存函数差异有统计学意义(Log-rank=7.094,P=0.008;图1)。1年生存率:老年组为90.2%,非老年组为97.1%;5年生存率:老年组为75.1%,非老年组为94.6%;10年生存率:老年组为55.1%,非老年组为83.5%。根据是否为老年组及是否发生PE,将患者分为4组,4组患者生存函数差异有统计学意义(Log-rank=26.01,P<0.001);老年组中发生PE者与未发生PE者的生存函数差异有统计学意义(Log-rank=13.14,P<0.001);非老年组中发生PE者与未发生PE者的生存函数差异无统计学意义(P=0.890;图2)。
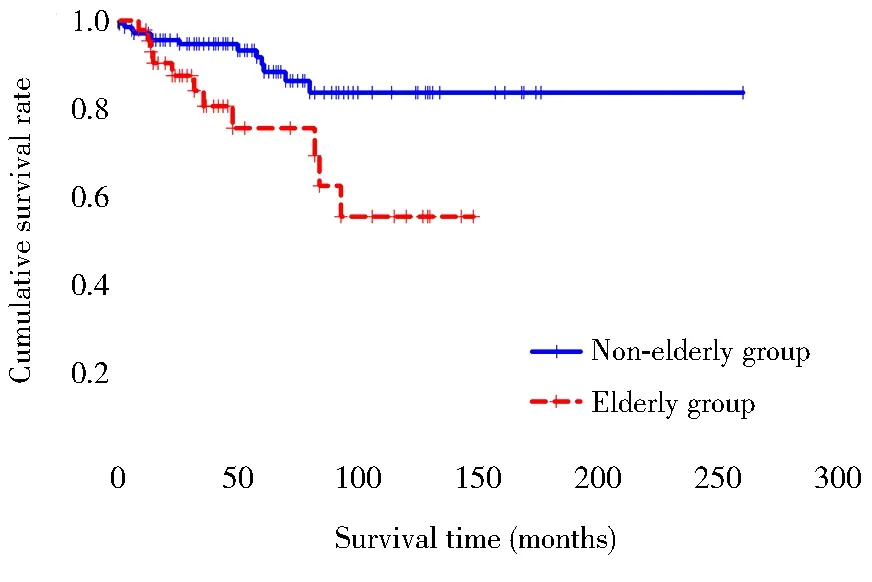
图1 老年组与非老年组生存曲线比较Figure 1 Comparison of survival curves between elderly group and non-elderly group

图2 老年及非老年患者有无肺栓塞生存曲线比较Figure 2 Comparison of survival curves among elderly group and non-elderly group with or without pulmonary embolismPE: pulmonary embolism.
3 讨 论
近20年来,对老年EGPA的关注越来越多[10,11],但针对老年EGPA患者的流行病学调查还很缺乏。Uchiyama等[11]回顾了2003年至2010年已报道的123例EGPA患者,年龄15~85岁,其中47.2%的患者年龄≥60岁。本研究中,年龄≥60岁的患者占24.9%,比例低于Uchiyama等的报道,可能与地域差异相关,也可能与两个研究纳入方法不同有关。
多项研究显示,年龄是影响EGPA患者预后的独立危险因素[8,12]。本研究也显示,老年组EGPA患者在随访期内的全因死亡率显著高于非老年组,5年及10年生存率低于非老年组,年龄≥60岁是EGPA患者死亡的独立危险因素。Samson等[13]的研究中,年龄≥65岁是EGPA患者死亡的唯一危险因素。在国际公认的用于预后评估的2009版FFS评分系统中,也将年龄>65岁作为预后不佳的因素之一。本研究中,Cox回归分析显示,年龄≥65岁患者在随访期内的死亡风险是年龄<65岁患者的3.815倍,年龄≥60岁患者在随访期内的死亡风险是年龄<60岁患者的3.343倍。可见,年龄≥60岁已经可以作为预后不良的预测指标之一。
肾脏受累见于25%~30%的EGPA患者[14,15]。Durel等[16]进行的多中心回顾性研究显示,63例病理证实肾脏受累的EGPA患者的中位年龄为60岁,较EGPA总体人群的发病年龄38~54岁更大。本研究发现,老年组EGPA患者较非老年组更多出现肾功能不全,并证实了SCr>150 μmol/L与EGPA患者不良预后相关。
本研究的第1个发现为相比非老年组,老年组EGPA患者BVAS评分更高,提示老年组患者疾病活动度较非老年组更高。Flossmann等[17]针对GPA和MPA的预后研究显示,BVAS评分高是患者死亡的危险因素之一。但BVAS评分用于预测EGPA患者预后的效果目前尚不明确。本研究结果中BVAS评分并非影响EGPA患者预后的独立危险因素,这一结果还需要更大样本量的队列研究去证实。
Flossmann等[17]的研究中,低HGB水平是ANCA相关性血管炎(GPA、MPA)患者不良预后的预测因素之一,可能是全身炎症反应强度的标志物。本研究中,老年组EGPA患者的HGB水平更低,而ESR更高,提示贫血也可能是EGPA患者全身炎症反应的表现。这一结果在国际及国内已发表的文献中尚未见报道。
本研究第2个发现为静脉血栓事件是影响高龄EGPA患者预后的不利因素。血栓栓塞事件曾被认为是EGPA的罕见表现,但近年来,有关EGPA合并静脉血栓栓塞(venous thromboembolism, VTE)的报道越来越多。Ames等[18]总结了1977年至2009年文献报道中VTE的发生率,2000年之前为3.1%~12.5%,2000年之后为5.8%~30.0%。本研究中,VTE发生率为6.6%,相比国际上的报道,处于较低水平。高龄是普通人群发生VTE的危险因素之一。Allenbach等[19]针对包含EGPA患者在内的1 130例AAV患者的研究显示,高龄也是AAV患者发生VTE的危险因素。本研究中,年龄≥60岁患者的VTE发生率为10.0%,略高于年龄<60岁患者的6.0%,但差异未达到统计学意义,可能与样本量较小有关。值得注意的是,针对老年EGPA患者死亡预测因素的Cox回归分析发现,PE是年龄≥60岁EGPA患者死亡的独立危险因素,这在已发表的文献中尚未见报道。老年EGPA患者的PE值得引起临床关注,在发生PE之前早期发现深静脉血栓并及时治疗可能有助于改善PE相关不良预后,预防性抗栓治疗是否可使老年EGPA患者受益,目前尚无循证医学证据,需要进一步的临床研究来证实。
激素及免疫抑制剂治疗使AAV患者的生存率大幅提高,但也导致了感染等不良反应,高龄及肾功能不全是发生药物不良反应的危险因素[20]。EGPA治疗指南推荐FFS≥1分的患者使用激素联合免疫抑制剂进行诱导缓解治疗,危及生命情况下,给予甲强龙冲击治疗[21]。但是否所有老年患者均应使用激素、免疫抑制剂联合治疗,目前并没有高质量循证医学证据。本研究结果显示,使用免疫抑制剂与EGPA患者不良预后相关,对于老年EGPA患者,激素冲击治疗是死亡的独立危险因素。由于免疫抑制剂及激素冲击治疗均用于病情危重的患者,最终的死亡是因免疫抑制的不良反应所致,还是因为病情过于危重所致,目前尚无法厘清。有研究显示,环磷酰胺等免疫抑制剂引起的感染等不良反应会抵消其对AAV的诱导缓解作用[22]。对于高龄EGPA患者是否应该使用以及如何使用免疫抑制剂值得进一步研究和探讨。老年EGPA患者的治疗需要寻找新的安全而有效的药物。目前已有研究者尝试使用利妥昔单抗替代环磷酰胺,以治疗传统免疫抑制治疗无效的老年EGPA,一项小型回顾性研究结果提示,利妥昔单抗是一种安全有效的备选方案[23]。此外,抗免疫球蛋白E单抗(奥马珠单抗)[24,25]、白介素-5拮抗剂(美泊利单抗)[26]等生物制剂也开始尝试用于难治性EGPA患者,但是否适合于老年EGPA患者的治疗,还有待于进一步的随机对照研究来评判。
本研究的不足之处在于其回顾性研究的特点。此外,由于近年来治疗方法的发展,EGPA患者生存率明显提高,短期死亡患者数量较少,对患者生存预后分析提出了挑战。尽管如此,本研究已是近年来研究老年EGPA患者中样本量相对较大的,且对患者进行了长期随访,结论具有一定可参考性。
本研究显示,老年EGPA患者更易出现肾功能不全,全因死亡率更高。年龄≥60岁、心肌病、中枢神经系统受累、消化道出血及使用免疫抑制剂是EGPA患者死亡的独立危险因素。对于老年EGPA患者,PE对预后带来的不利影响应引起临床医师的关注,激素冲击及免疫抑制治疗是否对老年EGPA患者有益有待于进一步探讨。
