膜联蛋白Ⅴ微泡体外高特异性靶向识别凋亡细胞
2021-04-27李梦琴冯煜然
李梦琴,朱 梅,冯煜然,范 旭
(昆明医科大学第一附属医院超声科,云南 昆明 650032)
甲状腺结节发病率达70%。采用微波消融原位灭活可致肿瘤细胞坏死,但消融过程中过高热能可能损伤周围组织[1]。细胞凋亡是启动自主程序性死亡的过程[2],诱导凋亡所需消融能量或化学治疗(简称化疗)剂量通常较低,可显著提升治疗的安全性。目前多通过实验室检测方法识别和评价凋亡,如光镜/电镜下观察形态学、检测DNA片段、凋亡相关基因及产物等[3]。膜联蛋白Ⅴ(annexin Ⅴ)实验室检测细胞凋亡已得到广泛临床应用,核素显像及CT、MRI分子影像领域相继开展了相关实验研究,但以声学显影方法实时识别凋亡的研究报道较少。本研究尝试制备可靶向识别凋亡细胞的超声微泡(microbubbles, MB),并评价其体外识别凋亡细胞的能力,旨在以简便直观的影像学方法判定肿瘤凋亡及凋亡范围。
1 材料与方法
1.1 主要材料 CAL-62人甲状腺未分化癌细胞株(北纳生物),annexin Ⅴ抗体、山羊抗兔IgG-FITC(Abcom公司),亲和素(avidin,Sigma-Aldrich公司),二棕榈酰磷脂酰胆碱(dipalmitoyl phosphatidyl choline, DPPC)、甲氧基聚乙二醇(methoxypolyethylene glycols, MPEG)200、二棕榈酰基磷脂酸(dipalmitoyl phosphonic acid, DPPA)、二硬脂酰磷脂酰乙醇胺-聚乙二醇(distearoylphosphatidylethanolamine-polyethylene glycol, DSPE-PEG)2000、二棕榈酰磷脂酰乙醇胺-聚乙二醇-生物素(dipalmitoylphosphatidylethanolamine-polyethylene glycol-biotin, DSPE-PEG-Biotin)、二棕榈酰磷脂酰乙醇胺-聚乙二醇(dipalmitoylphosphatidylethanolamine-polyethylene glycol, DSPE-PEG)200(Avanti公司),细胞培养液Hyclone(DMEM公司),annexin Ⅴ/碘化丙啶(annexin Ⅴ/propidium iodide, annexin Ⅴ/PI)凋亡试剂盒(BD公司),一步法Tunel细胞凋亡原位检测试剂盒(KeyGEN BioTECH公司),细胞膜红色荧光探针(DiI,索莱宝公司)。
1.2 主要仪器 Olympus荧光显微镜,RHERMO台式高速冷冻离心机,威尔德机械振荡仪,Malvern表面电位仪,康友微波消融仪,诺禾致源流式细胞仪。
1.3 制备MB 取DPPC、MPEG200、DPPA、DSPE-PEG2000-Biotin,按摩尔比80∶5∶5∶10充分混悬后分装于3 ml西林瓶中,采用特定冻干工艺程序,全氟丙烷置换空气,加入溶酶液(三羟甲基氨基甲烷∶甘油∶丙二醇体积比为8∶1∶1)制成生物素化MB,充分振荡、离心洗涤后依次加入avidin、annexin Ⅴ抗体、山羊抗兔IgG-FITC,孵育20 min后离心洗涤制得FITC标记的annexin Ⅴ靶向MB。
取DPPC、MPEG200、DPPA及DSPE-PEG2000,按相同摩尔比充分混悬,经冻干工艺程序后,全氟丙烷置换空气,加入溶酶液,机械振荡仪充分振荡后得到普通MB。
1.4 评价annexin Ⅴ靶向MB理化性质及稳定性 将50 μl靶向MB 加入100 ml电解液中,采用粒径分析仪测量粒径分布范围、以表面电位仪测量Zeta电位后置入4℃冰箱内避光保存。于制成时、制成7天、14天及1个月后于镜下观察MB形态大小及分布情况;取1 ml靶向MB原液,以磷酸盐缓冲液(phosphate buffer solution, PBS)稀释10倍,加入血球计数板,镜下计数3次,取平均值计算平均浓度:MB浓度(MB数/ml)=80小格MB数/80×400×104×稀释倍数。
1.5 获取凋亡CAL-62细胞初步筛选最佳消融参数 将CAL-62细胞传代种植于直径35 mm培养皿中,生长至对数期,分为消融组(以1~15 W、2~5 min进行分组消融)及对照组(仅插入电极);将微波电极斜插入培养皿,电极匀速均匀转动,均匀加热使细胞受热。消融结束后以胰酶消化离心,采用annexin Ⅴ/PI凋亡试剂盒及流式细胞术检测凋亡情况,记录并分析数据,获得最佳消融参数。
1.6 鉴定凋亡细胞
1.6.1 流式细胞术及Tunel试验检测细胞凋亡 采用最佳消融参数再次对细胞进行微波消融,先后加入annexin Ⅴ与PI,孵育后采用流式细胞仪检测。取一步法Tunel细胞凋亡原位检测试剂盒,按说明操作,之后于荧光显微镜下观察细胞凋亡情况。(即A、B、C共3组)
1.6.2 观察annexin Ⅴ靶向MB特异性结合凋亡细胞 取3份肿瘤细胞,每份计数约2×104个,对其中2份行微波消融,1份作为对照而不予处理,观察其寻靶情况。A组(凋亡细胞+普通MB):取凋亡肿瘤细胞,以PBS洗涤3次,加入普通MB孵育20 min后再以PBS轻柔缓慢冲洗3次,置于普通光学显微镜下观察。B组(正常细胞+靶向MB):取正常细胞。C组(凋亡细胞+靶向MB):取凋亡肿瘤细胞。对B组及C组细胞以PBS洗涤3次,加入DiI细胞膜染料,避光孵育15 min后以PBS洗涤3次,加入annexin Ⅴ靶向MB,避光孵育20 min后再以PBS轻柔缓慢冲洗3次,置于荧光显微镜下观察。
2 结果
2.1 镜下观察MB 普通光镜及荧光显微镜下,annexin Ⅴ靶向MB和普通MB分布均匀,为大小一致的泡状结构(图1A、1B);荧光显微镜下,靶向MB呈花环状绿色荧光结构(图1C),普通MB不发出荧光(图1D)。

图1 显微镜镜下annexin Ⅴ靶向MB与普通MB图像(×200) A、B.光镜下观察annexin Ⅴ靶向MB(A)与普通MB(B); C、D.荧光显微镜下观察annexin Ⅴ靶向MB(C)与普通MB(D)
2.2 靶向MB理化性质及稳定性 annexin Ⅴ靶向MB大小均一,分布均匀,理化性质稳定,平均粒径(0.78±0.06)μm,Zeta电位为(-22.70±1.80)mV(图2)。制成时、制成7天、14天及1个月后靶向MB平均浓度分别为4.23×108/ml、2.70×108/ml、2.21×107/ml及3.70×105/ml。随时间延长,镜下所见MB粒径逐渐增大、分布由均匀转为聚集,荧光强度则逐渐减弱。

图2 annexin Ⅴ MB粒径分析结果
2.3 细胞消融最佳参数 随功率增加,不同消融时间下细胞存活率总体呈下降趋势,凋亡率及死亡率总体呈上升趋势,死亡率升高时凋亡率相对有所下降;微波消融CAL-62细胞最佳参数为功率10 W、时间3 min(图3)。
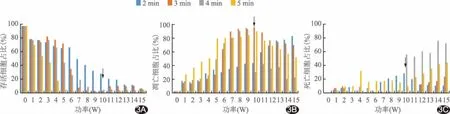
图3 不同消融时间细胞存活率(A)、凋亡率(B)及死亡率(C) (箭示最佳消融参数)
2.4 鉴定凋亡细胞 根据细胞凋亡早期膜内磷脂酰丝氨酸(phosphatidylserine, PS)外翻至膜外、可与annexin Ⅴ高亲和力结合而PI可进入晚期凋亡及死细胞包膜内,可区分活细胞、早期、晚期凋亡及死细胞(图4)。
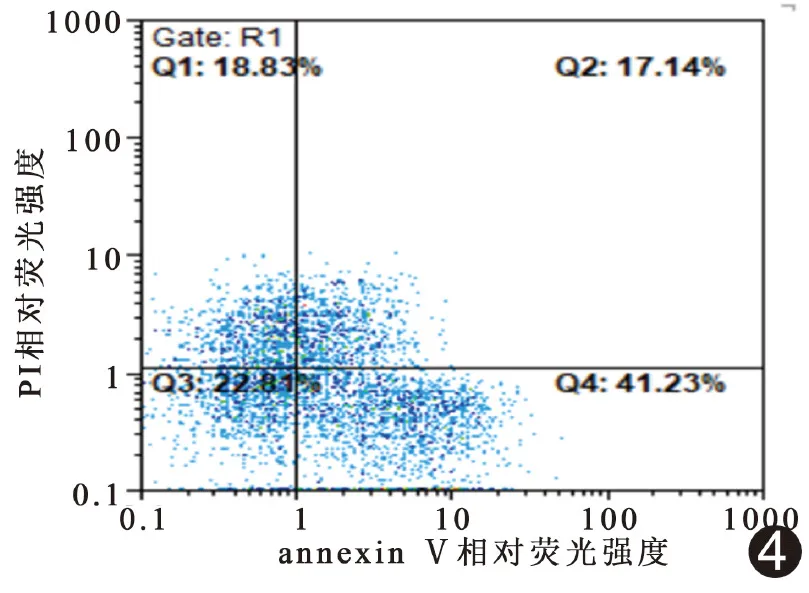
图4 流式细胞术鉴定凋亡细胞 Q1、Q2、Q3、Q4分别为死亡、晚期凋亡、活细胞及早期凋亡细胞占比
Tunel检测法:以红色荧光素标记的脱氧尿嘧啶核苷三磷酸在末端脱氧核苷酸转移酶作用下可与凋亡细胞内DNA断链3’-OH末端链接;凋亡细胞细胞质内的断链DNA在荧光显微镜下呈红色荧光,以DAPI(4',6-二脒基-2-苯基吲哚)复染细胞核后,凋亡与非凋亡细胞的细胞核在荧光显微镜下呈蓝色,二者重合而呈紫红色,即为凋亡细胞(图5)。

图5 消融后细胞Tunel实验merge图(×100) 蓝色胞核与红色荧光核酸断链重合呈紫红色,即为凋亡细胞
2.5 annexin Ⅴ靶向MB体外识别凋亡细胞 A组:荧光显微镜下仅见消融后肿瘤细胞,未见与凋亡细胞稳定结合的普通MB(图6A);B组:镜下仅见正常细胞,未见正常细胞与靶向MB稳定结合(图6B);C组:镜下见凋亡细胞与annexin Ⅴ靶向MB稳定结合(图6C、6D)。
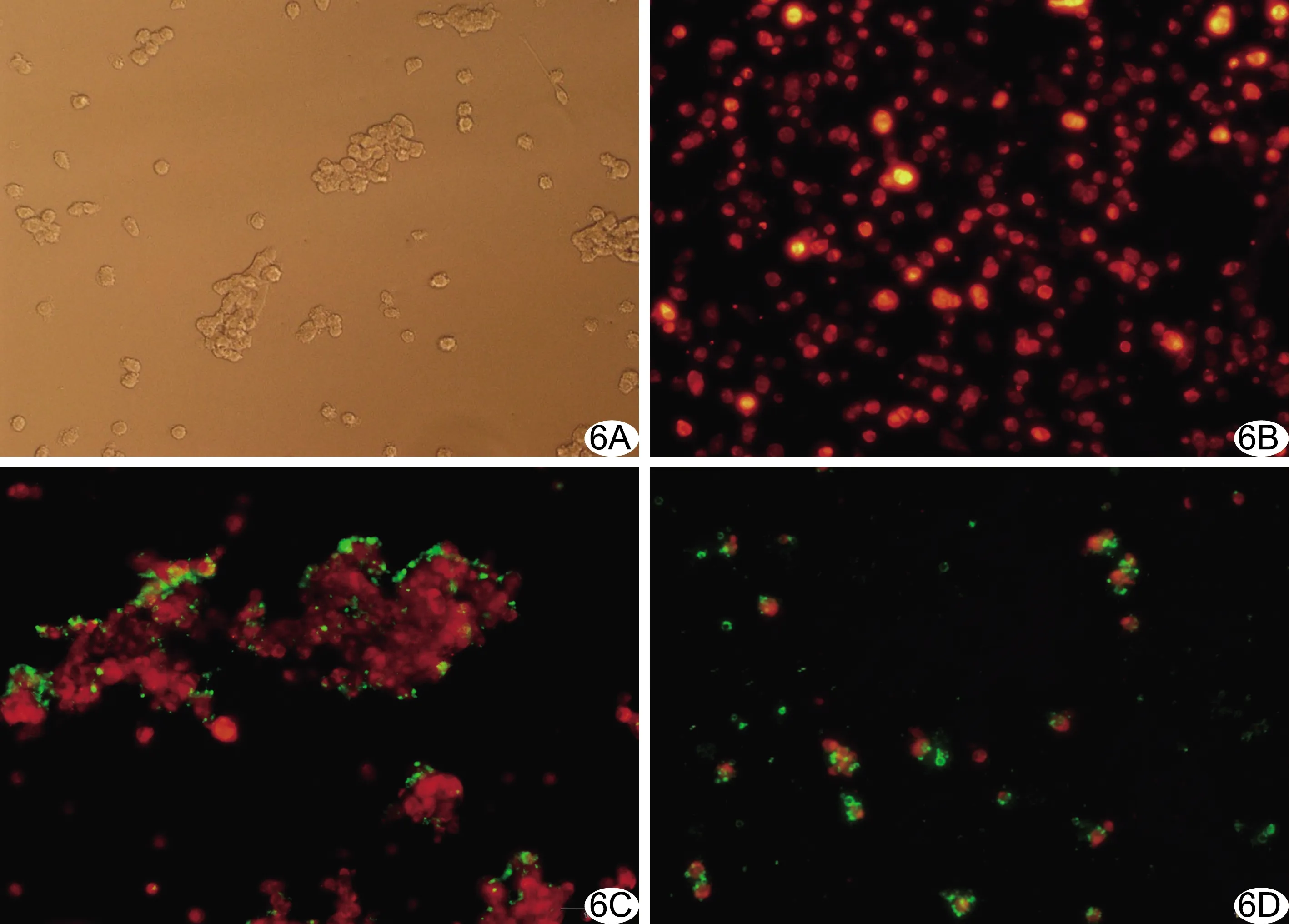
图6 镜下annexin Ⅴ MB体外寻靶图(×100) A、B.分别为荧光显微镜下观察A组及B组; C、D.镜下观察C组,细胞标记为红色荧光,靶向MB标记为绿色荧光
3 讨论
为有效消融甲状腺肿瘤,临床多选择高功率、长时间消融模式,其所带来的过高热能易损伤周围组织,引起不可逆的并发症[1];而以低能级超声诱导肿瘤细胞凋亡[4]同样可达到治疗目的,若治疗过程中能够识别凋亡和凋亡范围,则可在提高治疗安全性的同时保证其有效性,具有重要临床应用价值。
annexin Ⅴ对凋亡早期自细胞膜内侧外翻至膜外的PS具有高亲和力[5],将annexin Ⅴ加载到超声MB上,即可制备出能够靶向识别凋亡细胞的新型功能性MB。本实验采用生物素化MB链接亲和素,进一步结合annexin Ⅴ及荧光二抗的方法成功制备了粒径小、大小均一、性质稳定的annexin Ⅴ靶向MB。生物素-亲和素系统是已知最强的非共价作用,每个亲和素分子有4个生物素结合位点[6],呈多级放大模式,可避免浪费抗体,保证抗体高携载率;按特定顺序制泡,逐步分离、提纯未与MB链接的亲和素、抗体及脂质膜碎片[7],可提高靶向MB纯度。
目前关于微波治疗的临床应用研究较多,但应用凋亡理论避免毒副损伤的报道较少。为验证annexin Ⅴ靶向MB的特异性识别能力,首先需获取凋亡细胞。有学者[8]采用顺铂或紫杉醇等化疗药物诱导肿瘤细胞发生凋亡,再进行体外寻靶。本实验采用微波消融肿瘤细胞,经流式细胞术及Tunel检测,验证了微波消融可诱导CAL-62细胞凋亡,为annexin Ⅴ MB体外寻靶奠定了基础。为保证后续实验效果,首先进行预实验,筛选消融参数,获取了凋亡率最佳的细胞样本。体外寻靶实验中,A组、B 组细胞均不具备靶向对应性,未见与细胞稳定结合的MB;而C组annexin Ⅴ靶向MB可与凋亡细胞外翻的PS高亲和度结合,提示相对于普通MB,annexin Ⅴ靶向MB识别凋亡细胞具有高度特异度与敏感度。
既往相关研究[9-10]多利用超声MB携载靶向配体、治疗药物或基因,并取得了一定成果。目前靶向MB多用于对局部组织的特异性寻靶,以针对性诊断特定疾病。本实验制备的靶向MB未添加特异性识别特定肿瘤的靶向分子,仅针对性识别凋亡细胞外翻的PS分子[5],可用于检测正常组织及肿瘤组织等细胞凋亡状况,并有望由此建立无创识别凋亡细胞的特异性靶向显影方法[8],评估临床抗癌疗效,减少治疗过程中正常组织的损伤,降低并发症风险。
本研究不足之处在于annexin Ⅴ靶向MB体外识别凋亡细胞仅是初步寻靶体外实验,其体内显影效果有待观察;且需进一步改进设计,提高制备annexin Ⅴ靶向MB的成功率。
