咪唑型离子液体溶液中纤维素酶荧光活性测定1)
2021-04-27刘婷婷张鑫艺隋小宇陈刚王慧玉张杰孙辑凯徐涛
刘婷婷 张鑫艺 隋小宇 陈刚 王慧玉 张杰 孙辑凯 徐涛
(齐齐哈尔医学院,齐齐哈尔,161006)
离子液体以其独特的性质,作为一种“绿色溶剂”用于植物活性成分的萃取分离,具有潜在优势。离子液体目前主要应用于合成、催化、萃取等领域,近年来,基于离子液体的固液萃取技术在植物化学研究领域越来越受到关注[1],已发展应用于生物碱[2]、黄酮类[3-4]、香豆素[5]、木脂素类[6]等药用植物活性成分的萃取分离过程。
尽管离子液体在很多萃取研究中体现出优于传统萃取溶剂的性质,但其不足之处也十分明显[7]。首先,纯离子液体的黏度大,与传统萃取过程相比,其萃取过程中的混合和传质性能会显著下降。向离子液体中添加分子溶剂作为稀释剂,通过离子—分子相互作用及溶剂化效应可有效削弱离子间的相互作用及其微观聚集结构,显著降低体系的黏度,促进传递过程的进行[8-9]。目前的研究多采用离子液体-水复合溶剂实现活性物质的固液萃取[10-13],水作为共溶剂,降低离子液体的黏度,提高了溶剂的扩散能力。但离子液体-水复合溶剂对植物原料的渗透性较差,分散速度缓慢。
选用纤维素酶作用于植物材料,降解构成细胞壁的物质,破坏细胞壁的致密结构,减小传质阻力,从而有利于有效成分的提取。而咪唑类离子液体中加入纤维素酶,纤维素酶可以降解纤维素、果胶而破坏植物细胞壁,从而使提高子液体的扩散能力。其意义在以下几方面体现:①纤维素酶能够有效破坏植物细胞壁,减小溶剂扩散阻力;②纤维素酶破坏细胞壁会使细胞内成分溶解、混悬于溶剂中,利于提取分离;③节约时间和溶剂;④提高了离子液体渗透能力。而这其中首要工作是要保证纤维素酶在离子液体-水中的酶活力。测定纤维素酶酶活的方法有化学法(底物、产物分析)、荧光法、同位素测定法和电化学法[14-15]。本研究采用荧光分析法考查咪唑类离子液体中纤维素酶的荧光活性。荧光光谱分析法的主要优点是灵敏度高、选择性高、干扰小、试样量小,相比于化学法操作简便[16]。利用荧光光谱法分析不同1-烷基-3-甲基咪唑类离子液体水溶液中纤维素的酶活力,为离子液体的选择和利用提供基础数据。此外,离子液体已广泛应用于生物质资源转化领域[17],在预处理过程中,借助纤维素酶的水解作用,有效提高纤维素的降解效率[18-20]。本研究结果也将为该领域中的纤维素酶的酶学特性提供借鉴和参考。
1 材料与方法
1.1 材料
纤维素酶,以羧甲基纤维素钠为底物的酶活≥1×106U/g,银川市和氏璧生物技术有限公司;11种咪唑类离子液体1-丁基-3-甲基咪唑四氢氟硼酸盐[Bmim]BF4,溴化1-辛基-3-甲基咪唑[Omim]Br溴化1-己基-3-甲基咪唑[Hmim]Br, 1-丁基-3-甲基咪唑硝酸盐[Bmim]NO3,溴化1-乙基-3-甲基咪唑[Emim]Br, 1-丁基-3-甲基咪唑对甲苯磺酸盐[Bmim]MBS, 1-丁基-3-甲基咪唑硫酸氢盐[Bmim]HSO4, 氯化1-烯丙基-3-甲基咪唑[Amim]Cl, 氯化1-苄基-3-甲基咪唑[Bzmim]Cl, 氯化1-丁基-3-甲基咪唑[Bmim]Cl, 溴化1-丁基-3-甲基咪唑[Bmim]Br, 上海成捷化学有限公司,使用时未经进一步纯化,去离子水为实验室自制。荧光光谱仪LS-45/55, 美国PerkinElmer。
1.2 纤维素酶的荧光光谱
配制质量浓度为2 g/L纤维素酶于柠檬酸缓冲溶液中(pH= 4.8, 50 mmol/L),扫描纤维素酶的激发光谱和发射光谱,得到纤维素酶的最大激发波长(λex,max)和最大发射波长(λemx,max)及荧光强度。扫描范围200~800 nm,激发单色器狭缝宽度20 nm,发射单色器狭缝宽度5 nm,循环水浴温度50 ℃。
1.3 离子液体溶液中纤维素酶的荧光活性测定
配置一定浓度的离子液体溶液与上述酶溶液等体积混合后, 在相同的作用时间内,以纤维素酶λex,max波长为激发光,于λemx,max下检测纤维素酶的荧光活性,空白分别为各离子液体溶液。
2 结果与分析
2.1 纤维素酶的荧光光谱特征
在蛋白质分子中,能发射荧光的氨基酸有色氨酸(Trp)、酪氨酸(Tyr)及苯丙氨酸(Phe)。个别蛋白质分子含有的黄素腺嘌呤二核苷酸(FAD)也能发射荧光。Trp、Tyr及Phe荧光强弱顺序从大到小依次为Trp、Ty、Phe。通常,蛋白质的荧光通常在 280 nm 或更长的波长被激发,因此Phe在绝大多数实验条件下不被激发。蛋白质的内源荧光主要来自Trp和Tyr 残基。Trp 残基对微环境的变化很敏感,因而常作为内源荧光探针来研究溶液状态下蛋白质的构象[21]。目前,对于荧光光谱的研究主要在猝灭剂、溶剂、电磁场及金属离子等对酶构象方面[22-23]。因此,可以根据蛋白质溶液在280 nm附近的激发波长下所产生较高强度的荧光,根据蛋白溶液的荧光光谱特征,可以分析蛋白结构的变化,进而考查环境等因素对纤维素酶活力的影响[24]。
结果如图1所示,纤维素酶的最大激发波长270 nm(荧光强度194.43),最大发射波长 346 nm (荧光强度196.05),它的荧光发射光谱和激发光谱之间存在着镜像对称关系。由于纤维素酶为蛋白质,荧光活性主要来自于其色基酸残基,其荧光活性的稳定性有待考查,因此不同时间点(30、 60、90、120 min)分别考查纤维素酶的荧光活性,其荧光强度在190.44~193.04范围内变化,说明其荧光活性在2 h内是较稳定的。
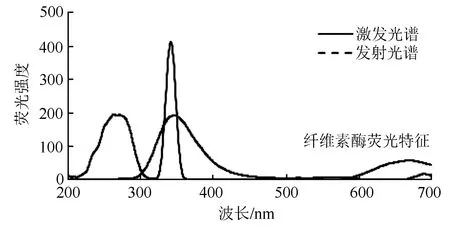
图1 纤维素酶的荧光光谱特征
2.2 离子液体溶液对纤维素酶的荧光活性的影响
2.2.1 离子液体的荧光干扰
离子液体在酶荧光活性测定时会存在一定程度的干扰,最终导致酶荧光活性测定准确度降低。因此对离子液体溶液自身的荧光干扰进行了考查。结果如表1所示,11种咪唑型离子液体中在346 nm处的荧光强度较小,对酶活性测定影响较小。

表1 离子液体溶液的荧光干扰
2.2.2 离子液体结构对纤维素酶荧光活性的影响

阳离子碳链长度。阴离子均为Br-时,碳链长度不同对纤维素酶荧光强度产生影响亦不相同。阳离子碳链长度越长,纤维素酶的荧光强度降低幅度越大,当碳链的原子数目为2或4个时对酶活性影响最小。这可能由于空间位阻的影响,使得纤维素酶空间结构、褶皱程度发生改变,导致其分子内的荧光猝灭,其具体影响如表2所示。
阳离子不饱和程度。阴离子均为Cl-时,分别考查了阳离子碳链的不饱和程度对纤维素酶荧光强度影响,荧光活性大小依次顺序为丁烷基、烯丙基、苄基, 阳离子不饱和程度越大对酶的活性影响越大。
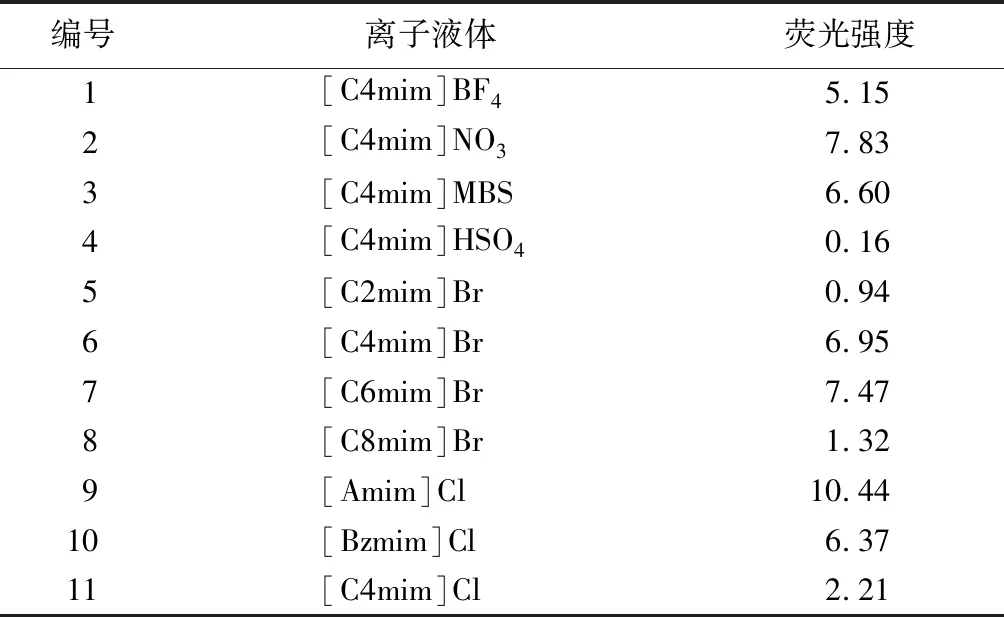
表2 离子液体溶液中纤维素酶的荧光活性
2.2.3离子液体溶液浓度对纤维素酶荧光活性的影响
如表3所示,离子液体溶液浓度分别为0.40、0.25、0.20、0.10 mol/L时,11种咪唑类离子液体中纤维素酶荧光活性随浓度的增高成递减的趋势,浓度越低,对酶活性影响越小。
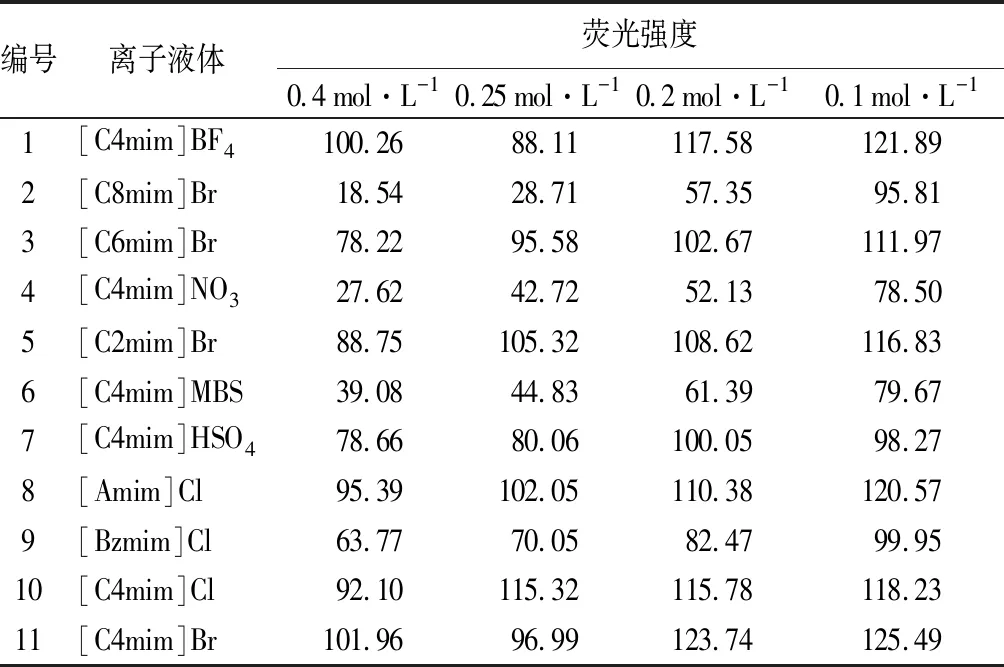
表3 纤维素酶在不同浓度离子液体中的荧光强度
3 讨论与结论
纤维素酶系蛋白质中,因其含有色氨酸、酪氨酸、苯丙氨酸等氨基酸残基而产生较强的内源荧光。 影响分子发光的环境因素有:溶剂、介质酸碱性、介质的温度和黏度及有序介质。当某些因素作用于蛋白质后,会导致其荧光强度下降,这种现象称为荧光猝灭作用。一般来说,不同阴离子组成的离子液体影响纤维素酶活性,结果在一定程度上符合离子对蛋白质稳定性的Hofmeister规律[16];离子液体中碳链长度较长的阳离子对纤维素酶有较大的抑制作用,但未达到失活水平;最明显的是高浓度的离子液体会使酶在一定程度上失去部分活性。
从Chen、Liu et al.[25-26]的研究可以看出,在低浓度的咪唑型离子液体溶液中,纤维素酶保持一定的活性,对水解纤维素保持有效的催化效率,能够破坏细胞壁,提高传质。Cui et al.[27]对1-烷基-3甲基咪唑型离子液体溶液中纤维素酶、半纤维素酶、果胶酶、蛋白酶对喜树翅果进行处理,其中以[Omim]Br+半纤维素酶溶剂体系在目标化合物的溶出效果上优势明显,这可能与喜树翅果细胞壁主要以半纤维为主有关。本研究的光谱学研究结果显示,低浓度的离子液体溶液对纤维素酶酶活力有一定影响,其还具备一定催化水解能力和效率。
