酵母菌和双歧杆菌发酵对大麦苗SOD 及抗氧化活性的影响
2021-04-26边传周唐桂芬陈复生
张 雪 ,边传周 ,唐桂芬 ,陈复生
(1.河南牧业经济学院食品与生物工程学院,河南 郑州 450011;2.河南牧业经济学院实验中心省级重点实验室,河南 郑州 450011;3.河南工业大学,河南 郑州 450000)
大麦苗是我国种植面积较广的农业资源,其幼苗富含叶绿素、类黄酮、维生素、抗氧化酶及蛋白质等多种功能营养成分[1]。《本草纲目》记载:“麦苗解盅毒,除烦闷,解时疫狂热,退胸隔热,利小肠[2]”。目前,大麦苗加工方式简单粗放,加工产品口感粗糙,不利于人体肠道的吸收和消化。为满足人们日益增长的营养健康需要,需深入研究大麦苗加工工艺,提高其功能成分含量,生产出易于人体消化的产品[3]。大麦苗粉是以大麦嫩叶加工而成的微粉,是超氧化物歧化酶(SOD)和过氧化氢酶的丰富来源[4],也是一种能增强人体免疫力的功能食品[5-6]。但其溶解性较低,难以充分体现大麦苗的市场价值和优势。
目前关于大麦苗精深加工的研究已有一些文献报道。徐春[7]以新鲜大麦苗和鲜牛奶为主要原料,通过添加适当的发酵剂及辅料,研制出一种口感良好的大麦苗酸乳;高飞虎等[8]以大麦苗和小麦粉作为主要原料,加工成富含麦绿素的营养面条,具有较好的食疗功效;陈为凤等[9]对大麦苗饮料的稳定性进行了探讨。但同时采用酵母菌、双歧杆菌分段发酵大麦苗,并探究组合发酵对大麦苗SOD 活性及抗氧化活性影响的研究较少报道。
本文以大麦苗粉为原料,以酵母菌和双歧杆菌为菌种,分别采用SOD 活力和双歧杆菌浓度为主要指标,通过调配、分段发酵等步骤,对大麦苗的发酵工艺进行了优化。大麦苗可为酵母菌发酵提供碳源,同时其自身的组分被代谢转化为次生产物,如超氧化物歧化酶的前体物;进一步采用双歧杆菌发酵,可使大麦苗中的酚类化合物形态转化,从而提高其生物活性。本研究可为组合发酵改善大麦苗的功能特性提供理论依据,同时提升其经济效益和应用价值。
1 材料与方法
1.1 材料与设备
1.1.1 材料与试剂
大麦苗粉、D-阿洛酮糖:上海惠诚生物科技公司;酵母菌(食品级):安琪酵母股份公司;双歧杆菌(食品级):北京川秀科技有限公司;三羟基氨基甲烷、浓盐酸、乙二胺四乙酸二钠、焦性没食子酸、氢氧化钠、邻苯二甲酸氢钾、氯化钠、无水碳酸钠、硫酸亚铁、30%过氧化氢、磷酸氢二钠(均为分析纯):国药集团上海化学试剂有限公司;超氧化歧化酶、福林酚,莫匹罗星锂盐和半胱氨酸盐酸盐改良乳酸菌(MRS)培养基(均为生化试剂):国药集团上海化学试剂有限公司。
1.1.2 仪器与设备
UV Power 紫外可见分光光度计:北京莱伯泰科仪器有限公司;PYX-DHS-500BS 恒温培养箱:上海跃进医疗器械厂;pHS-25 pH 计:上海仪电科学仪器股份有限公司;SW-CJ-1F 超净工作台:苏州净化设备有限公司。
1.2 方法
1.2.1 工艺流程
大麦苗粉→调配、均质→酵母菌活化→接种→29 ℃发酵28 h→灭菌→冷却→双歧杆菌活化→接种→恒温发酵→37 ℃发酵24 h→4 ℃冷藏→成品
1.2.2 操作要点
1.2.2.1 调配、均质
大麦苗粉10 g,加500 mL 纯净水混合,搅拌充分溶解并均质。
1.2.2.2 酵母菌活化
添加活性干酵母(Saccharomyces cerevisiae AM262831),将其加入试管中,按 1∶10(g/mL)加入去离子水(36 ℃),充分溶解,36 ℃恒温水浴活化15 min。
1.2.2.3 接种
将活化液接种到麦苗汁(接种量0.85%),然后于29 ℃发酵28 h,定期通风以保证充分溶氧。
1.2.2.4 双歧杆菌活化
取双歧杆菌(Bifidobacterium longum NCC2705)接种于10 mL 灭菌MRS 培养基中,接种量1%,活化3 次,每次 12 h。
1.2.2.5 接种
取1 mL 活化后的双歧杆菌菌液,离心,去上清,加入1 mL 灭菌生理盐水重悬,按1.5%的比例添加,混匀溶解后分装前述酵母菌发酵液中,于37 ℃发酵24 h,置于 4 ℃后熟 12 h 即得样品。
1.2.3 大麦苗酵母菌发酵工艺单因素试验设计
双歧杆菌对于营养成分利用的速率快于酵母菌,因此在麦苗的发酵过程中,先进行酵母菌发酵,再进行双歧杆菌发酵[10]。
1.2.3.1 酵母菌发酵D-阿洛酮糖添加量的考察
固定发酵温度29 ℃、pH 4.0、酵母接种量0.85%、发酵时间24 h,D-阿洛酮添加量分别为2%、4%、6%、8%、10%进行发酵。结束发酵后,进行SOD 活力测定,筛选D-阿洛酮糖最适添加量。
1.2.3.2 酵母菌发酵接种量的考察
固定发酵温度29 ℃、pH 4.0、D-阿洛酮糖添加量6.0%、发酵时间24 h,分别接种0.25%、0.45%、0.65%、0.85%、1.05%酵母进行发酵。结束发酵后,进行SOD活力测定,筛选酵母菌最适接种量。
1.2.3.3 酵母菌发酵温度的考察
固定pH 4.0、酵母接种量0.85%、D-阿洛酮糖添加量 6.0%、发酵时间 24 h,分别在 25、27、29、31、33 ℃条件下进行发酵。结束发酵后,进行SOD 活力测定,筛选最适发酵温度。
1.2.3.4 酵母菌发酵时间的考察
固定发酵温度29 ℃、pH 4.0、D-阿洛酮糖添加量6.0%、酵母接种量0.85%,分别发酵 6、12、18、24、30、36h。结束发酵后,进行SOD 活力测定,筛选最适发酵时间。
1.2.4 大麦苗酵母菌发酵正交试验设计
根据单因素试验的结果,以D-阿洛酮糖添加量、接种量、发酵温度、发酵时间四个因素设计L9(34)正交试验(表1),仍选择之前的指标,研究麦苗酵母菌发酵的最佳工艺条件。

表1 大麦苗酵母菌发酵正交试验设计Table 1 Orthogonal design of barley seedling yeast fermentation
1.2.5 大麦苗酵素双歧杆菌发酵工艺优化
在酵母菌发酵时间达到最佳,即SOD 活力达到最高时,向发酵液中接种双歧杆菌,进行双歧杆菌发酵。
1.2.5.1 双歧杆菌发酵pH 的研究
当麦苗酵素酵母菌发酵SOD 活力达到最高值时,酵素液pH 降至3.0,而双歧杆菌最适pH 在6.5附近,因此有必要对酵素液pH 做出调整,确定麦苗酵素双歧杆菌发酵的最适pH。调节发酵液pH,分别在初始 pH 6.1、6.3、6.5、6.7、6.9、7.1 条件下,接种2.0%双歧杆菌,发酵24 h 后,取酵素液测定指标,以确定麦苗酵素双歧杆菌发酵阶段的适宜初始pH。
1.2.5.2 双歧杆菌发酵温度的研究
将1.5%双歧杆菌接种至发酵液,在发酵温度分别为 33、35、37、39、41 ℃下,恒温发酵 24 h,研究双歧杆菌浓度和可滴定酸含量的变化。
1.2.5.3 双歧杆菌发酵时间的研究
发酵温度为38 ℃,将1.5%双歧杆菌接种至发酵液,分别恒温发酵 6、12、18、24、30、36、42、48 h,研究双歧杆菌浓度和可滴定酸含量的变化。
1.2.5.4 双歧杆菌发酵接种量的研究
发酵温度为38 ℃,分别接种0.5%、1.0%、1.5%、2.0%、2.5%的双歧杆菌,恒温发酵24 h,研究双歧杆菌浓度和可滴定酸含量的变化。
1.2.6 测定指标与方法
1.2.6.1 发酵过程中理化指标的测定
(1)SOD 活力
参照GB/T 5009.171—2003 中[11]的第二法和文献[12]进行测定。
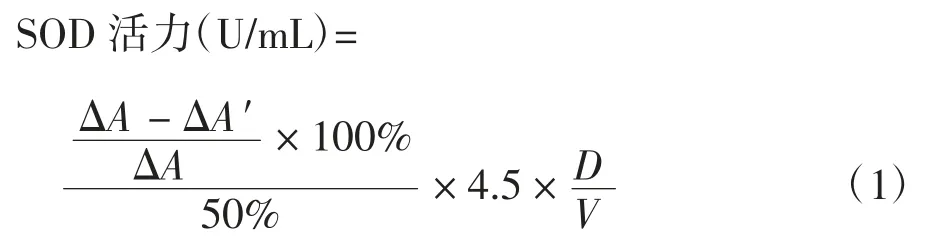
式中:ΔA 为邻苯三酚自氧化速率;ΔA′为 SOD 酶液抑制邻苯三酚自氧化速率;4.5 为反应液总体积,mL;V 为所加样液体积,mL;D 为样液的稀释倍数。
(2)可滴定酸含量
参考文献[13]和GB/T 12456—2008[14]中的方法测定。
(3)双歧杆菌浓度
采用莫匹罗星锂盐和半胱氨酸盐酸盐改良MRS培养基对酵素液进行平板接种计数,计算得出双歧杆菌浓度,测定方法参考GB/T 4789.34—2016[15]。
1.2.6.2 抗氧化性指标的测定
(1)总酚含量
配制0.2 mg/mL 3,4,5-三羟基苯甲酸标液,分别量取标液 0、0.1、0.2、0.3、0.4、0.5 mL 于比色管中,加入 1 mL 福林酚试剂、5 mL H2O 和 2 mL 10%Na2CO3,去离子水定容到刻度,760 nm 下测吸光度A760,绘制标准曲线。以0.5 mL 酵素液代替标液重复上述步骤,根据标准曲线计算总酚含量[16]。
(2)羟基自由基清除率
参考文献[17-18]中的方法,略有改动。取稀释10 倍的样品1mL 于试管中,依次加入1 mL 邻菲咯啉、1.5 mL 0.2 mol/L 磷酸盐缓冲溶液(pH 7.4)、1 mL 0.75 mmol/L FeSO4和 1 mL 0.01%H2O2溶液,混匀后于 37 ℃水浴避光反应30 min,536 nm 波长处测吸光度。以H2O2和不加样品为空白。按下式计算羟自由基清除率:
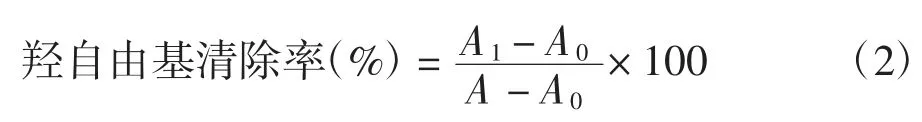
式中:A0为不加样品组的吸光度值;A1为样品组的吸光度值;A 为以水代替样品和H2O2组的吸光度值。
1.2.7 数据处理
数据均为3 次重复试验的平均值,应用SPSS 9.0进行显著性和相关性分析。
2 结果与分析
2.1 酵母菌发酵工艺优化结果
2.1.1 酵母菌发酵D-阿洛酮糖添加量的考察
D-阿洛酮糖作为一种新型的低热量功能甜味剂,其甜度是蔗糖的70%,但热量仅为蔗糖的0.3%,且与其他D-酮糖相比,其具有良好的乳化稳定性和抗氧化性能,可改善产品的风味、色泽及口感[19-21],在食品研发中具有重要意义。由图1 可知,D-阿洛酮糖可为酵母菌的发酵提供碳源,随着D-阿洛酮糖添加量的逐渐增加,SOD 活力也随之增大,添加量达到6%时,SOD 活力达到45.62 U/mL,D-阿洛酮糖添加量继续增加,渗透压增大,导致SOD 活力降低,且考虑到成本,故选取D-阿洛酮糖添加量在6%左右进行正交试验。

图1 D-阿洛酮糖添加量对SOD 活力的影响Fig.1 Effects of D-allulose additions on SOD activities
2.1.2 酵母菌接种量的考察
由图2 可知,随着酵母菌接种量的增大,代谢速度加快,导致发酵液中SOD 活力随之增大,当添加量达到0.85%时,SOD 活力达到最高峰,其值为56.46 U/mL,添加量高于0.85%后,SOD 活力逐渐下降,可能是由于随着发酵液内菌体数量的增加,菌体间互相争夺碳源等营养物质,导致酵母菌代谢能力下降;同时酵母菌添加量过多,酵母菌自溶,从而使SOD 活力下降,故选取酵母菌添加量在0.85%左右进行正交试验。

图2 酵母菌接种量对SOD 活力的影响Fig.2 Effects of yeast inoculation amounts on SOD activities
2.1.3 酵母菌发酵温度的考察
20~30 ℃是酵母菌生长的最适温度[22]。由图3 可知,随着发酵温度的升高,酵母菌代谢速度加快,SOD活力随之增加,29 ℃时,SOD 活力值达到最大,为45.76 U/mL,温度继续升高时,酵母菌的活性受到抑制,SOD 活力逐渐减小,故选取发酵温度29 ℃左右进行正交试验。
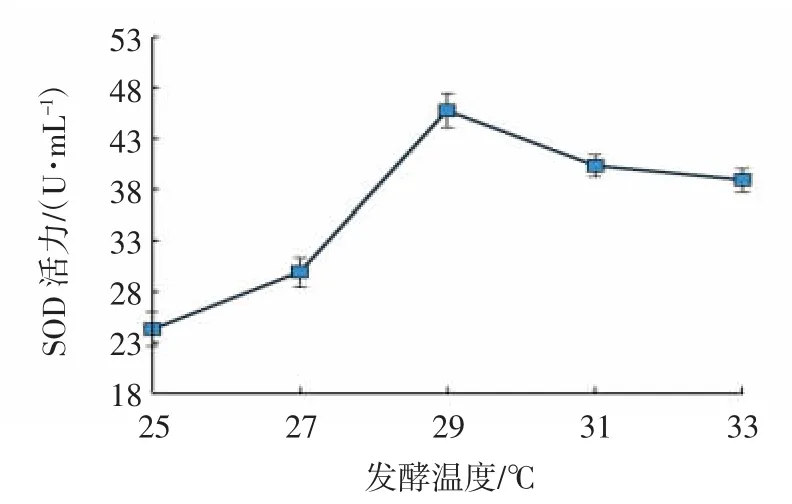
图3 发酵温度对SOD 活力的影响Fig.3 Effects of fermentation temperatures on SOD activities
2.1.4 酵母菌发酵时间的考察
由图4 可知,发酵液中SOD 活力随发酵时间的延长呈递增趋势,至24 h 时,酵母菌充分利用碳源,产生大量SOD,SOD 活力增加至最大值43.51 U/mL。由于SOD 是含金属的酶,金属离子是辅基,因此随着发酵时间的继续延长,酵母菌代谢产生的Fe3+和Mn2+数量增多,它们对酵母菌生长和SOD 活力有较明显的抑制作用,SOD 活力开始逐渐下降,故选取发酵时间24 h 左右进行正交试验,李凡等[23]的研究也得出了相似的结果。
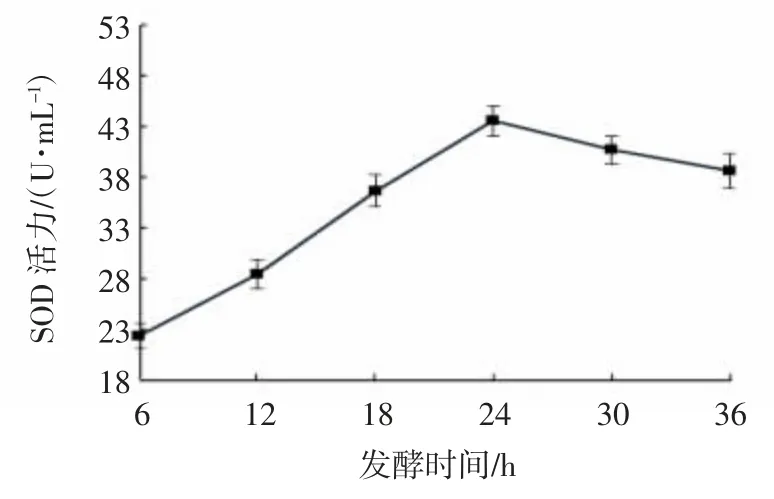
图4 酵母菌发酵时间对SOD 活力的影响Fig.4 Effects of yeast fermentation times on SOD activities
2.1.5 大麦苗酵母菌发酵正交试验结果
由表2 可知,影响大麦苗酵母菌发酵各因素的主次顺序为:B>D>C>A,即酵母菌接种量对SOD 活力的影响最大,其次是发酵时间和发酵温度,D-阿洛酮糖添加量的影响最小;所得出的大麦苗酵母菌发酵最优方案为A2B2C3D3,即D-阿洛酮糖添加量6%,酵母菌接种量0.85%,发酵温度30 ℃,发酵时间28 h,以此组合再次进行验证发酵,制成的麦苗酵素SOD活力最高,达76.9 U/mL。
2.2 麦苗酵素双歧杆菌发酵工艺优化结果
2.2.1 双歧杆菌发酵初始pH 的研究
发酵液的酸碱度是双歧杆菌发酵的重要条件之一。由图 5 可知,双歧杆菌发酵最适 pH 在 6.5~6.9,在此pH 范围内,双歧杆菌浓度及可滴定酸含量均最佳且稳定,pH 高于或低于此范围,指标值均出现下降,权衡到酵母菌的生长,初始pH 为6.5 较为适宜。
2.2.2 双歧杆菌发酵温度的研究
由图6 可知,随着发酵温度的升高,双歧杆菌代谢速度加快,双歧杆菌浓度和可滴定酸含量大幅度增大,当发酵温度在37~39 ℃时,双歧杆菌浓度和可滴定酸含量均达到最佳;当发酵温度>39 ℃时,指标值均快速减小。考虑到能耗,选择发酵温度37 ℃较适宜。

表2 酵母菌发酵产SOD 活力的正交试验结果Table 2 Orthogonal test result of SOD activities produced after yeast fermentation

图5 初始pH 对双歧杆菌浓度及可滴定酸含量的影响Fig.5 Effects of initial pH on bifidobacteria concentrations and titratable acidity contents
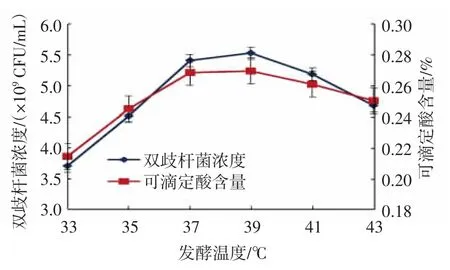
图6 发酵温度对双歧杆菌浓度及可滴定酸含量的影响Fig.6 Effects of fermentation temperatures on bifidobacteria concentrations and titratable acidity contents
2.2.3 双歧杆菌发酵时间的研究
由图7 可知,随着发酵时间的延长,双歧杆菌不断利用酵母菌发酵后样液中的营养物质,同时产生大量的酸,使得酸度值处于上升趋势,但当发酵时间>24 h,双歧杆菌数量和可滴定酸含量增加趋缓,考虑到实际生产的效率,将发酵时间定为24 h。

图7 发酵时间对双歧杆菌浓度及可滴定酸含量的影响Fig.7 Effects of fermentation times on bifidobacteria concentrations and titratable acidity contents
2.2.4 双歧杆菌接种量的研究
由图8 可知,随着双歧杆菌接种量的增大,双歧杆菌浓度和可滴定酸含量增加迅速,当接种量增加至1.5%时,双歧杆菌浓度和可滴定酸含量增加趋缓,维持在5.89×109CFU/mL 和0.28%左右的水平;考虑到成本,双歧杆菌接种量为1.5%较为适宜。
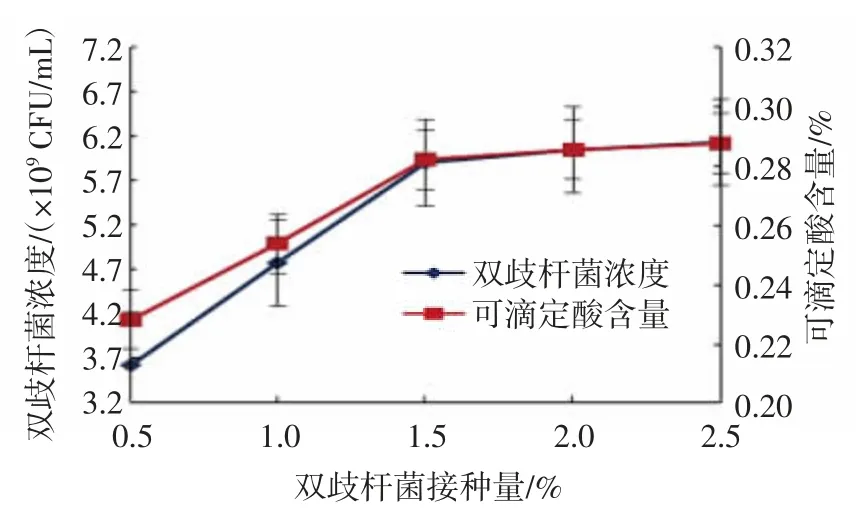
图8 双歧杆菌接种量对双歧杆菌浓度及可滴定酸含量的影响Fig.8 Effects of bifidobacteria inoculation amounts on bifidobacteria concentrations and titratable acidity contents
2.3 抗氧化性分析结果
对制得的酵素总酚含量和羟基自由基清除率进行了测定,同时以未发酵的大麦苗液作为对照,结果见表3。
由表3 可知,大麦苗酵素的总酚含量比对照组提高了81.63%,大麦苗酵素的羟基自由基清除率比未发酵对照组提高了109.03%,表明发酵可使大麦苗总酚含量和羟基自由基清除率显著提高,这与郭艳萍等[24]的研究结果一致。

表3 麦苗酵素总酚和羟基自由基清除率对比Table 3 Comparison of total phenols contents and hydroxyl radical scavenging rates of wheat seedling enzymes
3 结论
通过单因素和正交试验,确定大麦苗粉酵母菌发酵的最佳工艺条件为:D-阿洛酮糖添加量6%,酵母菌接种量0.85%,发酵温度30 ℃,发酵时间28 h,制成的麦苗酵素SOD 活力最高,达76.9 U/mL;然后将发酵液pH 调至6.5,接种1.5%双歧杆菌,发酵温度37 ℃,发酵24 h,此条件下样品的双歧杆菌浓度和可滴定酸含量指标最佳;同时对样品的抗氧化活性进行初步研究,结果表明酵母菌和双歧杆菌组合发酵大麦苗粉酵素的总酚含量、羟基自由基清除率比对照组分别提高了81.63%和109.03%,显示了较好的抗氧化活性。
