运动改善糖尿病大鼠心肌功能:自噬的可能调节作用
2021-04-26王世强胥祉涵王少堃王一杰王国军
王世强 胥祉涵 王少堃 王一杰 王国军
1 湖南工业大学体育学院(湖南株洲412000)
2 体质健康和运动健身湖南省重点实验室(湖南株洲412000)
国际糖尿病联盟(IDF)最新发布的全球糖尿病地图(第9版)显示,全球糖尿病患病人数不断上升,每11个人中就有1 个糖尿病患者。预计到2030年,糖尿病患者会达到5.8 亿[1]。糖尿病是一种代谢障碍性疾病,常引起脑、眼、足、肾和心等多个部位的并发症。糖尿病心肌病(diabetic cardiomyopathy,DCM)是指发生于糖尿病患者,不能用高血压性心脏病、冠状动脉粥样硬化性心脏病及其他心脏病变来解释的心肌疾病,可引发心肌广泛灶性坏死,出现亚临床的心功能异常,最终进展为心力衰竭、心律失常及心源性休克,重症患者甚至猝死[2]。研究表明,在DCM进展过程中,自噬标记蛋白Beclin1和LC3(light chain 3)表达下降,Atg7(recom⁃binant autophagy related protein 7)和Atg12-Atg15 蛋白表达减少,P62( protein 62)表达增加,细胞自噬体的形成和降解均受到抑制,心肌自噬流减弱,受损的细胞器累积在心肌组织无法得到清除,最终导致心功能障碍[3]。经过二甲双胍和雷帕霉素等方式进行处理后,心肌细胞自噬能力增强,心肌受损的程度降低,心脏功能得以改善[4,5]。这些结果提示,由高糖导致的心肌自噬抑制可能是DCM发生发展的重要机制,通过一定的手段提高糖尿病患者心肌的自噬能力,对预防和改善DCM的发生发展具有重要作用。
研究发现,有氧运动能够增强心肌抗氧化能力,减轻心肌纤维化,抑制糖尿病诱导的病理性心肌重塑,改善心脏舒缩功能[6,7]。然而,其具体的调节机制尚不清楚。研究证实,在正常状态下,中等强度的有氧运动能上调Beclin1 和LC3 的表达,增加LC3-Ⅱ/LC3-Ⅰ的比值,有利于心肌能力代谢和收缩功能的提高[8,9]。在病理状态下,有氧运动能够通过增强自发性高血压[10]、心力衰竭[11]和心肌梗死[4]等动物模型心肌基础自噬水平,重建心肌自噬通量,改善心肌功能,抑制病理性心脏重塑。然而,运动是否能够通过改变心肌细胞自噬水平进而发挥运动对糖尿病心肌的保护效应,进而改善心功能,尚未见相关研究报道。因此,本研究通过高脂饮食和腹腔注射小剂量链脲佐菌素(STZ)建立2 型糖尿病大鼠模型,观察运动对糖尿病大鼠心肌自噬标记蛋白Beclin1、LC3和P62 mRNA和蛋白的影响,为运动保护心脏改善DCM 心功能提供一定的理论依据和实验支持。
1 材料与方法
1.1 实验动物
健康雄性SD 大鼠(40 只),体重296 ± 8 g,8 周龄,购自北京维通利华实验动物技术有限公司,许可证编号为SCXK(京)2012-001,室温22℃± 2℃,光照时间12个小时,空气湿度40%~50%。所有大鼠适应性喂养1 周后随机分为正常对照组(NC 组,n=8 只)和糖尿病建模组(n=32只),其中正常对照组喂养普通饲料,糖尿病建模组喂养高脂饲料(基础饲料添加28%蔗糖、20%炼猪油、l%胆固醇和0.25%胆酸盐等混合形成,总热能20 kJ/g)。
1.2 糖尿病大鼠模型的建立及验证
参照Reed 等[12]的方法建立2 型糖尿病大鼠模型。糖尿病建模组大鼠持续高脂饲料喂养4 周后,大鼠建模前禁食12 小时,将链脲佐菌素(STZ)与0.1 mol/L pH4.2的柠檬酸缓冲液互溶,浓度为2%,按30 mg/kg体重一次性腹腔注射,正常对照组(NC组)腹腔一次性注射等体积的0.1 mol/L 柠檬酸缓冲液。72 小时后随机时间尾静脉采血,根据检测的随机血糖判定建模是否成功,随机血糖大于11.1 mmol/L 为建模成功判定标准,剔除血糖不达标的大鼠,1周后复查暂时成模大鼠,共有28只大鼠建模成功。
从建模成功的28 只大鼠中随机挑选其中的8 只,以及对照组的8只大鼠,经过禁食12小时,检测其空腹静脉血,静置30分钟,待血液凝固后分离取血清,用全自动生化仪(日立7020,日本)测定空腹血糖(fasting blood glucose,FBG),采用葡糖糖氧化酶法,试剂盒购于上海酶联生物科技有限公司。ELISA 检测空腹血浆胰岛素(fasting plasma insulin,FINS),酶标仪为美国LabsystemsDragan 公司WellScan MK3,试剂盒购于南京建成生物公司。根据公式计算胰岛素敏感指数(in⁃sulin sensitivity index,ISI)和胰岛素抵抗指数(insulin resistance,HOMA-IR),公式为ISI=-log(FPG×FINS)、HOMA-IR=(FPG×FINS)/22.5[13]。如果ISI 显著低于对照组,而HOMA-IR 高于对照组,说明大鼠出现了胰岛素敏感性下降的现象,所建的动物模型符合2 型糖尿病的特征,则能进一步验证所建模型是否成功。将建模成功的大鼠随机分为糖尿病对照组(T2DM)和糖尿病运动组(T2DME),各14只。
1.3 运动方案
适应性训练1 周(10 m/min,15 min/day)后,糖尿病运动组给予8 周中等强度有氧跑台运动,采用Bed⁃ford训练方案,速度为15.2 m/min,坡度为3°(运动强度相当于58.4% ± 1.7%VO2max负荷)[14]。每次运动60 min,每周5天(周一和周四不进行跑台运动)。
1.4 超声心动图(ultrasonic cardiogram graph,UCG)测定
末次运动后12小时,按照NC组、T2DM 组 和T2DME 组每组1 只的先后顺序,进行麻醉和超声心动测试。腹腔注射10%水合氯醛(40 mg/100 g 体重)麻醉后仰卧位固定,胸部去毛,小动物超声探头置于大鼠左前胸,连接超声检查仪(加拿大ULTRASONIX 公司,SXTCH2.0)进行超声检查测量左室舒张末期内径(left ventricular internal dimension diastole,LVIDd)、左室收缩末期内径(left ventricular internal diameter at endsystole,LVIDs)、左室后壁舒张末期厚度(left ventricu⁃lar posterior wall at end-diastole,LVPWd)、左室后壁收缩末期厚度(left ventricular posterior wall at endsystole,LVPWs)等心脏结构指标和短轴缩短率(frac⁃tional shortening,FS)、射血分数(ejection fraction,EF)心脏功能指标。
1.5 取材
实验过程中,糖尿病对照组和糖尿病运动组共有11只大鼠相继死亡,至8周跑台运动结束时,糖尿病组大鼠余8只,糖尿病运动组大鼠余9只。末次运动结束12小时后麻醉后测量大鼠体重,腹腔静脉取血(用于血糖检测),随后摘取心脏,吸干血液后进行称重,并计算心脏重量指数(心脏重量*1000/体重)。然后分离左心室,立即置于液氮中速冻,存入-80℃冰箱保存,以备PCR和WB检测。
1.6 RT-PCR
采用Trizol 法(购于美国Technologies)提取总RNA,每个样本按照2 μg RNA 作为初始模板,配置20 μl 的总反应体系,应用cDNA 合成试剂盒(RR370A,购于TaKaRa 公司)在核酸扩增仪(Gene Amp PCR System 9700,美国ABI 公司)进行反转录成cDNA,反应条件为:37℃,15 min;85℃5 s;4℃保持。以合成的cDNA 作为模板,以β-actin 作为内参,配置20 μl 反应体系,每个样本检测3 个复孔,在实时荧光定量PCR 系统(7300,美国ABI)进行扩增荧光定量,反应条件为:预变性95℃,30 s;PCR反应95℃,5 s;60℃,31 s;40 个循环。荧光定量试剂盒为TaKaRa 公司的RR820A。根据收集的数据通过2-△△CT公式计算样本中mRNA的相对含量,其中△△CT =(CT实验组目的基因-CT 实验组内参基因)-(CT 对照组目的基因-CT 对照组内参基因)。 实验所需引物由上海生工生物合成。
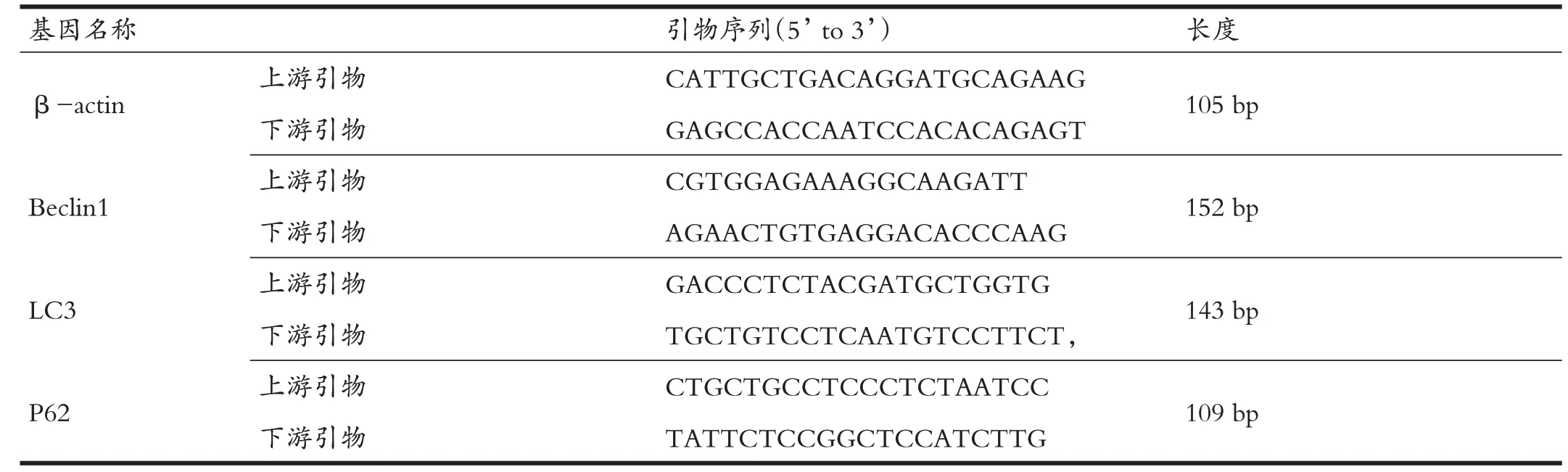
表1 Real-time PCR基因引物序列
1.6 Western Blotting
提取总蛋白后用BCA 法测定并调整蛋白浓度一致,加入上样缓冲液在干式恒温仪内使蛋白变性。120 V 恒压SDS-PAGE 电泳1小时后,70 mv 恒压转膜70 分钟。5%脱脂奶粉封闭1 小时,孵育兔源一抗(Be⁃clin1、P62、LC3稀释比例均为1︰1000;GAPDH 稀释比例为1︰10000)置于摇床4℃过夜。洗膜缓冲液洗涤3次后,加HRP 标记的羊抗兔二抗(稀释比例为1︰5000),室温摇床孵育1 h。洗膜缓冲液洗膜3次,滴加ECL 化学发光试剂,室温2 min,滤纸吸干后置于保鲜膜内封存,在蛋白成像仪(CD touch,美国伯乐)中成像,条带用Imag Lab软件进行图像分析。内参为GAP⁃DH,计算目的蛋白与内参蛋白条带的积分光密度(IOD)。
1.7 统计分析
所有结果采用平均数±标准差表示,数据用GraghPad Prism 6.0 软件转换作图。数据均采用SPSS19.0 软件进行分析处理,采用单因素方差分析组间差异,P<0.05表示差异具有统计学意义。
2 结果
2.1 糖尿病大鼠模型的建立及验证
结果显示,T2DM 组大鼠FBG 和FINS 均显著高于NC 组,ISI 显著低于NC 组,HOMA-IR 高于NC 组。结果表明,T2DM 组大鼠出现了胰岛素敏感性下降的现象,所建的动物模型符合2型糖尿病的特征。

表2 大鼠FBG、FINS、ISI和HOMA-IR的变化
2.2 大鼠体重、心脏重量和血糖的变化
如表3 所示,与NC 组相比,T2DM 组和T2DME 组大鼠体重均降低,具有显著性差异(P<0.05),T2DME组与T2DM 组相比,体重增加,无明显差异。与NC 组相比,T2DM 组和T2DME 组大鼠心脏重量指数显著增加(P<0.05),与T2DM组相比,T2DME组心脏重量指数显著降低(P<0.05)。与NC组相比,T2DM组和T2DME组血糖含量均显著性增加(P<0.05)。与T2DM 组相比,T2DME组大鼠血糖显著性降低(P<0.05)。
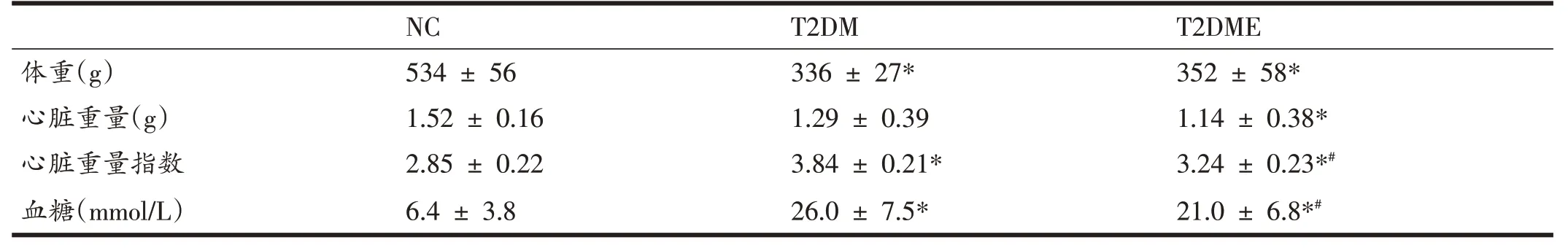
表3 大鼠体重、心脏重量及血糖的变化
2.3 大鼠心脏结构和功能的变化
如表4所示,与NC组相比,T2DM组大鼠LVIDd和LVIDs 均显著性增加(P<0.01),LVPWd 和LVPWs 无明显变化。与T2DM 组相比,T2DME 组LVIDs 显著性降低(P<0.05)。与NC 组相比,T2DM 组大鼠FS 和EF 均显著性下降(P<0.05 和P<0.01)。与T2DM 组相比,T2DME组FS和EF显著性升高(P<0.05)。
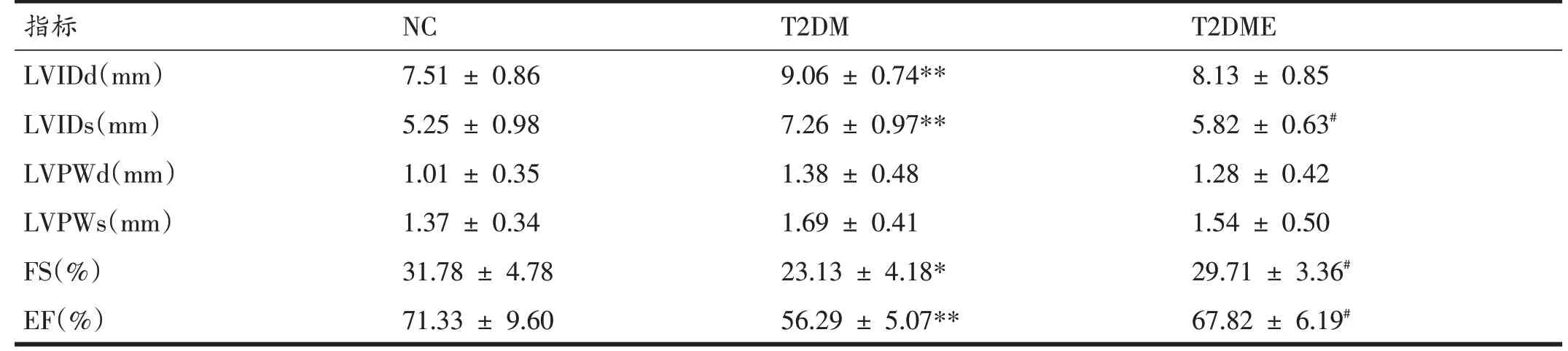
表4 大鼠左心室结构和功能变化
2.4 大鼠心肌自噬相关因子mRNA表达变化
结果显示,与NC 组相比,T2DM 组Beclin1 mRNA的表达显著降低(P<0.05),P62 mRNA 的表达显著增加(P<0.05),LC3 mRNA 的表达无明显变化;与T2DM组相比,T2DME 组Beclin1 mRNA 和LC3 mRNA 的表达显著增加(P<0.01),P62 mRNA的表达显著减少(P<0.01)。见图1。
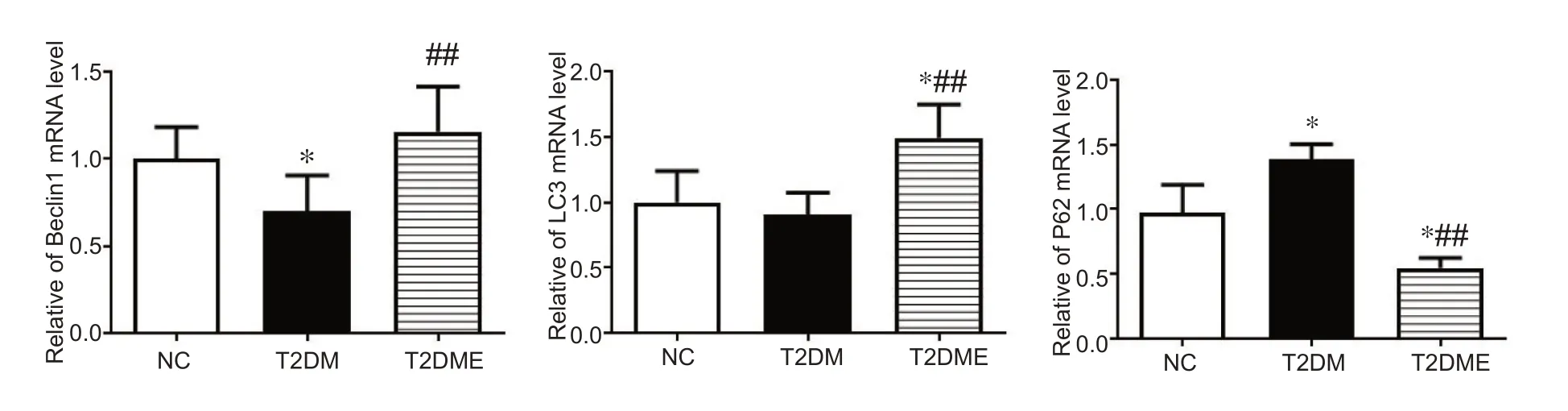
图1 心肌自噬相关因子mRNA的表达
2.5 糖尿病大鼠心肌自噬相关蛋白表达变化
与NC 组相比,T2DM 组Beclin1 和P62 蛋白无明显变化;与T2DM 组相比,T2DME 组Beclin1 蛋白显著增加(P<0.05),P62 蛋白显著降低(P<0.05)。与NC 组相比,T2DM组LC3-Ⅰ蛋白无明显变化,LC3-Ⅱ蛋白显著降低(P<0.05),T2DME 组LC3-Ⅰ和LC3-Ⅱ蛋白均显著增加(P<0.05,P<0.01);与T2DM 组相比,T2DME 组LC3-Ⅰ和LC3-Ⅱ蛋白均显著增加(P<0.01)。与NC组相比,T2DM 组LC3-Ⅱ/ LC3-Ⅰ显著降低(P<0.05),T2DME 组LC3-Ⅱ/ LC3-Ⅰ显著升高(P<0.05);与T2DM 组相比,T2DME 组LC3-Ⅱ/ LC3-Ⅰ显著升高(P<0.01)。见图2。
3 讨论
3.1 糖尿病导致大鼠心肌功能降低和自噬水平降低
糖尿病会带来一系列并发症,约一半以上的糖尿病患者死于糖尿病心血管病并发症,其中,DCM的危险因素占首位,严重者可发生心衰而死亡。目前,DCM的发生机制尚未被完全阐明。随着对自噬研究的逐渐深入,自噬被认为可能在DCM 发生发展中具有重要作用。Xie 等研究发现,STZ 诱导的1 型糖尿病小鼠心肌自噬程度降低,LC3-Ⅱ的表达显著降低,左心室功能下降[15]。Feidantsis等的研究显示,糖尿病大鼠LC3-Ⅱ/LC3-Ⅰ的表达显著降低,细胞凋亡增加,心肌收缩功能降低。AMPK 的激活有助于增强糖尿病大鼠心肌自噬,进而增强心脏功能[16]。与此一致,Xiao 等研究也显示,糖尿病小鼠心肌Beclin1表达显著减少,P62的表达显著增加,LC3-Ⅱ/LC3-Ⅰ的比值显著降低,心肌自噬被抑制,心脏功能降低,并伴随心肌炎症反应,细胞凋亡增加和氧化应激加剧,发生病理性心肌重塑[17]。本研究发现,高脂饮食和STZ诱导的糖尿病大鼠心肌Be⁃clin1表达降低,LC3-Ⅱ和LC3-Ⅱ/LC3-Ⅰ的比值也显著减少,而P62的表达则显著增加,同时伴随大鼠左心室短轴缩短率和射血分数的显著下降。研究提示,细胞自噬能力的降低可能是糖尿病大鼠左心室心肌功能减退的原因。这可能是由于高血糖抑制心肌细胞自噬,心肌细胞自噬能力的下降导致有细胞毒性的蛋白质集聚体和功能失调的细胞器的积累,进而造成细胞凋亡的增加和心肌细胞丢失,最终使心肌收缩功能受损[18]。
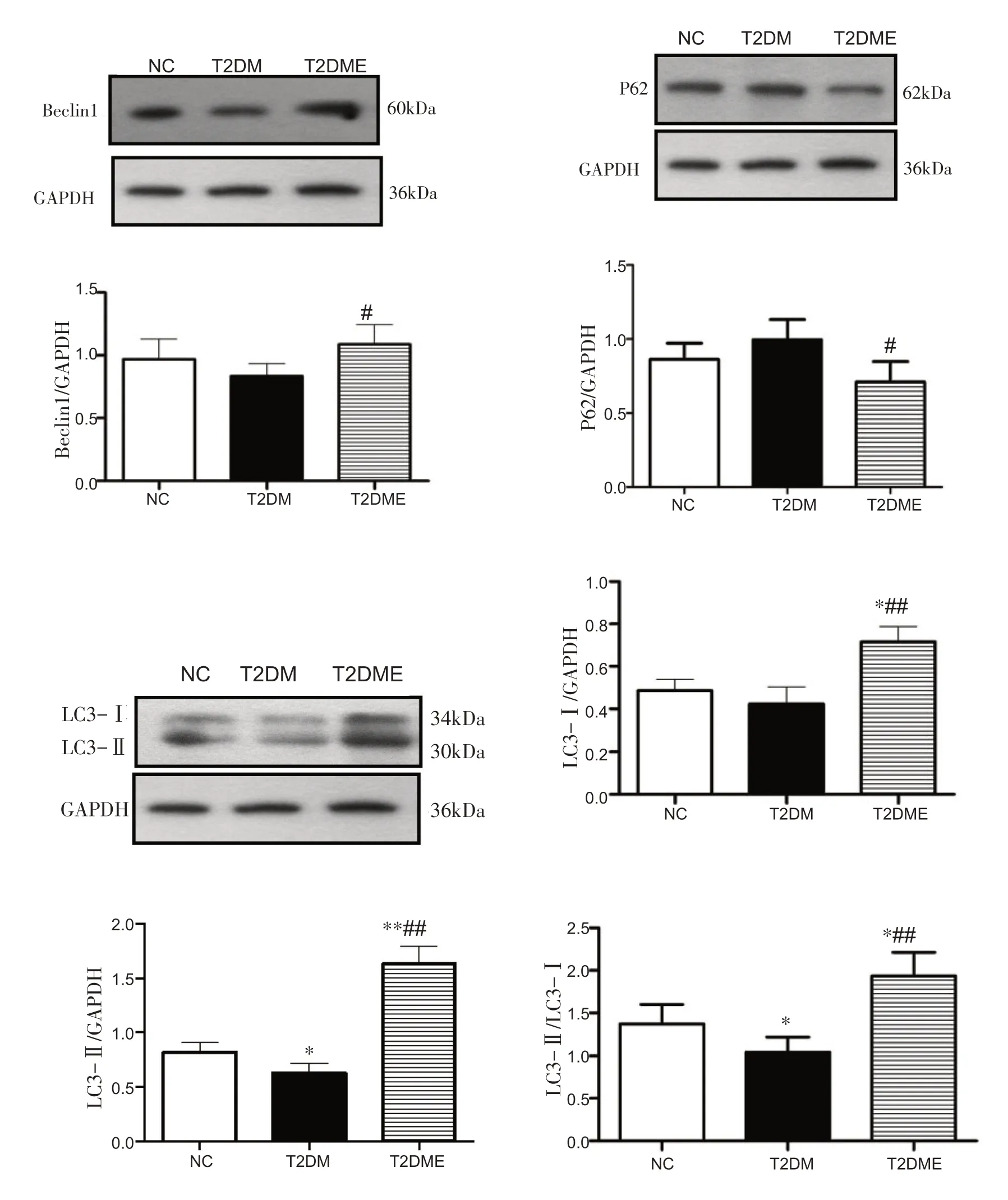
图2 心肌自噬相关因子蛋白的表达
然而,也有研究认为糖尿病心肌自噬增强。如Mu⁃nasinghe 等通过冠状动脉搭桥手术收集了2 型糖尿病患者的左心耳,电镜观察显示,心肌自噬体数量增加。蛋白分析结果显示,Beclin-1表达增加,P62表达减少,提示糖尿病患者心肌自噬活性增加[19]。然而,自噬是一个动态过程,仅仅通过Beclin-1、LC3 等的表达或自噬体的数量并不代表整个自噬过程。Xu 等观察了糖尿病小鼠的心肌自噬流,发现虽然心肌中自噬体数量增加,但自噬溶酶体缺乏,表明糖尿病小鼠心肌自噬降解受阻,自噬流受损。因此,关于2型糖尿病与心肌自噬的关系,尚未十分明确。未来需要加强基于自噬流的糖尿病心肌与自噬关系的相关研究[20]。
3.2 有氧运动增强大鼠心肌自噬能力和心脏功能
运动作为一种健康干预手段,对糖尿病心肌病的治疗具有重要作用。运动可通过减少细胞死亡,促进细胞增殖,降低心肌炎症反应,进而改善糖尿病心肌病。前期,我们研究发现,运动通过TGF-β1(transform⁃ing growth factor-β)/Smad 信号通路,降低了MMP-2
(matrix metalloproteinase 2)、CTGF(connective tissue growth factor)等纤维化标志物的表达,改善了糖尿病心肌纤维化,同时抑制了糖尿病氧化应激,这佐证了运动可以作为治疗糖尿病心肌病的有效方式[6]。鉴于运动的显著疗效,在《中国慢性疾病防治基层医生诊疗手册》中,列出了详细的运动治疗方案[21]。然而,运动改善糖尿病心肌病的机制尚未完全阐释,自噬为此提供了新的视角。
研究发现,缺血再灌注动物模型心肌自噬能力降低,运动可减轻缺血再灌注造成的心肌损伤,自噬可能是运动产生心肌保护效应的重要潜在机制[22]。Li 等研究也发现,在运动预适应的早期和晚期阶段,心肌细胞自噬均可被激活,其可能部分参与调节了运动诱导的心肌保护效应,是对抗力竭运动导致的心肌损伤的重要保护机制[4,23]。Yan通过敲除小鼠心肌自噬相关基因Atg7 限制心肌自噬能力后发现,运动不仅未能改善高脂膳食导致的心肌病变,反而加重了由此引发的心肌纤维化,线粒体生物发生受损。该研究表明细胞自噬是运动产生心肌保护效应的重要调节机制[24]。与以上研究一致,本研究发现,运动显著促进了糖尿病大鼠心肌Beclin1 的表达,抑制了P62 蛋白表达,LC3-Ⅰ和LC3-Ⅱ蛋白显著增加,LC3-Ⅱ/LC-Ⅰ比值显著升高,提示运动增强了糖尿病大鼠心肌自噬能力,其可能是运动改善糖尿病大鼠心脏功能的重要分子机制。本研究从自噬的角度探讨了运动改善2型糖尿病的分子机制,未来将进一步深入研究运动激活糖尿病心肌自噬的关键信号通路。
4 结论
糖尿病大鼠心肌功能下降,可能与心肌自噬水平降低有关。有氧运动可能通过增强心肌自噬能力,进而改善糖尿病大鼠心肌功能。
