血栓弹力图与凝血参数对老年脓毒症患者病情严重程度和预后的评估价值研究
2021-04-26张伟何正琼吴希张钊
张伟,何正琼,吴希,张钊
1.成都医学院第二附属医院·核工业四一六医院重症医学科,四川成都610000;2.四川省人民医院东院重症医学科,四川成都610000
脓毒症是感染引起的全身炎症反应综合征。表现为寒战、发热、心悸及气短等症状。严重时可导致器官功能和循环功能障碍,病死率高[1]。据报道显示,ICU 脓毒症病死率>40%[2]。因此,寻找有效指标用于反映程度和预后具有重要意义。同时30~50%的患者会出现凝血功能障碍。当脓毒症发生时炎症反应被激活,炎症和凝血相互作用放大宿主反应导致凝血功能障碍[3]。但常规的凝血功能检测存在一定的缺陷,需评估凝血功能障碍。血栓弹力图(thromboelastography,TEG)是一种基于细胞学的凝血检测模型,能实时测量血栓形成速度、强度和溶出过程,反映整个凝血过程[4]。因此本研究采用TEG 和凝血参数反应凝血功能,并分析TEG 参数和凝血参数的相关性,以期为临床诊断和治疗提供参考,现报道如下。
1 资料与方法
1.1 一般资料 回顾性分析2020年1月-2020年9月成都医学院第二附属医院?核工业四一六医院重症医学科收治的85 例脓毒症老年患者的病例资料。纳入标准:(1)均符合JAMA 2016 Sepsis 3.0 中相关诊断标准[5];(2)年龄≥60 岁。符合以上全部标准的病例纳入本研究。排除标准:(1)严重器质性疾病及恶性肿瘤者;(2)既往有血栓及出血性疾病者;(3)服用过抗凝药物者。具有上述任1 标准的病例不纳入本研究。根据APACHE Ⅱ评分和SOFA[6]分为脓毒症组和脓毒症休克组;同时根据28 d 疾病转归情况分为存活组和死亡组。脓毒症组(n=48):男性30 例,女性18 例,年龄60~78 岁,平均年龄为(68.2±7.1)岁;脓毒症休克组(n=37):男20 例,女17 例,年龄61~79 岁,平均年龄为(68.5±7.1)岁。两组一般资料比较差异无统计学意义(P>0.05),具有可比性。
1.2 方法
1.2.1 TEG 参数及凝血参数测定 入院后第2d 采取晨起空腹肘正中静脉血3 mL,保存于EDTA 抗凝管中,在3000 r/min 转速下离心10 min,进行离心沉淀细胞,分离上清液后-70℃恒温冰箱保存,采用全自动凝血分析仪(日本希森美康,型号CS-166,试剂为France STAGO 公司提供)测定APTT、PT、TT、FIB、DD、R、K、 角、MA 及CI 值。见图1。
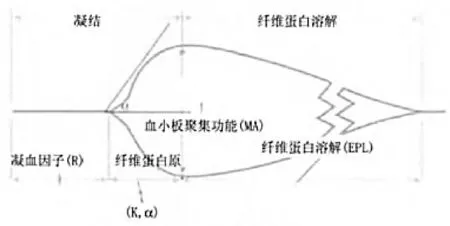
图1 TEG 图
1.2.2 患者预后 采用电话及门诊等方式对患者进行28 d 的随访,并记录患者的生存情况。
1.3 统计学分析 采用SPSS20.0 软件处理数据,以均数±标准差(±s)表示计量资料,经正态性检验与方差齐性检验后,正态分布且方差齐性的计量资料,2组间比较行独立样本t 检验,组内比较用配对样本t检验,服从正态分布各变量间相关性采用Spearman相关分析、以相关系数r 表示资料之间的相关性。P<0.05 为差异有统计学意义。
2 结果
2.2 不同病情程度患者的TEG 指标比较 脓毒症休克组R 与K 值高于脓毒症组, 角、MA 与CI 值低于脓毒症组(P<0.05)。见表2。
2.3 不同预后凝血功能指标比较 存活组患者的PT、APTT 与DD 水平低于死亡组(P<0.05);2 组TT 与FIB 水平比较差异无统计意义(P>0.05)。见表3。
2.4 不同预后TEG 指标比较 存活组患者的R 与K 值低于死亡组,角、MA 与CI 值高于死亡组(P<0.05)。见表4。
2.5 凝血参数与TEG 参数的相关性 Spearman 相关分析显示,PT、APTT、DD 水平与R、K 呈正相关,与角、MA、CI 呈负相关(P<0.05),TT、FIB、R、K、角、MA 与CI 相关性无统计学意义(P>0.05)。见表5。
3 讨论
由于老龄化趋势、免疫抑制剂广泛使用及多重耐药导致脓毒症发病率呈上升趋势。常表现为凝血功能紊乱和全身炎症反应,严重时可导致全身脏器功能衰竭,严重危及患者生命安全,因此寻找判断脓毒症患者病情并改善预后的工具至关重要[7]。
表1 不同病情程度凝血功能指标比较(±s)

表1 不同病情程度凝血功能指标比较(±s)
组别 PT(s) APTT(s) TT(s) FIB(g/L) DD(mg/L)脓毒症组( =48)脓毒症休克组( =37)images/BZ_88_275_2996_297_3020.png10.22±3.16 24.23±6.97 12.388<0.001 29.04±5.12 54.67±10.11 15.229<0.001 14.97±3.22 16.01±3.53 1.416 0.161 2.74±0.40 2.59±0.34 1.828 0.071 2.45±0.38 15.35±4.39 20.296<0.001
目前临床主要通过常规凝血指标的检测来确定凝血功能,但只能反映凝血的一个阶段,凝血状态不能明确确定,且FIB 不能充分反映纤维蛋白原功能状态[8]。由于TEG 操作简单,能在短时间内取得效果并能长期保持效果,在临床中应用越来越广泛,可客观地反映了血凝块形成的整个过程,从最初凝血物质的活化到纤维蛋白的形成,通过纤维蛋白与血凝块的相互作用,直至最终血凝块溶解,可判断凝血状态[9]。其中R值可反映凝血过程中涉及的所有凝血因子的联合作用;K 值及 角可反映了血凝块形成的速率;MA值可反映血凝块形成的最大强度和稳定性;CI 可反映样本凝血综合状态[10-11]。而PT 和APTT 是反映凝血内外试验的综合试验指标。APTT 延长提示因子活性增加;FIB 是血浆中含量最高凝血因子,其增加表明纤维蛋白活性增强;DD 是纤溶酶溶解纤维蛋白的产物,其水平升高提示机体处于高凝、高纤溶的状态[8,13]。本研究结果显示,脓毒症休克组患者的PT、APTT、DD、R 与K 高于脓毒症组, 角、MA 与CI 低于脓毒症组,与王希龙等[14]报道一致,说明脓毒症早期存在高凝状态,且随着感染加重,凝血纤溶异常更为明显,和病情严重程度有一定相关性。同时本研究对患者进行28 d 的随访,对比不同预后患者凝血与TEG参数,研究发现,存活组PT、APTT、DD、R 与K低于死亡组, 角、MA 与CI 值高于死亡组,进一步证实了凝血参数与TEG 参数对预后具有一定相关性。本研究的创新性为:进一步分析凝血参数与TEG 的相关性,Spearman 相关分析显示,PT、APTT、DD水平和R、K 呈正相关,和 角、MA、CI 呈负相关,提示凝血参数与TEG 参数具有一定的相关性,随着PT、APTT 与DD 水平的升高,R 与K 随之升高,MA与CI 降低,分析其原因可能为:脓毒症存在高凝状态,且病情程度越严重,凝血酶原生成时间越长,血凝块形成的速率越高,而血凝块形成的最大强度和稳定性较差,因此R、K 随PT、APTT、DD 水平升高,MA、CI 随PT、APTT、DD 水平降低[15]。但本研究纳入样本量较少,且随访时间较短,且未能连续监测TEG 和凝血参数,将扩大样本量进一步论证。
表2 不同病情程度TEG 指标比较(±s)
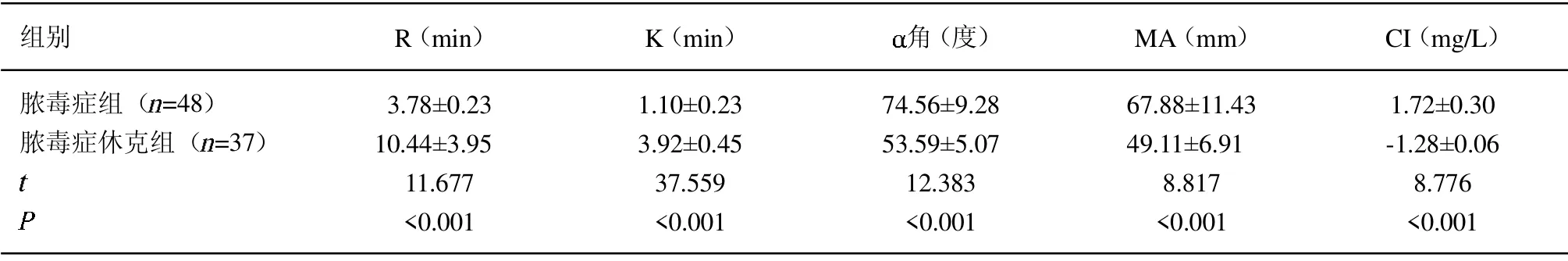
表2 不同病情程度TEG 指标比较(±s)
组别 R(min) K(min) 角(度) MA(mm) CI(mg/L)脓毒症组( =48)脓毒症休克组( =37)images/BZ_89_243_1501_266_1525.png3.78±0.23 10.44±3.95 11.677<0.001 1.10±0.23 3.92±0.45 37.559<0.001 74.56±9.28 53.59±5.07 12.383<0.001 67.88±11.43 49.11±6.91 8.817<0.001 1.72±0.30-1.28±0.06 8.776<0.001
表3 不同预后凝血功能指标比较(±s)
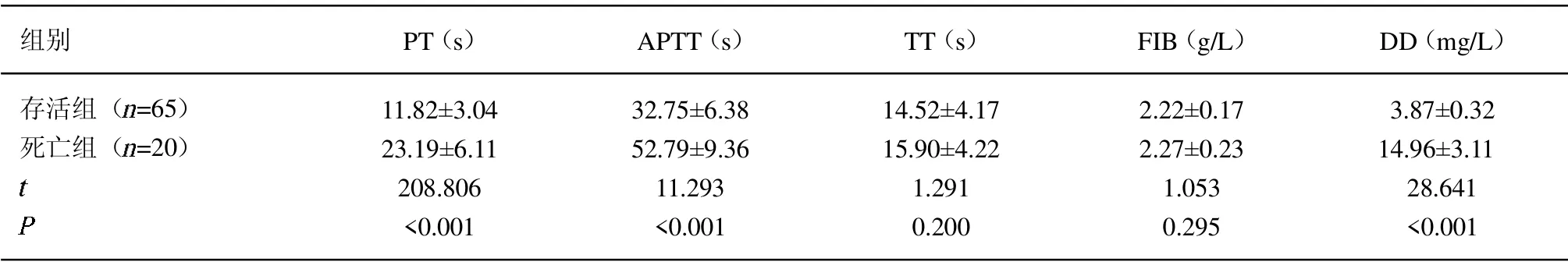
表3 不同预后凝血功能指标比较(±s)
组别 PT(s) APTT(s) TT(s) FIB(g/L) DD(mg/L)存活组( =65)死亡组( =20)images/BZ_89_243_1946_266_1970.png11.82±3.04 23.19±6.11 208.806<0.001 32.75±6.38 52.79±9.36 11.293<0.001 14.52±4.17 15.90±4.22 1.291 0.200 2.22±0.17 2.27±0.23 1.053 0.295 3.87±0.32 14.96±3.11 28.641<0.001
表4 不同预后TEG 指标比较(±s)
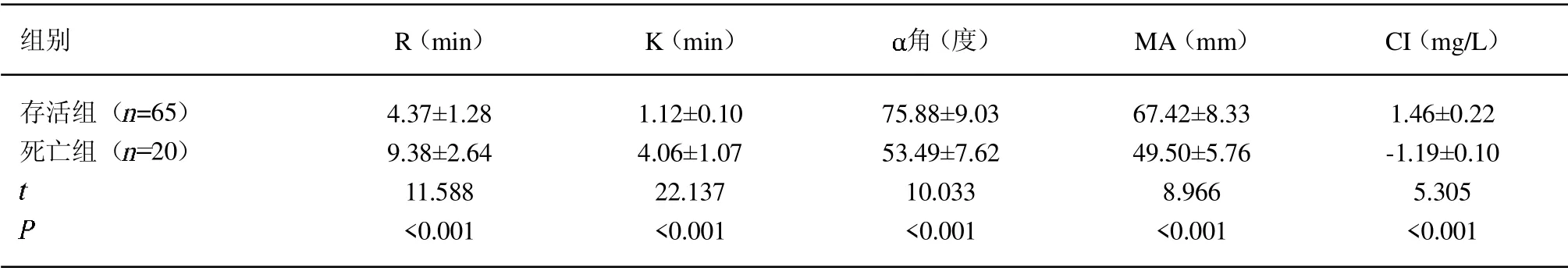
表4 不同预后TEG 指标比较(±s)
组别 R(min) K(min) 角(度) MA(mm) CI(mg/L)存活组( =65)死亡组( 20)images/BZ_89_243_2393_266_2416.png4.37±1.28 9.38±2.64 11.588<0.001 1.12±0.10 4.06±1.07 22.137<0.001 75.88±9.03 53.49±7.62 10.033<0.001 67.42±8.33 49.50±5.76 8.966<0.001 1.46±0.22-1.19±0.10 5.305<0.001
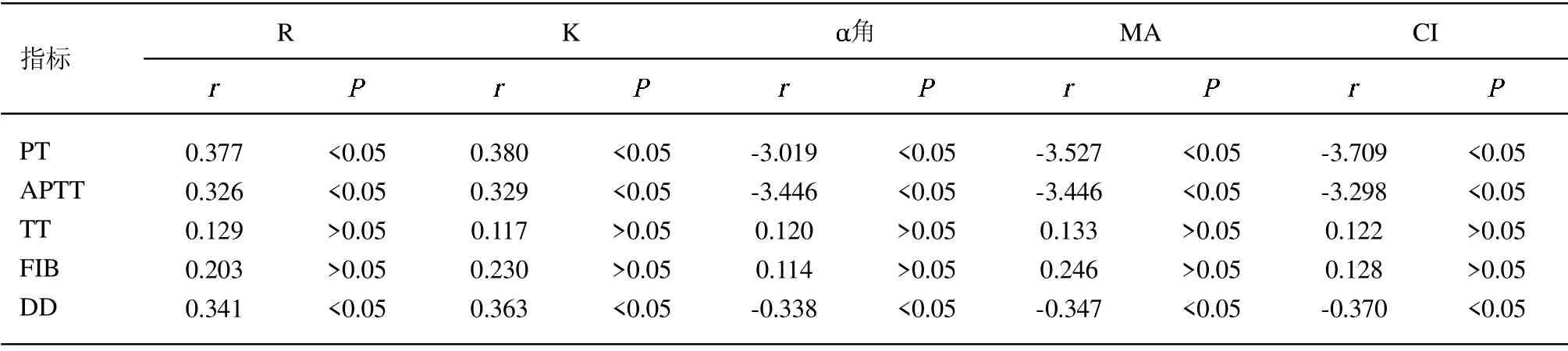
表5 凝血参数与TEG 参数的相关性
综上所述,TEG 和凝血参数可判断老年脓毒症患者凝血纤溶状态,与脓毒症病情严重程度和预后有一定相关性,但患者如果有肝损伤或肝硬化失代偿,会影响TEG,因此需要考虑基础肝功能状态,以及其他多种因素。
