温度对中华倒刺鲃不同生理生态性能的影响:驯化有益假说的验证
2021-04-25彭敏锐夏继刚
黄 艳,彭敏锐,夏继刚
进化生理与行为学实验室,重庆市动物生物学重点实验室,重庆师范大学生命科学学院, 重庆 401331
表型可塑性是自然选择和进化的基础,它不仅是生物表型的基本属性,而且存在于动物整个生活史进程[1- 3]。温度是动物栖息地环境最重要的非生物因子之一,温度对动物生理功能和生态学过程的影响是动物生理生态学领域的核心问题[4- 6]。热驯化是指动物调整自身的生理机能与行为表现以适应外界环境温度的变化,是动物表型塑造的一个特殊过程[7- 8]。开展热驯化对适合度密切相关的表型特征的研究有助于丰富动物温度适应性进化的理论内涵。目前,有关热驯化对外温动物适合度的影响尚有争议,主要涉及如下几个假说:(1)驯化有益假说(Beneficial acclimation hypothesis)认为,生物表型的适应性变化会增强其在诱导这些变化产生的环境中的生理机能或适合度,例如,经过特定温度驯化的动物,其运动能力或适合度与其他温度下生存的个体(在该温度下)相比有所提高,即动物的运动能力对驯化温度具有补偿性反应[9- 11];(2)热有益假说(Warmer is better hypothesis)和(3)冷有益假说(Cooler is better hypothesis)则分别认为,高温/低温下驯养的动物与其他温度下驯养的动物相比(在各种温度下)具有更好的行为表现或适合度[10];(4)最佳发育温度假说(Optimal developmental temperature hypothesis)认为,最佳环境温度下发育的动物与其他温度下发育的动物相比(在各种温度下)均具有更好的生理机能与行为表现[12];(5)无益假说(No-advantage hypothesis)认为,在动物正常活动的温度范围内,驯化温度对动物的行为表现无影响[7]。在以上各假说中,以驯化有益假说最具影响力,然而,尽管该假说获得了一些实验数据的支持,但其普适性一直存在较大争议[13- 15]。
运动是动物最为重要的生理活动之一,通常作为重要的功能性状被用于热生态学研究和驯化有益假说的验证[11]。游泳运动作为绝大多数鱼类重要的生存活动方式,是其实现逃逸、捕食、繁殖等多种行为功能及生态学过程的基础,与动物适合度密切相关[16- 17]。然而,鱼类为实现不同生理活动所采用的游泳方式不同。其中,稳定游泳主要存在于搜索食物和配偶、寻找适宜生境、生殖洄游等生理活动方面,由有氧代谢提供能量,与呼吸能力、组织有氧代谢能力、红肌的结构及相对比例等有关[18- 19];而非稳定游泳主要存在于捕食猎物/逃避捕食者、穿越复杂生境等生态表现方面,由无氧代谢提供能量,与无氧代谢能力、白肌的结构等有关[20- 21]。尽管稳定和非稳定游泳能力对鱼类生存繁衍均至关重要,然而,由于二者对机体形态以及生理生化等多方面存在相悖的需求,故而在适应性进化上可能存在多方面的限制与权衡[22- 23]。鉴于温度驯化对鱼类不同生理生态性能的影响可能不一致,那么,研究参数体系选择对热驯化相关假说的验证就尤为关键;因此,整合表征机体生存适合度的不同生理生态性能,进而揭示鱼类表型特征对热驯化的响应模式是必要的。为此,本研究以我国长江中上游广泛分布的中华倒刺鲃(Spinibarbussinensis)为对象,分别考察了驯化温度(18℃、28℃)和测试温度(18℃、28℃)及其交互作用对该物种有氧运动能力和无氧运动能力的影响,为驯化有益假说等相关假说的验证提供参考。
1 材料与方法
1.1 实验动物
实验鱼((2.90±0.10) g,(5.71±0.0) cm,n=60)购于重庆合川水产学校,置于实验室自净化循环控温水槽(1.2 m×0.55 m×0.55 m,实际水量250 L)中驯养适应2周。适应期间,实验用水为曝气后的自来水,保证水体溶氧≥90%饱和溶氧,水温(23±0.1)℃,日换水量约为驯养水体的10%,光周期15 L: 9 d;每日投喂1次冰冻红虫,投喂15 min后用虹吸管清除残饵及粪便。
1.2 实验方案
适应结束后,将实验鱼随机分为两组,将水温从23℃开始分别以1℃/d的速率升温至28℃或降温至18℃(28℃和18℃分别接近实验鱼栖息地在夏季、春秋季的平均温度,均未超过实验鱼的适宜温度范围[24]),然后将实验鱼分别在各自的目标温度下(18℃、28℃)驯化2周(温度驯化处理)。将经过不同温度驯化处理的实验鱼禁食24 h,然后分别在不同的测试温度下(18℃、28℃)(测试温度处理)测定其无氧运动能力,之后,将实验鱼放回原有的温度驯化环境恢复24 h再进行有氧运动能力测定,最后分析驯化温度(18℃、28℃)和测试温度(18℃、28℃)及其交互作用对实验鱼不同生理生态性能的影响。温度驯化期间,除了水温不同外,其余水质环境条件以及喂养水平等与驯养适应期间保持一致。测试期间,水温精度控制在±0.1℃。各组测试样本量均为n=15。
1.3 无氧运动能力测定
采用鱼类快速启动游泳能力(Fast-start performance)测定系统进行测定[23,25],该系统主要包括一个方形实验缸(长×宽×高, 40 cm×40 cm×15 cm;实验缸底部的透明有机玻璃板上刻有1 cm×1 cm的网格线)、一个位于水槽正下方30 cm处的LED矩阵光源以及一个LED电脉冲指示灯等。将直径1 mm的白色小塑料球固定在实验鱼背部中央皮肤表层,作为实验鱼的质心标记,然后将单尾实验鱼转入测试系统,并给予5 min的适应期以消除转移胁迫。测试水体水深8 cm,溶解氧≥90%饱和溶氧。实验鱼的快速启动逃逸行为由电脉冲刺激所激发(电刺激场强:0.75 v/cm,刺激时长:50 ms)。在发送电脉冲刺激的同时,用高速摄影机(500帧/s, BASLER A504K, Germany)开始拍摄记录实验鱼的整个逃逸过程,拍摄历时2 s。LED指示灯电源与刺激电源并联,可以通过摄像机捕获的图像确定刺激起始时刻。
采用图像处理软件(nEO iMAGING和ACDsee 12)对拍摄的图像进行处理,采用软件TpsUtil和TpsDig(http://life.bio.sunysb.edu/morph/)将图像数字化以测量实验鱼质心位移,依据质心轨迹计算出反应时滞(Latency time,TLatency)、最大线速度(Maximum linear velocity,Vmax)、最大加速度(Maximum linear acceleration,Amax)以及刺激起始120 ms内质心移动位移(Escape distance during the first 120 ms after the stimulus,S120ms)等参数。
1.4 有氧运动能力测定
1.4.1临界游泳速度(Critical swimming speed,Ucrit)
采用鱼类游泳代谢仪测定Ucrit[26]。测定时,将单尾实验鱼放入游泳管中适应20 min以使其适应微水流环境(6 cm/s,约为每秒一倍体长)。之后,将水流从6 cm/s开始,每隔20 min提升一次流速(流速增量为6 cm/s)并换水1次以确保游泳管内的水体溶氧不低于初始水平的80%,直至实验鱼到达力竭状态。力竭状态的判定标准是实验鱼停留在游泳管末端筛板20 s以上[26]。Ucrit的计算公式如下:
Ucrit=U+ (t/T)ΔU
式中,Ucrit为临界游泳速度,U为完成设定时间(20 min)游泳所游过的最大速度,ΔU为速度增量(6 cm/s),T是在各速度梯度下设定的持续游泳历时(20 min),t为出现力竭状态的速度下的实际游泳时间。
1.4.2运动代谢率
在Ucrit测定过程中,使用溶氧仪(HQ30, Hach Company, Loveland, CO, USA)对游泳管内水体的溶氧水平进行测定,每2 min测定1次,得出实验鱼的运动代谢率(Active metabolic rate,MO2)(mg O2kg-1h-1)。MO2的计算公式如下:
MO2=60 (S-S0)V/m
式中,S、S0分别为游泳管内水体在有实验鱼和无鱼(细菌耗氧)状况下的溶氧水平随时间变化斜率的绝对值,V为游泳管水体系统总体积(3.5 L)减去实验鱼所占的体积,m为实验鱼的体重(kg)。
中国的改革开放体现的实践的伟大之处在于它一方面继承着中国发展而来的历史经验,另一方面创新着中国发展出去的民族精神。习近平总书记在庆祝改革开放40周年大会指出: “只有顺应历史潮流,积极应变,主动求变,才能与时代同行。”[1]新时代的具体实践方案体现的就是中国的发展思路、中国的战略定位、中国的世界眼光,实践方案关系着改革开放能否顺利的承接历史使命,关系着中华民族的前途命运。我们还应该在伟大实践的新时代方案中不断深化改革开放的政治意义、时代意义、民族意义。
将Ucrit测定过程中测得的最大MO2记为最大代谢率(Maximum metabolic rate, MMR)[23]。
1.4.3游泳效率
通过测定游泳运动单位距离能量消耗(The energetic cost of transport, COT)来反映游泳效率,COT(J/m)越大则游泳效率越低[19, 26]。COT的计算公式如下:
COT=13.56MO2/(U×36)
式中,MO2为不同游泳速度U下的耗氧率,13.56为氧热当量系数(J/mg O2)[27]。
1.5 数据分析
采用SPSS软件(SPSS 19.0 Inc., USA)对数据进行统计分析。首先对实验数据进行正态性(Shapiro-Wilks检验)和方差齐性检验。采用双因素方差分析和Tukey′s HSD多重比较检验驯化温度和测试温度对实验鱼有氧运动能力(Ucrit、MMR)和快速启动能力(TLatency、Vmax、Amax、S120 ms)的影响,采用三因素方差分析检验驯化温度、测试温度、游泳速度(水流速度)对运动代谢率MO2和COT的影响。数据均以平均值±标准误表示,显著性水平设为P<0.05。
2 结果与分析
2.1 温度对实验鱼无氧运动能力的影响
除Amax外,驯化温度对TLatency、Vmax、S120 ms均无显著影响(P>0.05,表1,图1),结果倾向于支持无益假说。测试温度对TLatency、Amax、S120 ms的影响显著(P<0.05,表1)。无论驯化温度如何,28℃测试环境下TLatency均较短,S120 ms均较长(P<0.05);28℃驯化—28℃测试下的Amax优于18℃驯化—28℃测试下的Amax(P<0.05,图1),该数据部分支持驯化有益假说。
2.2 温度对实验鱼有氧运动能力的影响
驯化温度、测试温度及其交互作用对实验鱼Ucrit的影响显著(P<0.05,表1)。18℃驯化—18℃测试下的Ucrit优于28℃驯化—18℃测试下的Ucrit(P<0.05),结果支持驯化有益假说和冷有益假说;然而28℃驯化—28℃测试下的Ucrit与18℃驯化—28℃测试下的Ucrit相比无显著差异(P>0.05,图2),结果又不支持前述假说。
驯化温度和测试温度对实验鱼MMR均有显著影响(P<0.05,表1)。18℃驯化—18℃测试下的MMR优于28℃驯化—18℃测试下的MMR(P<0.05),结果支持驯化有益假说和冷有益假说;然而28℃驯化—28℃测试下的MMR也低于18℃驯化—28℃测试下的MMR(P<0.05,图2),结果仅支持冷有益假说。
2.3 温度对实验鱼运动代谢率和游泳效率的影响
驯化温度、测试温度、游泳速度对实验鱼的运动代谢率MO2影响显著(P<0.05,表1)。当游泳速度小于30 cm/s时,驯化温度对MO2无影响,结果支持无益假说(P>0.05);而当游泳速度大于30 cm/s时,在特定的流速下经28℃驯化的实验鱼无论在28℃还是18℃的测试环境下MO2均较低(P<0.05,图3),结果支持热有益假说。

表1 驯化温度和测试温度对中华倒刺鲃生理生态参数的影响
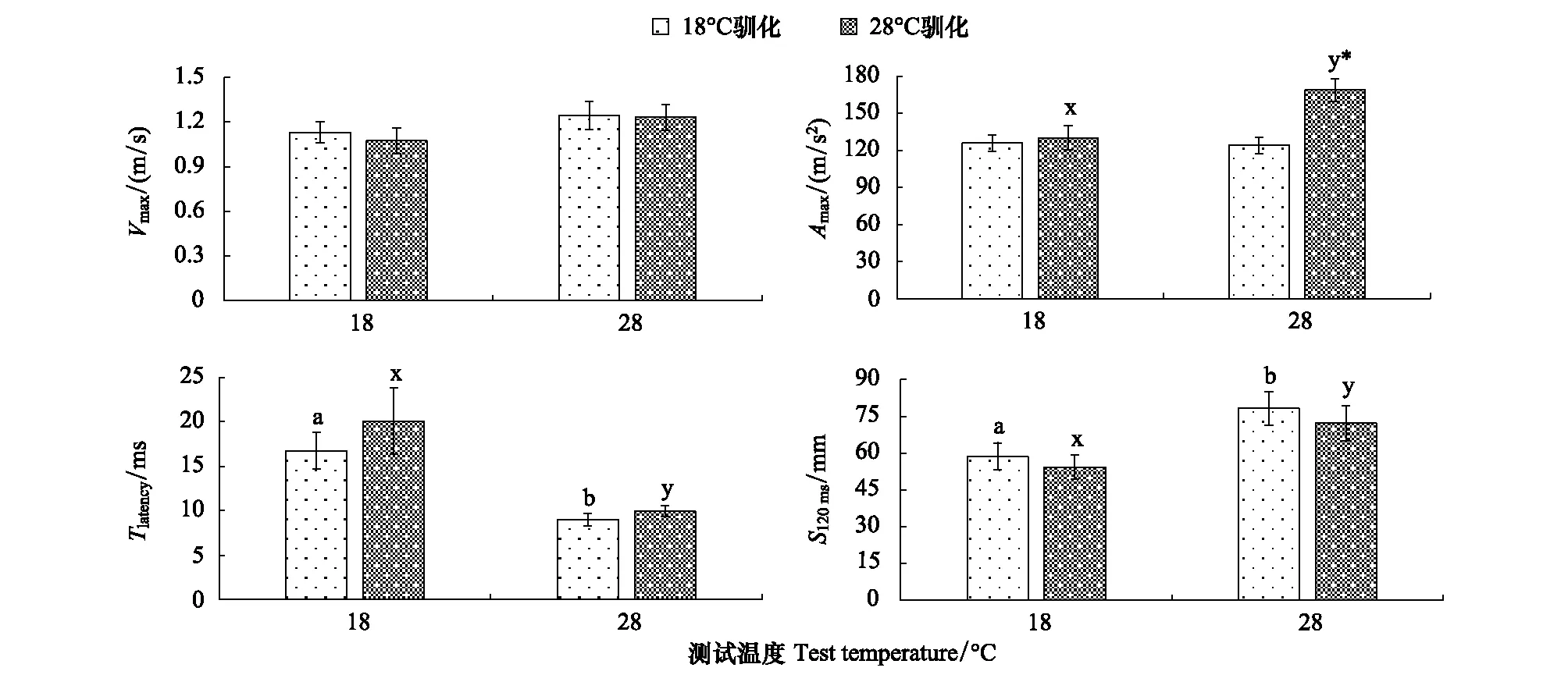
图1 驯化温度和测试温度对中华倒刺鲃Vmax、Amax、TLatency、和S120 ms的影响Fig.1 The effects of acclimation temperature and test temperature on Vmax, Amax, TLatency and S120 ms in Spinibarbus sinensisVmax: 最大线速度 Maximum linear velocity; Amax: 最大加速度 Maximum linear acceleration; TLatency: 反应时滞 Latency time; S120 ms: 刺激起始120 ms内质心移动位移 Escape distance during the first 120 ms after the stimulus;*表示同一测试温度下不同温度驯化组间差异显著(P<0.05);a, b上标字母不同表示18℃驯化的实验鱼在不同测试温度下差异显著(P<0.05);x, y上标字母不同表示28℃驯化的实验鱼在不同测试温度下差异显著(P<0.05)
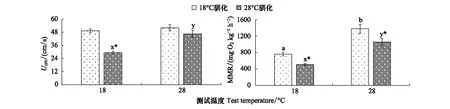
图2 驯化温度和测试温度对中华倒刺鲃Ucrit和MMR的影响Fig.2 The effects of acclimation temperature and test temperature on Ucrit and MMR in Spinibarbus sinensisUcrit: 临界游泳速度 Critical swimming speed; MMR: 最大代谢率 Maximum metabolic rate; *表示同一测试温度下不同温度驯化组间差异显著(P<0.05);a, b上标字母不同表示18℃驯化的实验鱼在不同测试温度下差异显著(P<0.05);x, y上标字母不同表示28℃驯化的实验鱼在不同测试温度下差异显著(P<0.05)
类似地,驯化温度、测试温度、游泳速度对实验鱼运动单位距离能耗COT影响显著(P<0.05,表1)。当游泳速度小于30 cm/s时,驯化温度对COT无影响(P>0.05,图3),结果支持无益假说;而当游泳速度大于30 cm/s时,在特定流速下经28℃驯化的实验鱼无论在28℃还是18℃的测试环境下COT均较低(P<0.05,图3),结果支持热有益假说。
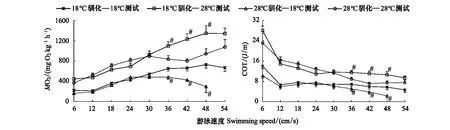
图3 驯化温度、测试温度和游泳速度对中华倒刺鲃MO2和COT的影响Fig.3 The effects of acclimation temperature, test temperature and swimming speed on MO2 and COT in Spinibarbus sinensisMO2: 运动代谢率 Active metabolic rate; COT: 单位距离能耗 The energetic cost of transport; #表示在特定水流速度和同一测试温度下不同温度驯化组间差异显著(P<0.05)
3 讨论
多数硬骨鱼类经常暴露在温度变化的水环境中,这种温度变化一般分为急性温度变化(例如潮汐、迁移)和慢性温度变化(例如季节变换、昼夜节律)[28-30]。伴随着温度波动,鱼体生理机能及其生态表现的可塑性将决定其能否在极端温度条件下生存,这一特性是鱼类应对温度急性/慢性变化的关键因素[31- 34]。
通常情况下,与遭遇环境骤然变化的动物相比,经历相同或相似环境驯化的动物具有充足的时间调整自身的生理、形态和行为,以使其能够在该环境中能更好地生存[10- 11,31]。驯化有益假说正是基于这一背景提出的,并在一系列实验中进行了检验。李晓晨等[35]发现,22℃驯化—22℃测试下的胡氏大生熊虫(Macrobiotushufelandi)运动时间比、运动速度显著大于2℃—22℃测试下的动物,但2℃驯化—2℃测试下的动物与22℃驯化—2℃测试下动物的运动表现相比无显著差异,结果部分支持驯化有益假说;该研究同时还发现,任何偏离驯化温度的实验温度都会造成表征动物适合度的运动速率的下降。Geister等[36]探究了不同测试温度(27℃、20℃)条件下,发育温度(27℃、20℃)和驯化温度(27℃、20℃)对丛林斜眼褐蝶(Bicyclusanynana)交配成功率的影响,结果发现在20℃测试环境下经历20℃驯化的动物的表现远远优于其他个体,然而在27℃测试环境下并非所有经历27℃驯化的个体的表现均优于经历20℃驯化的个体(仅经历20℃发育27℃驯化的个体更具优势),结果部分支持驯化有益假说。此外,陆洪良等[37]发现,经25℃驯化的东方蝾螈(Cynopsorientalis)在25℃测试温度游泳速度最大,15℃和20℃下驯化的蝾螈在对应的测试温度下游泳速度亦稍大,表明经特定温度驯化的动物在该温度下具有增强的功能表现和适合度,结果总体上支持驯化有益假说。
一般认为,表型的驯化适应性变化能提高有机体(在诱导表型响应发生环境下)的生理机能或适合度,但在确定驯化对表型变化产生的功能作用方面时,对驯化现象往往又产生一些争论,包括表型如何提高生理功能、行为表现、生长、繁殖以及存活等[10, 35, 38]。不仅如此,机体不同器官和组织对驯化环境的响应与适应时间也很可能存在差异[39- 40],例如,经过快速降温后,中华倒刺鲃的低温耐受和高温耐受能力分别于降温的1—2周达到稳定,而游泳运动能力在4周达到稳定,消化功能可在短期(1周内)得以调整稳定[40]。因此,合适的表型性状的选择对驯化有益假说检验至关重要[41- 42]。值得注意的是,以往的研究往往局限于用生物某一方面甚至是某一个表型来对驯化有益假说进行验证,所得出的结论很可能具有片面性。本研究整合鱼类的不同生理生态性能验证驯化有益假说(而且这些不同的生理生态性能之间本身又存在着相悖的进化需求),研究结果并非简单的支持或否定驯化有益假说。研究发现,中华倒刺鲃不同生理生态性能对温度驯化的响应存在差异。总体上,驯化温度对表征中华倒刺鲃无氧运动能力的快速启动游泳无显著影响(除Amax外),但对表征中华倒刺鲃有氧运动能力的Ucrit和MMR影响显著,并且显著影响中华倒刺鲃的运动代谢率MO2以及运动单位距离能耗COT。其一,快速启动能力受驯化温度影响不显著,而受测试温度影响显著,暗示中华倒刺鲃无氧运动能力可对环境温度变化产生快速的响应与适应,该结果倾向于支持热驯化的无益假说。其二,动物有氧运动关联的生理机能对热驯化的响应与调整通常涉及到酶系统的改变、代谢底物积累、膜结构调整、热休克蛋白表达的变化等[29,43]。当动物遭遇环境的骤然变化时,其生理功能的调整往往难以在短时间内完成。与无氧运动能力对驯化温度的响应相比,本研究中,驯化温度和测试温度对表征中华倒刺鲃有氧运动能力的Ucrit和MMR均影响显著。18℃驯化—18℃测试下的Ucrit和MMR均优于28℃驯化—18℃测试下的Ucrit和MMR,然而,28℃驯化—28℃测试下的Ucrit和MMR并不高于18℃驯化—28℃测试下的Ucrit和MMR,该结果部分支持驯化有益假说和冷有益假说。其三,驯化温度、测试温度和游泳速度对中华倒刺鲃运动代谢率MO2和COT影响显著。有趣的是,当游泳速度小于30 cm/s时,驯化温度对MO2和COT无影响,结果支持无益假说;而当游泳速度大于30 cm/s时,在特定的流速下经过28℃驯化的中华倒刺鲃无论是在28℃还是18℃的测试环境下MO2和COT均较低,结果又倾向于支持热有益假说,本研究结果同时表明驯化有益相关假说的验证还与测试对象所处的环境压力及其强度有关。其四,对游泳能力(Ucrit和MMR)的测试结果部分支持驯化有益假说和冷有益假说,而在高流速下对游泳效率(COT)检测结果倾向于支持热有益假说,暗示急性温度变动下实验鱼的游泳能力与游泳效率变化具有非同步性,急性温度升高可能对实验鱼具有更大的“兴奋刺激”作用引起更强的急性应激反应[30]。
综上,本研究发现中华倒刺鲃不同生理生态性能对温度驯化的响应不一致,并分别支持不同的假说。由于机体不同器官和组织对驯化环境的响应与适应时间存在差异,因此合适的表型性状的选择对驯化有益假说的检验尤为关键,加之不同测试环境压力下动物生理功能(例如MO2和COT)对热驯化的响应又表现出相异的规律,未来研究中选取切实有效的整体功能性状(例如,优质生境占有率、捕食成功率、食物和配偶资源占有率等)[42],进而揭示鱼类表型对热驯化的响应模式是必要的。研究提示:驯化有益假说并不具有普遍性,热驯化相关假说的验证不仅受表型性状选择的影响,而且还与测试的环境选择压力有关。
