CT灌注成像用于评估TACE联合阿帕替尼治疗中晚期原发性肝癌疗效的临床研究
2021-04-25黄石市第二医院放射科湖北黄石435000
黄石市第二医院放射科 (湖北 黄石 435000)
李青薛*
原发性肝癌(hepatocellular carcinoma, HCC)是发病率仅次于肺癌和胃癌的常见恶性肿瘤,起病隐匿、易复发,多数患者确诊时已处于疾病中晚期,错过了手术治疗的最佳时机,再加上术后残留病灶等一系列影响,导致中晚期HCC患者的远期预后较差[1]。经导管动脉化疗栓塞术(transcatheter arterial chemoembolization,TACE)采用Seldinger法经皮穿刺动脉血管,将导管选择性或超选择性插入肿瘤相关供血动脉,经导管灌注化疗药物,使肿瘤细胞直接暴露于高浓度化疗药物环境内,可达到治疗作用,现已成为无法手术切除的中晚期HCC患者的首选治疗方法[2-3]。单纯TACE治疗后残留的肝癌组织缺氧,刺激残存病灶中的血管内皮生长因子(vascular endothelial growth factor,VEGF)表达,导致肿瘤血管重生,使肿瘤组织侵袭性和转移性增强[4]。阿帕替尼是一种新型的口服抗血管生成药物,大量研究证实TACE联合阿帕替尼治疗中晚期HCC可有效抑制血管内皮细胞增殖和迁移,从而抑制肿瘤生长[5-6]。术后及时客观、理性地评价治疗疗效对指导临床治疗方案的制定具重要意义,还可避免过度治疗及医疗资源的浪费。CT平扫是以往临床评价TACE治疗疗效的主要依据,但单纯根据碘化油的沉积形态难以准确判断术后是否有病灶残存或新生。近年来随着CT技术的飞速发展,CT灌注成像(CT perfusion imaging,CTPI)可直观评估介入治疗术后肿瘤的存活情况,引起了临床的重点关注[7]。本研究主要观察CTPI用于评估TACE联合阿帕替尼治疗中晚期HCC疗效的应用价值,结果如下。
1 资料与方法
1.1 一般资料纳入2017年3月至2019年3月期间我院收治的中晚期HCC患者56例。纳入标准:经病理、血清学及B超、CT等影像学检查确诊的中晚期HCC,于我院首次行TACE联合阿帕替尼治疗,并在术前1~3d和术后1~2个月接受CTPI检查;肝功能Child-Pugh分级A级或B级;巴塞罗那肝癌分期(BCLC)B期或C期;患者自愿签署知情同意书。排除标准:肝内其他占位性病变;介入治疗前曾经外科手术治疗;心肺肾功能严重障碍;伴远处转移或严重腹腔积液;停服药物超过1个月。本研究病例中,男42例,女14例,年龄34~76岁,平均年龄(58.62±9.20)岁;病灶位于肝右叶40例,肝左叶16例;病灶直径3~14cm,平均直径(7.20±2.08)cm;Child-Pugh分级A级39例,B级17例;BCLC分期B期44例,C期12例。
1.2 治疗方法纳入患者均采用Seldinger法经皮穿刺右侧股动脉血管,使用2.7F微导管超选插入病灶供血血管,采用5mL碘油+50mg奥沙利铂+10mg表柔比星乳化均匀后灌注,直至供血血管内血流缓慢停止,造影见肿瘤染色消失,供血动脉闭塞,手术结束。术后3d起开始服用阿帕替尼,初始剂量为500mg/d,1~2周后根据患者耐受情况可减量至250mg/d或暂停服药,待不良反应缓解后再恢复原剂量服药,停药时间不能超过1个月。
1.3 CTPI检查方法检查前禁食4h,训练患者呼吸配合,嘱其在扫描期间尽可能屏住呼吸或保持均匀的小幅度短促呼吸。采用Siemens Defintion双源螺旋CT,患者取仰卧位,先行全肝CT平扫定位,再选取肿瘤面积最大的层面作为扫描中心层面进行同层动态扫描,采用电影模式,球管每旋转1圈扫描4层,层厚7.2mm,层间距0mm,时间1s,120kV,100mA,矩阵512×512。经肘静脉采用双筒高压注射器快速团注370mg(I)/mL优维显,注射速率5.0mL/s,注射总量60mL。扫描延迟8s,120kV,100mA,矩阵512×512,探测器24mm×1.2mm,数据采集50s,共产生200幅图像。
1.4 图像分析将图像传至工作站,采用肝脏灌注模式,阈值范围-50~150HU,以腹主动脉为输入动脉,门静脉为输入静脉,选择感兴趣区(ROI)层面,再使用Perfusion软件进行图像后期处理。选择病灶最大层面作为分析计算层面,以选定层面上的主动脉或左颈总动脉为参考血管,选择感兴趣区(ROI)层面,通过计算机处理自动生成时间-密度曲线(TDC),在距离肿块边缘约2mm内描绘ROI获得灌注参数,尽可能选择大面积的ROI,以降低噪声影响,同时注意避免因容积效应导致的灌注测量误差。计算肝血流量(BF)、肝血容量(BV)、平均通过时间(MTT)、肝动脉灌注指数(HPI)、肝动脉灌注量(HAP)、门静脉灌注量(PVP)。选取3次不同层面计算,取平均值。
1.5 统计学分析应用SPSS 21.0软件处理数据,灌注参数以(±s)表示,行t检验。以P<0.05为差异有统计学意义。
2 结 果
2.1 治疗前后的CTPI图像表现56例患者肿瘤组织全肝灌注均获得较为满意的CTPI重建图像。治疗前BF、BV、MTT、HPI、HAP均为高血流灌注表现,其中17例表现为均匀高灌注,39例表现为不均匀高灌注,液化坏死区呈低灌注或无血流灌注;PVP均呈低血流灌注表现,明显低于周围正常肝实质(见图1)。治疗后,16例病灶区碘油致密充填,40例病灶区碘油不均匀充填;碘油区BF、BV、MTT、HPI、HAP、PVP均呈无血流灌注表现,碘油部分缺损或稀疏区呈相对肝动脉高血流灌注表现(见图2)。

图1 治疗前CTPI图像。1A:CT平扫示肿瘤内碘油沉积密实;1B:HAP示肿瘤均匀高灌注;1C:HAP示肿瘤不均匀高灌注,中心坏死区无血流灌注;1D:PCV示肿瘤低灌注。图2 治疗后CTPI图像。2A:CT平扫示肿瘤内碘油沉积不均匀;2B:HAP示碘油浓聚区无血流灌注;2C:PVP示碘油浓聚区无血流灌注;2D:HPI示碘油缺损或稀疏区有血流灌注。
2.2 治疗前后肿瘤组织的灌注参数比较治疗后肿瘤组织的BF、BV、HPI、HAP较治疗前均显著降低,差异有统计学意义(P<0.05);治疗后肿瘤组织的MTT、PVP较治疗前无显著变化,差异无统计学意义(P>0.05,见表1)。
2.3 治疗后残瘤组织与正常肝组织的灌注参数比较治疗后38例患者局部有肿瘤残瘤,残瘤组织的BF、BV、HPI、HAP显著高于正常肝组织,差异有统计学意义(P<0.05);残瘤组织的MTT、PVP显著低于正常肝组织,差异有统计学意义(P<0.05,见表2)。
3 讨 论
肝脏血流供应改变是HCC病情进展中的重要变化,这一过程包括肿瘤内皮细胞增殖、毛细血管形成、肿瘤血管与宿主血管合并等,可使肿瘤细胞快速生长,短期内可发展至中晚期阶段[8]。TACE能有效阻断肿瘤的供血动脉,在不影响正常肝组织血供的情况下,减少肿瘤组织灌注量,使肿瘤细胞缺氧坏死[9]。但单纯TACE治疗难以彻底杀死肿瘤细胞,术后栓塞组织细胞缺血缺氧可分泌VEGF等多种生长因子,促进肿瘤生长和转移[10]。血管新生是恶性肿瘤发生、发展的重要关键,因此TACE常联合靶向血管生成抑制剂治疗,可有效阻止肿瘤血管新生。阿帕替尼是一种小分子络氨酸激酶抑制剂(EGFRTKI),可抑制多种类型的肿瘤细胞活性及其侵袭能力,通过RET/Src等信号通路产生细胞毒性,起到治疗肿瘤的效果,明显延长中晚期患者的生存时间[11-12]。而治疗后如何准确监测肿瘤血供变化、正确评估治疗疗效,对后续治疗方案的制定和最佳治疗时机的选择具重要的临床意义。
血管造影(digital subtraction angiography,DSA)是评价TACE疗效的“金标准”,但由于其为有创检查,检查费用较高,术后多次检查并不现实,无法在临床高效推广;常规CT是通过观察碘油沉积和密度改变来评价肿瘤坏死程度,目前并无公认的量化标准,同时术后肿瘤内碘油沉积还会掩盖残瘤组织的CT强化表现,影响影像医师的观察;MRI检查不受碘油沉积影响,采用MR弥散成像(diffusion weighted image,DWI)可鉴别肿瘤成活和坏死组织,但由于肿瘤存活区和坏死区DWI信号之间存在重叠,也会影响评估的准确性[13-14]。随着CT技术的不断发展和更新,CTPI作为一种无创性的功能成像方法在肝脏疾病的临床诊断中表现出一定优势,得到广泛应用。CTPI是静脉团注对比剂后对选定层面进行动态扫描,通过工作站后处理获得该层面的TDC曲线,计算各种灌注参数评价组织器官的血流动力学变化。已有研究证实,CTPI测量的多种灌注参数与肿瘤微血管密度(microvesseldensity,MVD)及VEGF的表达有密切的相关性,可通过分析灌注参数获得肿瘤血管生成情况的相关信息,评估TACE的治疗疗效[15]。
表1 治疗前后肿瘤组织的灌注参数比较(±s)
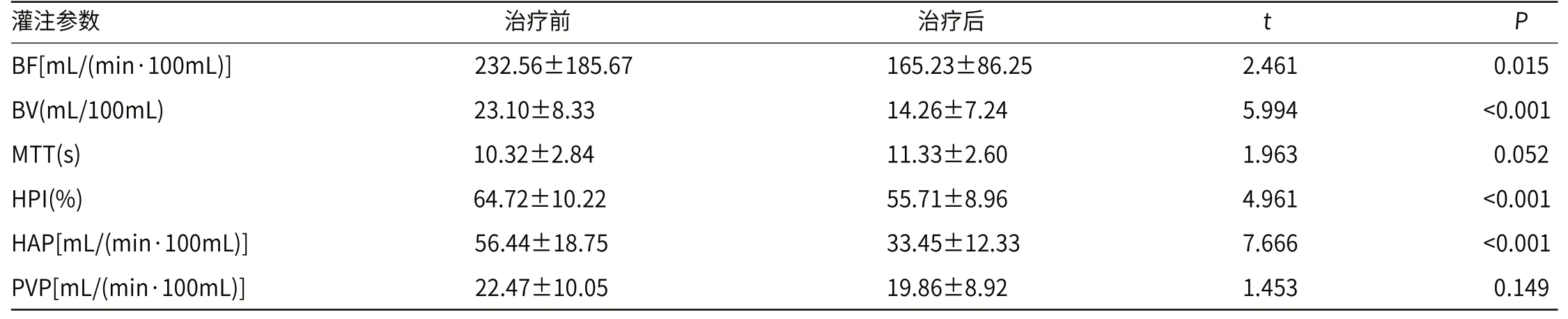
表1 治疗前后肿瘤组织的灌注参数比较(±s)
灌注参数 治疗前 治疗后 t P BF[mL/(min·100mL)] 232.56±185.67 165.23±86.25 2.461 0.015 BV(mL/100mL) 23.10±8.33 14.26±7.24 5.994 <0.001 MTT(s) 10.32±2.84 11.33±2.60 1.963 0.052 HPI(%) 64.72±10.22 55.71±8.96 4.961 <0.001 HAP[mL/(min·100mL)] 56.44±18.75 33.45±12.33 7.666 <0.001 PVP[mL/(min·100mL)] 22.47±10.05 19.86±8.92 1.453 0.149
表2 治疗后残瘤组织与正常肝组织的灌注参数比较(±s)

表2 治疗后残瘤组织与正常肝组织的灌注参数比较(±s)
灌注参数 残瘤组织 正常肝组织 t P BF[mL/(min·100mL)] 178.55±88.56 98.33±42.28 5.039 <0.001 BV(mL/100mL) 18.28±8.59 11.27±5.22 4.299 <0.001 MTT(s) 8.77±3.27 14.08±5.24 5.300 <0.001 HPI(%) 54.78±14.89 28.75±12.52 8.248 <0.001 HAP[mL/(min·100mL)] 41.88±12.32 16.05±5.66 11.744 <0.001 PVP[mL/(min·100mL)] 21.86±12.44 48.85±15.29 8.441 <0.001
由于碘油浓聚,本研究治疗后肿瘤坏死及存活区域的增强CT均呈高密度表现,碘油沉积区CTPI表现为无血流灌注,灌注图像呈黑色;碘油稀疏区有残瘤时,HAP图可清晰显示斑点状黑色碘油沉积区出现红色或黄色的血流灌注区。CTPI除可通过图像观察反映残瘤信息外,还可通过肿瘤内各区域的血供参数进行定量分析,提高评估的准确性和客观性。已有大量研究证实,栓塞术后肿瘤内部及周边动脉狭窄、闭塞导致肝固有动脉流速下降,对化疗敏感和栓塞治疗效果较好的患者,肝固有动脉血流速度降低与肿瘤内部血流减少或消失是一致的[16-17],因此对于治疗后血供明显减少或消失的患者,可认为其治疗疗效较好。本研究治疗后肿瘤组织的BF、BV、HPI、HAP较治疗前均显著降低,与上述病理改变一致,证实肿瘤主要由肝动脉供血,TACE联合阿帕替尼治疗后肝动脉血流明显减少。本研究中残瘤组织的BF、BV、HPI、HAP显著高于正常肝组织,残瘤组织的MTT、PVP显著低于正常肝组织,与李珊玫等[18]的报道一致,提示CTPI可通过定量分析灌注参数来评估肿瘤的存活情况,预测治疗疗效。
综上所述,CTPI用于评估TACE联合阿帕替尼治疗中晚期HCC疗效的应用价值较高,可通过灌注参数定量分析和判断肿瘤存活与坏死,为患者进一步治疗方案的制定提供依据。
