藜麦蛋白质提取工艺优化
2021-04-24马洪鑫刘粟心杨许花郭鹏辉高丹丹
马洪鑫,刘粟心,杨许花,郭鹏辉,高丹丹*
(1.西北民族大学生命科学与工程学院,甘肃兰州730124;2.西北民族大学生物医学研究中心,甘肃兰州730030)
藜麦(Chenopodium quinoa Wild.)又名奎藜、灰米、金谷子等,是藜科一年生草本开花植物。藜麦原产于南美洲安第斯山脉的哥伦比亚、厄瓜多尔、秘鲁等中高海拔山区等地[1]。1987 年,藜麦在我国西藏地区引进种植,现已在山西、吉林、青海、甘肃等地实现产业化种植[2]。研究表明,藜麦含有大量的优质蛋白(大部分为白蛋白和球蛋白),其蛋白质量分数高于一般谷物,平均质量分数达到12%~23%[3]。与水稻相比,其必需氨基酸、维生素和矿物质的含量更高,是具有较高营养特性的谷类食品,还富含多酚等抗氧化物[4]。由于其较高的营养价值,藜麦被FAO 认定为非转基因营养食品,被称为“营养黄金”。NASA 也将其列为宇航员的理想食物。因此,藜麦因其丰富的营养价值在食品界拥有巨大的应用潜能。
目前对藜麦总蛋白的提取方法主要有碱溶酸沉法、酶法、复合提取法等,其中碱溶酸沉法为目前最主要的提取方法。目前国内外的研究中,主要利用正交实验来优化藜麦总蛋白的提取,但正交实验只能分析离散型数据,具有精确度不高、预测性较差等缺点。而响应面法采用多元二次回归方程来拟合因素与响应值之间的函数关系,能得到高精度的回归方程,可进行合理预测来找出最佳工艺条件。本实验采用碱溶酸沉法进行蛋白质提取,采用单因素和响应面法对蛋白质提取工艺进行优化,为研发藜麦生物制品提供理论支持和技术支持。
1 材料与方法
1.1 材料与仪器
藜麦(产地青海,由青海新绿康食品公司提供);氢氧化钠、硫酸铜、硫酸、酚酞、乙醇、氯化氢、氯化钠(均为国产分析纯);L-8900 全自动氨基酸分析仪(日立高新技术公司),X1R 冷冻离心机、Multiskan GO 多功能读数仪(美国Thermo 公司)。
1.2 实验方法
1.2.1 藜麦蛋白提取工艺流程 藜麦→除皂苷→干燥(50℃)→粉碎过筛(100 目)→正己烷脱脂→干燥(50℃)→藜麦粉加水→调pH 至碱性→适宜温度下浸提一段时间→离心(4 500 r/min,10 min)→上清液加盐酸调pH 至等电点→沉淀→水洗→离心→冷冻干燥→蛋白质干粉。
1.2.2 蛋白质提取率的测定 采用凯氏定氮法[5]分别测定藜麦粉中、藜麦提取液中的蛋白质含量,其公式如下:

1.2.3 单因素试验设计 藜麦蛋白质的基本提取条件:料液比1∶15,pH 为11,温度45℃,提取时间3 h。每个参数的变化如下:温度:25℃、30℃、35℃、40℃、45℃、50℃、55℃、60℃;料液比:1∶5、1∶10、1∶15、1∶20、1∶25、1∶30、1∶35、1∶40;pH:7.5、8.0、8.5、9.0、9.5、10.0、10.5、11.0、11.5、12;时间:0.5 h、1 h、1.5 h、2 h、2.5 h、3 h、3.5 h、4 h。
1.2.4 响应面试验设计 在单因素试验的基础上,分别确定各提取条件的自变量,采用响应面[6]设计,对藜麦蛋白的提取条件进行优化,其实验因素与水平见表1。
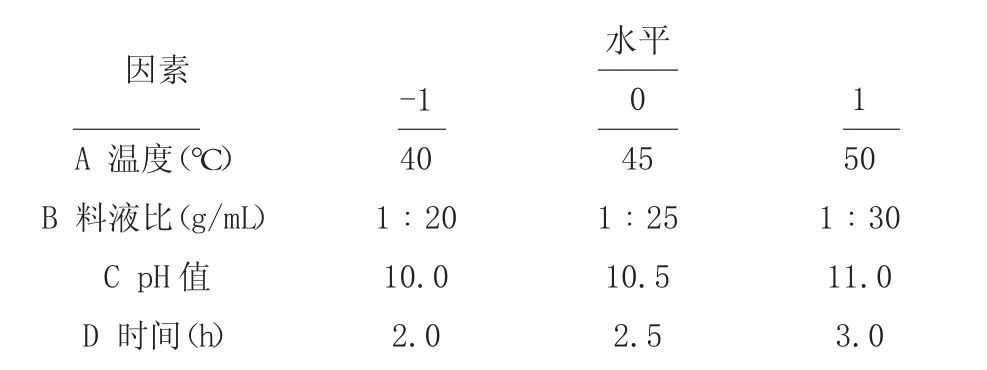
表1 响应面设计与因素水平
1.2.5 数据处理方法 所有实验均重复3 次,实验结果用±s 表示,用Origin 2018 和Design-Expert 8.0 软件进行实验数据的分析和图表制作。
2 结果与分析
2.1 藜麦蛋白质提取的单因素试验
2.1.1 温度对藜麦蛋白质提取率的影响 由图1 可知,蛋白质提取率随温度升高先增大后减小,在45℃时蛋白质提取率最大。因温度小幅度升高,使蛋白质溶解度增大,因碱性条件会促进藜麦淀粉的糊化[7],所以当温度继续升高时,藜麦淀粉颗粒吸水膨胀甚至发生糊化,使体系黏稠,不利于蛋白质的溶出,同时温度升高会引起部分蛋白质变性,影响了藜麦蛋白的溶解性,从而使提取率下降。与袁诗涵等[8]研究不同,他们从黄米中提取的蛋白质,发现随温度的升高,黄米蛋白提取率呈现先降低后增加的趋势,但变化幅度较小。主要是由于黄米中耐热蛋白质含量较多,其耐热蛋白质会随着温度升高而溶出量增大,导致提取率增加。
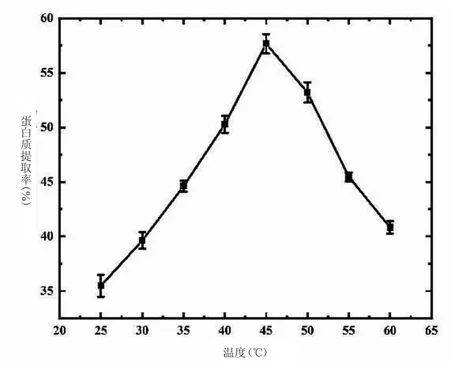
图1 温度对藜麦蛋白质提取率的影响
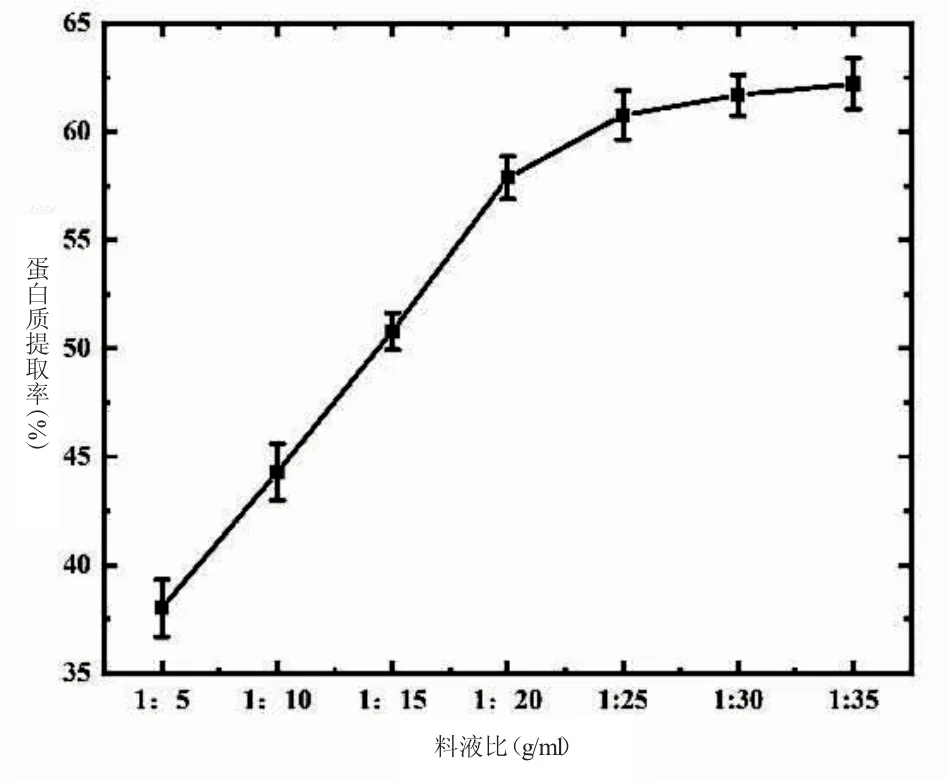
图2 料液比对藜麦蛋白质提取率的影响
2.1.2 料液比对藜麦蛋白质提取率的影响 由图2可知,当料液比从1∶5 上升至1∶30 时,藜麦蛋白的提取率不断升高,当料液比达到1∶25 之后,提取率比变化不大。这与高丹丹等[9]的研究结果一致,他们从棉籽中提取蛋白质,提取率随料液比的增大而升高,当到达1∶25 后,其提取率虽然升高,但基本趋于稳定,且料液比太大会使产品成本增加,加大后续处理的负担,因此本研究选取料液比1∶25 进行蛋白质提取。
2.1.3 pH 值对藜麦蛋白质提取率的影响 由图3可知,蛋白质提取率随pH 增加而增大,当增至11时,其提取率达到最大,比pH 为7.5 时高34.71%。碱性环境会对蛋白质的次级键产生破坏作用,发生酸式解离,使分子表面带相同电荷,从而使蛋白质溶出量增加,这种增溶作用随pH 的升高而增大[10]。综上,pH 选取在11 为宜。
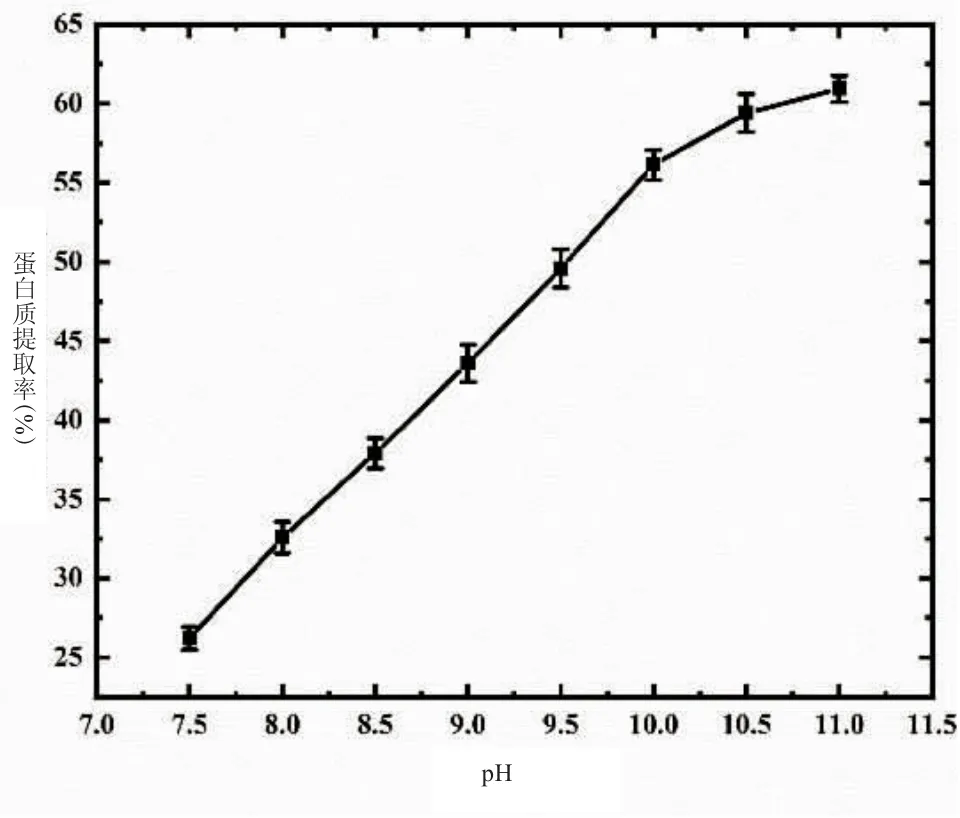
图3 pH 值对藜麦蛋白质提取率的影响
2.1.4 提取时间对藜麦蛋白质的影响 由图4 可知,蛋白质提取率随时间的延长而不断增加,在0.5~2.0 h 提取率升高变化较大,2.0 h 之后提取率增加趋势缓慢,且随着时间的延长,所需耗能增加,生产成本与周期增大,故选择时间范围为3.0 h。赵东霞等[11]从大豆中提取水溶性蛋白质,其提取率随时间的增加先增大后减小,其研究结果与本研究略有不同,主要是由于水溶性蛋白的增加使溶出量达到动态平衡,因此出现提取率降低的状态。
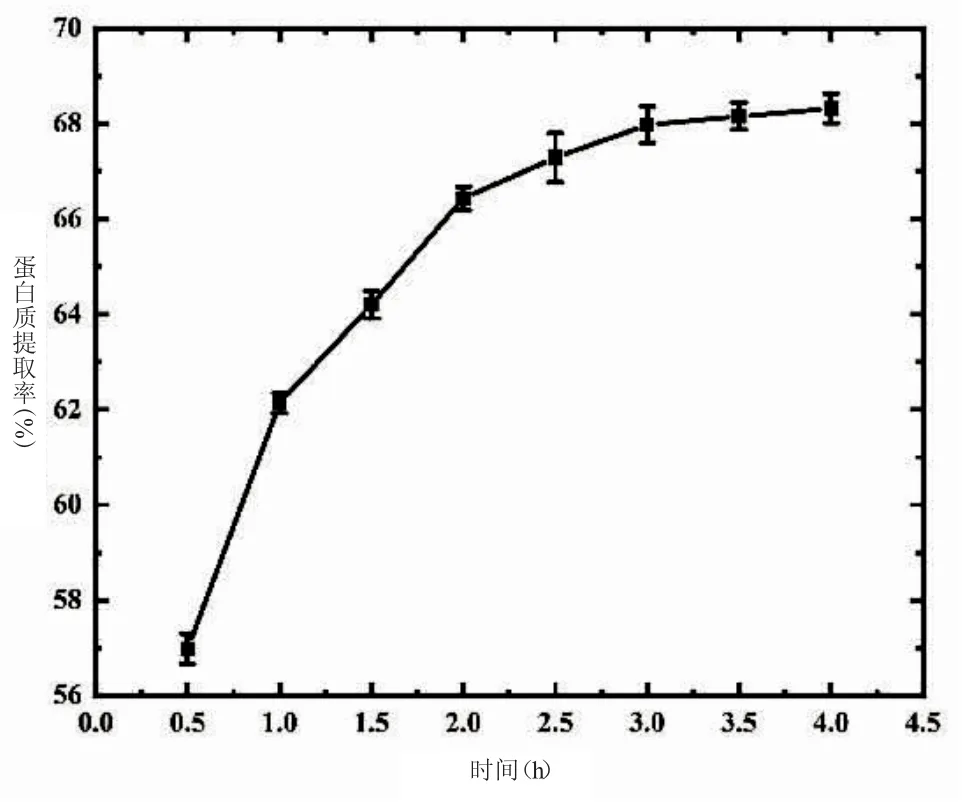
图4 提取时间对藜麦蛋白质的影响
2.2 响应面优化实验结果
2.2.1 回归模型的建立及显著性分析 在单因素试验结果基础上,其响应面分析试验根据Box-Benhnken原理设计了29 组试验,其响应面分析试验设计及结果见表2。
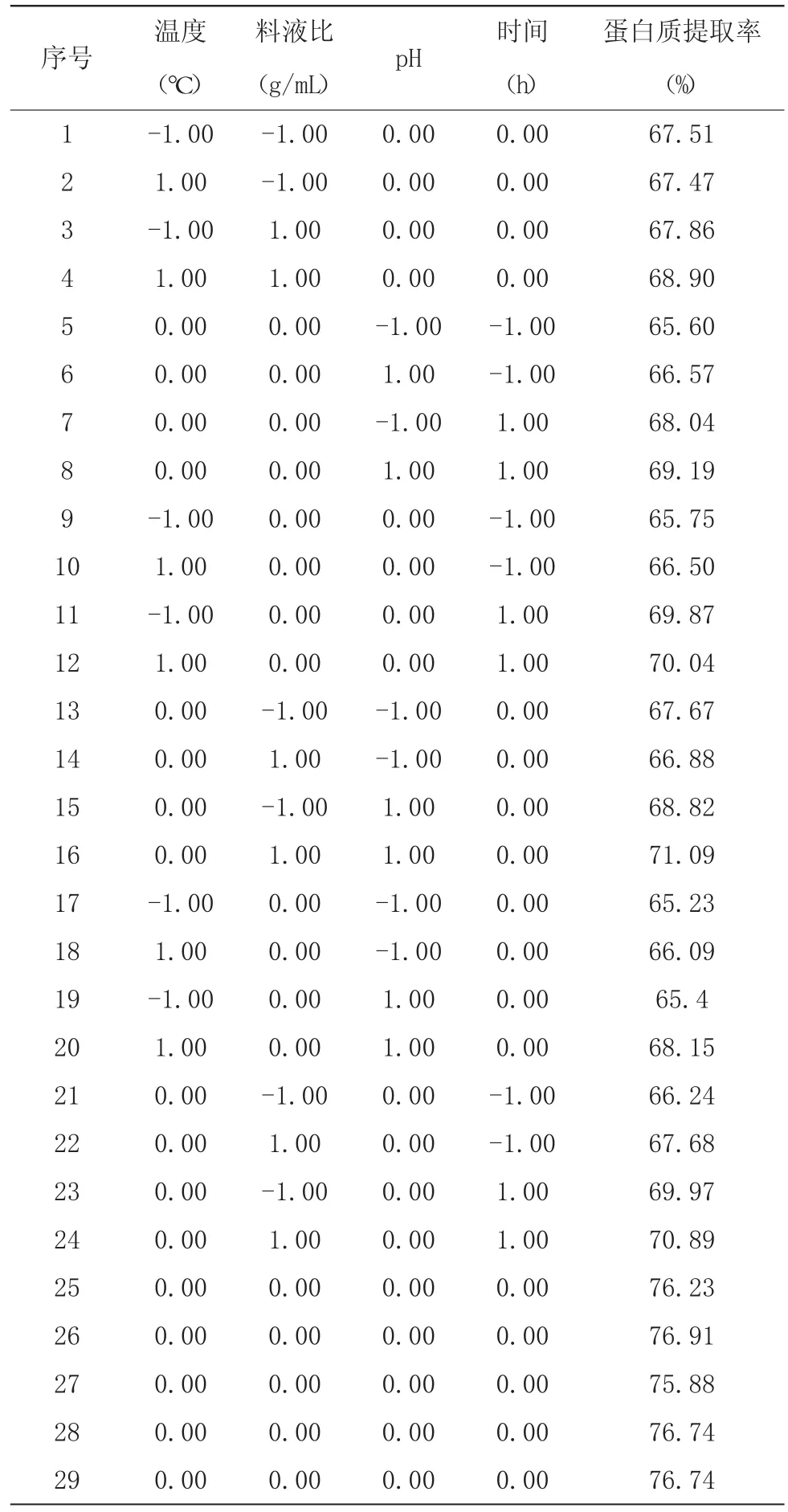
表2 Box-Benhnken 响应面试验设计及结果
利用响应面软件对表2 结果进行回归分析,对温度(A)、料液比(B)、pH(C)、时间(D)等4 个因素进行回归拟合,得到回归方程(Y 代表蛋白质提取率):Y=76.50+0.46 A+0.47 B+0.81 C+1.64 D+0.27 AB+0.47 AC-0.15 AD+0.77 BC-0.13 BD+0.045 CD-4.96 A2-3.44 B2-4.97 C2-4.02 D2。
其实验模型显著性分析见表3。模型F 值为47.11(P<0.000 1),说明回归模型是极显著的。B、C、D、A2、B2、C2、D2的P 值均小于0.05,说明这些是显著的模拟项。由表3 可知,各因素对藜麦蛋白质提取率的影响顺序为时间>pH>料液比>温度。该模型的R2值是0.979 2,表明模型充分拟合试验数据,说明该模型建立的回归方程能够较好地预测藜麦蛋白质提取工艺。
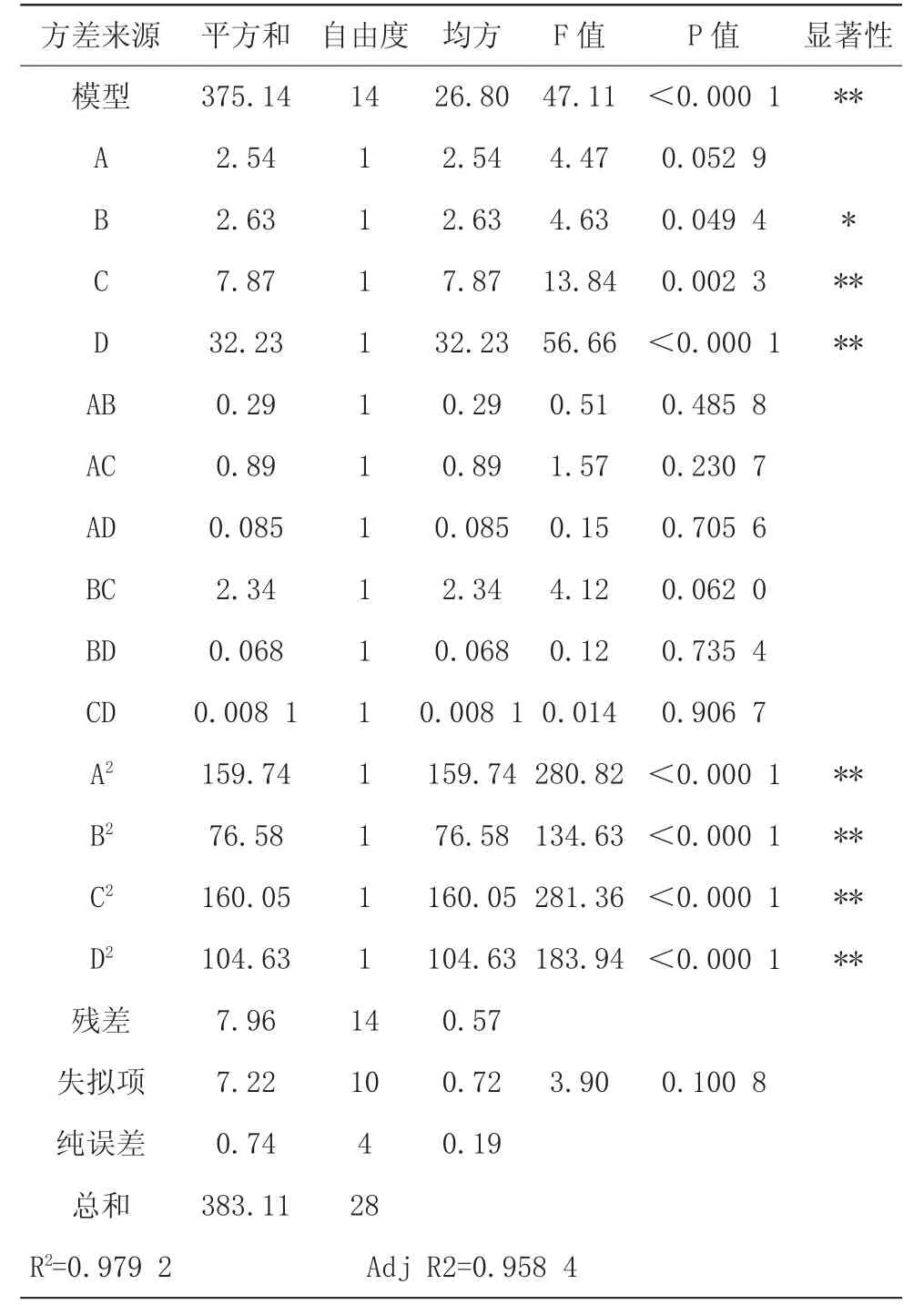
表3 方差分析结果
2.2.2 响应面交互作用分析 自变量与响应值之间的二维等高线和三维曲面图如图5 所示。
在2 个变量变化,另一个变量保持在中间水平不变的情况下,考察交互项对提取率的影响,评价自变量对藜麦蛋白提取率影响的交互作用。在3D 图中,图形的坡度表明响应指标对响应因素的敏感度。由图5 中可看出,随料液比和pH 的增大,蛋白提取率先增大后降低,说明试验范围内存在藜麦蛋白质提取的最佳条件,当低于或高于该条件,都会影响蛋白提取率。同样对于料液比、提取温度、pH、提取时间各因素两两交互影响条件中均存在最佳提取条件。说明试验所选择因素水平范围中存在最优蛋白提取条件组合,使得藜麦蛋白的提取效果达到最优。
2.2.3 模型验证实验结果 根据响应面软件分析结果,获得藜麦蛋白提取率最高时的各因素最佳反应条件为温度为45℃,料液比为1∶25 g/ml,pH 为10.5,时间为2.5 h,在此条件下,藜麦蛋白提取率为76.50%,为验证模型预测的可信度,在此最佳反应条件下进行3 次重复实验,测得蛋白提取率为76.69%,76.87%,76.95%,平均值为(76.84±0.11)%,该实测值与理论值的误差小于±1%,由此可见该模型能较好地预测实际的藜麦蛋白提取率的情况。
3 结论
采用响应面分析法建立了藜麦蛋白提取的二次方程,显著性分析得到影响藜麦蛋白提取率的因素依次为时间>pH>料液比>温度;确定了藜麦蛋白的最佳提取条件:温度为45℃,液料比为1∶25 g/ml,pH为10.5,提取时间为2.5 h,且此条件下蛋白质最大提取率为(76.84±0.11)%,与理论值较为接近,表明响应面预测的数学模型对其工艺优化具有可行性。然而关于藜麦蛋白的营养安全和加工工艺特性还有待深入研究。藜麦作为一种优质蛋白,研究其提取工艺可为藜麦蛋白质的开发应用提供理论依据,还可以通过酶法改性扩大其应用范围,充分挖掘其潜在的商业价值,以满足消费需求。
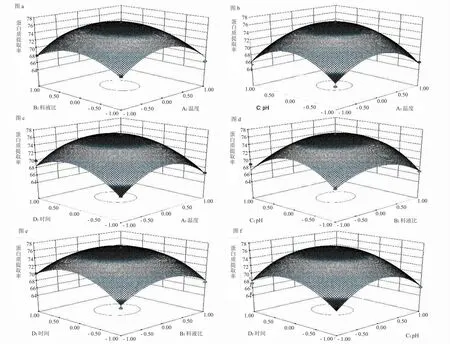
图5 各因素交互作用对藜麦蛋白质提取率的影响
