灵芝多糖对脓毒症急性肺损伤大鼠肺功能及TLR4/NF-κB通路的影响
2021-04-23李凤芝张小红
黄 晗,李凤芝,李 杨,张小红
灵芝多糖对脓毒症急性肺损伤大鼠肺功能及TLR4/NF-κB通路的影响
黄 晗,李凤芝,李 杨,张小红*
郑州大学附属郑州中心医院 呼吸与危重症医学科,河南 郑州 450000
探究灵芝多糖对盲肠结扎穿孔导致的脓毒症急性肺损伤大鼠肺功能及肺组织炎症的影响。SD大鼠随机分成对照组、模型组及灵芝多糖低、中、高剂量(50、100、200 mg/kg)组和乌司他丁组,除对照组外,其余各组大鼠均采用盲肠结扎穿孔法制备脓毒症模型。给予灵芝多糖和乌司他丁进行干预,采用全自动血气分析仪检测大鼠O2分压[(O2)]和CO2分压[(CO2)];取大鼠右肺中叶计算肺组织湿/干质量;采用ELISA法检测大鼠肺泡灌洗液中白细胞介素-6(interleukin-6,IL-6)、IL-1β、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)和核因子-κB(nuclear factor-κB,NF-κB)水平;采用苏木素-伊红(HE)染色法检测大鼠肺组织病理变化;采用Western blotting法检测大鼠肺脏组织中Toll样受体4(toll like receptor 4,TLR4)、p65、磷酸化p65(p-p65)蛋白表达水平。与对照组比较,模型组大鼠肺组织结构破坏,肺泡间隔明显增厚,有大量炎性细胞浸润,肺组织炎症评分显著升高(<0.05);肺组织湿质量/干质量显著升高(<0.05);(CO2) 显著升高(<0.05),(O2) 显著降低(<0.05);肺泡灌洗液中IL-6、IL-1β、TNF-α和NF-κB水平均显著升高(<0.05);肺组织TLR4和p-p65/p65蛋白表达水平显著升高(<0.05)。与模型组比较,灵芝多糖组大鼠肺组织损伤减轻,肺泡完整性较好,炎症细胞浸润减少,肺组织炎症评分显著降低(<0.05);肺组织湿质量/干质量显著降低(<0.05);(CO2)显著降低(<0.05),(O2) 显著升高(<0.05);肺泡灌洗液中IL-6、IL-1β、TNF-α和NF-κB水平均显著降低(<0.05);肺组织TLR4和p-p65/p65蛋白表达水平显著降低(<0.05),呈剂量相关性。灵芝多糖能够通过抑制TLR4/NF-κB信号通路,从而减轻脓毒症大鼠炎症反应并保护肺功能。
灵芝多糖;脓毒症;炎症反应;Toll样受体4;核因子-κB
脓毒症是感染引起的全身性炎症反应综合征,患者严重时会出现器官功能障碍[1]。肺脏是脓毒症患者最易受到损伤的器官之一。脓毒症可以引起急性肺损伤(acute lung injury,ALI),肺组织中大量炎性细胞浸润,免疫炎症反应失衡[2-4]。Toll样受体4(toll like receptors 4,TLR4)为Toll样受体亚型之一,可通过促进其下游靶点核因子-κB(nuclear factor-κB,NF-κB)磷酸化活化,介导炎症反应。研究发现,抑制TLR4/NF-κB信号通路可减轻炎症反应,改善脓毒症肺损伤[5]。灵芝多糖是灵芝的主要活性成分之一,具有免疫调节、抗氧化、抗病毒、抗炎等作用[6-7]。灵芝多糖可通过抑制ApoE−/−动脉粥样硬化小鼠TLR4/NF-κB信号通路,发挥调血脂作用[8]。本研究采用盲肠结扎穿孔法制备大鼠脓毒症模型,观察灵芝多糖对脓毒症大鼠肺功能的影响,并探讨其对TLR4/NF-κB信号通路的影响,以期为其治疗脓毒症提供依据。
1 材料
1.1 动物
SPF级SD大鼠60只,雌雄各半,6周龄,体质量200~220 g,购自浙江中医药大学,许可证号SYXK(浙)2019-0024。动物于郑州大学附属郑州市中心医院动物房适应性饲养1周,通风良好、温度25 ℃、相对湿度50%。动物实验经郑州大学附属郑州中心医院动物伦理委员会批准(批准号ZZCH-LL-2020072402)。
1.2 药品与试剂
乌司他丁注射液(5×104U/mL)购自广东天普生化医药股份有限公司;灵芝多糖对照品(质量分数≥90%,批号180516)、白细胞介素-6(interleukin-6,IL-6)试剂盒(批号190118)、IL-1β试剂盒(批号180925)、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)试剂盒、NF-κB试剂盒购自北京索莱宝生物技术有限公司;TLR4抗体、p65抗体、p-p65抗体、β-actin抗体、羊抗兔IgG抗体购自美国Abcam公司;苏木素-伊红(HE)染色试剂盒、BCA蛋白定量试剂盒购自上海碧云天生物技术有限公司。
1.3 仪器
GEM3500型全自动血气分析仪(美国沃芬有限公司);GL224/224i-1SCN型电子天平(德国赛多利斯公司);MK3 Multiskan型酶标仪(美国Thermo Fisher Scientific公司);DYCZ-25D型蛋白电泳仪(北京六一仪器厂);光学显微镜(日本Nikon公司);无创肺功能仪(法国EMKA公司)。
2 方法
2.1 脓毒症模型的制备
随机选取12只SD大鼠作为对照组,其余大鼠采用盲肠结扎穿孔法[9]制备脓毒症模型。大鼠ip 1.0%戊巴比妥钠(20 mg/kg)麻醉,仰卧位固定,腹部消毒脱毛,沿正中腹白线切开皮肤,打开腹腔,找出盲肠,结扎盲肠末端和回盲瓣中间部位,使用18号针头在盲肠结扎处做2处穿刺,轻轻挤压盲肠,挤出部分肠内容物至腹腔,盲肠放入腹腔,逐层缝合,关闭腹腔。术后,大鼠sc生理盐水(30 mL/kg)进行液体复苏。对照组大鼠仅打开腹腔,游离盲肠,不结扎穿孔。脓毒症大鼠模型制备成功后,检测大鼠肺功能相关指标如潮气量(tidal volume,T)、呼气峰流量(peak expiratory flow,PET),保证脓毒症大鼠模型造成了大鼠肺功能损伤。
2.2 分组与给药
按照文献方法[10-11],将脓毒症模型大鼠随机分为模型组及灵芝多糖低、中、高剂量(50、100、200 mg/kg)组和乌司他丁组,每组12只。灵芝多糖溶于生理盐水配制成质量浓度为0.5、1.0、2.0 g/mL的溶液。灵芝多糖组大鼠ig相应药物,乌司他丁组大鼠ip药物(3 mL/kg),对照组和模型组大鼠ig等体积生理盐水,1次/d,连续14 d。
2.3 灵芝多糖对脓毒症大鼠肺组织湿质量/干质量的影响
大鼠处死后,完整摘除肺组织。取大鼠右肺中叶,吸干表面水分,称定湿质量,于60 ℃烘箱中烘干48 h,称定干质量,计算肺组织湿质量/干质量。
2.4 灵芝多糖对脓毒症大鼠O2分压[p(O2)]和CO2分压[p(CO2)]的影响
末次给药24 h后,大鼠麻醉处死,颈总动脉取血并加入肝素抗凝,使用全自动血气分析仪检测(O2) 和(CO2)。
2.5 灵芝多糖对脓毒症大鼠肺泡灌洗液中炎症因子水平的影响
大鼠处死后,打开胸腔,结扎右侧肺部,在近头端气管位置,将预冷生理盐水缓慢注入大鼠左侧肺泡内,然后缓慢抽出,重复3次,将收集的肺泡灌洗液离心取上清,于−80 ℃保存。按照ELISA试剂盒说明书检测各组大鼠肺泡灌洗液中IL-6、IL-1β、TNF-α和NF-κB水平。
2.6 灵芝多糖对脓毒症大鼠肺组织病理变化的影响
取大鼠右肺组织,于4%多聚甲醛中固定,脱水透明、浸蜡包埋、切片后,进行HE染色,于显微镜下观察肺组织病理变化,并对淋巴细胞、中性粒细胞和巨噬细胞等炎性细胞浸润程度进行评分。评分标准:0分为无炎性细胞浸润;3分为部分炎性细胞浸润;5分为大量炎性细胞弥漫性浸润。
2.7 灵芝多糖对脓毒症大鼠肺组织TLR4/NF-κB通路相关蛋白表达的影响
取大鼠右肺组织,加入预冷的含蛋白酶抑制剂的裂解液,研磨混匀,离心取上清,采用BCA蛋白定量试剂盒测定蛋白质量浓度。蛋白样品经十二烷基硫酸钠-聚丙烯酰胺凝胶电泳,转至PVDF膜,加入脱脂牛奶封闭2 h;分别加入TLR4、p65、p-p65、β-actin抗体(1∶1000),孵育过夜,洗涤后加入羊抗兔IgG抗体,室温孵育2 h,洗涤后加入显影液,拍照并观察。
2.8 统计学分析
3 结果
3.1 灵芝多糖对脓毒症大鼠肺组织湿质量/干质量的影响
如表1所示,与对照组比较,模型组大鼠肺组织湿质量/干质量显著升高(<0.05);与模型组比较,灵芝多糖组大鼠肺组织湿质量/干质量明显降低(<0.05),呈剂量相关性。
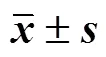
表1 灵芝多糖对脓毒症大鼠肺组织湿质量/干质量的影响(, n = 12)
与对照组比较:#<0.05;与模型组比较:*<0.05;与灵芝多糖50 mg/kg组比较:▲<0.05;与灵芝多糖100 mg/kg组比较:■<0.05,下表同
#< 0.05control group;*< 0.05model group;▲< 0.05polysaccharide 50 mg/kg group;■< 0.05polysaccharide 100 mg/kg group, same as below tables
3.2 灵芝多糖对脓毒症大鼠p(O2) 和p(CO2) 的影响
如表2所示,与对照组比较,模型组大鼠(O2) 显著降低(<0.05)、(CO2) 显著升高(<0.05);与模型组比较,灵芝多糖组大鼠(O2) 显著升高(<0.05)、(CO2) 显著降低(<0.05),呈剂量相关性。
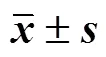
表2 灵芝多糖对脓毒症大鼠p(O2)和p(CO2)的影响(, n = 12)
1 mm Hg=133 Pa
3.3 灵芝多糖对脓毒症大鼠肺泡灌洗液中炎症因子水平的影响
如表3所示,与对照组比较,模型组大鼠肺泡灌洗液中IL-6、IL-1β、TNF-α和NF-κB水平均显著升高(<0.05);与模型组比较,灵芝多糖组大鼠肺泡灌洗液中IL-6、IL-1β、TNF-α和NF-κB水平均显著降低(<0.05),呈剂量相关性。
3.4 灵芝多糖对脓毒症大鼠肺组织病理变化的影响
如图1所示,对照组大鼠肺组织形态结构完整,肺泡结构清晰且间隔均一,无炎性细胞浸润;模型组大鼠肺组织结构破坏,肺泡间隔明显增厚,肺间质水肿,可见大量炎性细胞浸润;各给药组大鼠肺组织损伤较模型组减轻,肺泡完整性较好,炎症细胞浸润减少。
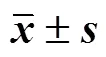
表3 灵芝多糖对脓毒症大鼠肺泡灌洗液中炎症因子水平的影响(, n = 12)
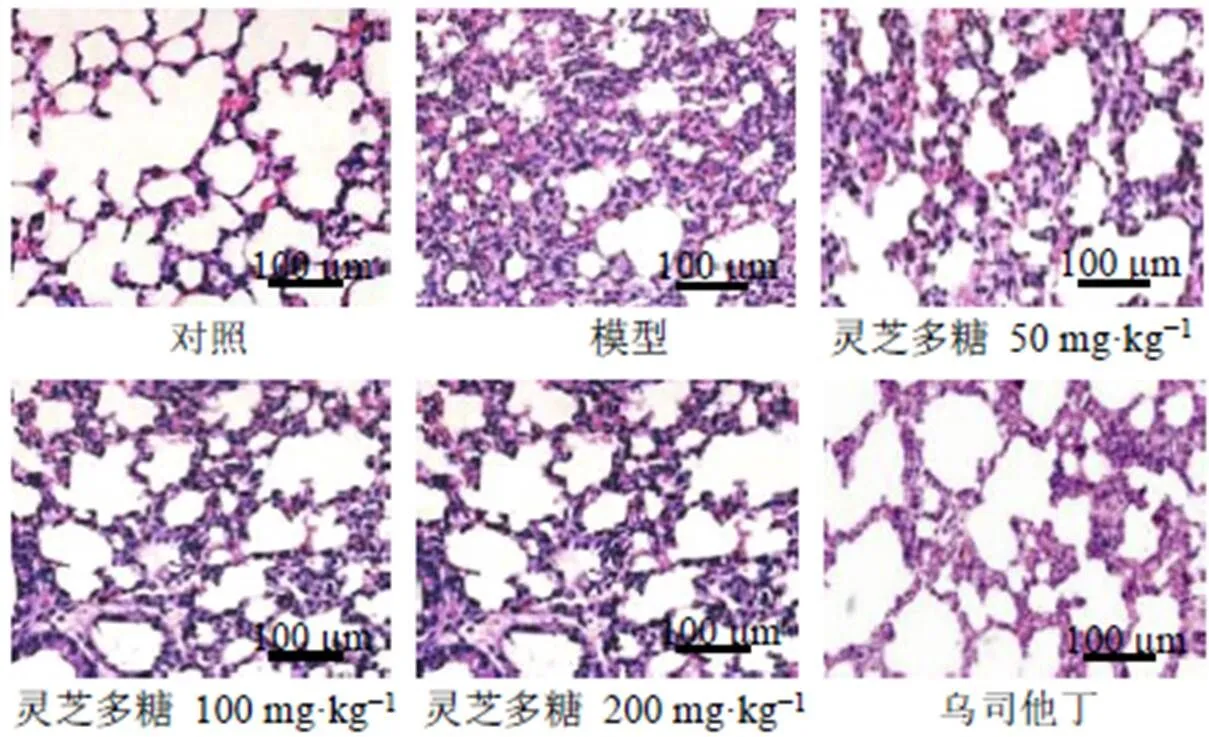
图1 灵芝多糖对脓毒症大鼠肺组织病理变化的影响(HE, ×200)
如表4所示,与对照组比较,模型组大鼠肺组织炎症评分显著升高(<0.05);与模型组比较,各给药组大鼠肺组织炎症评分显著降低(<0.05)。
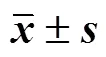
表4 灵芝多糖对脓毒症大鼠肺组织病理变化的影响(, n = 12)
3.5 灵芝多糖对脓毒症大鼠肺组织TLR4/NF-κB通路相关蛋白表达的影响
如图2和表5所示,与对照组比较,模型组大鼠肺组织TLR4、p-p65/p65蛋白表达水平显著升高(<0.05);与模型组比较,灵芝多糖组大鼠肺组织TLR4、p-p65/p65蛋白表达水平显著降低(<0.05),呈剂量相关性。

图2 灵芝多糖对脓毒症大鼠肺组织TLR4/NF-κB通路相关蛋白表达的影响
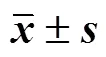
表5 灵芝多糖对脓毒症大鼠肺组织TLR4/NF-κB通路相关蛋白表达的影响(, n = 12)
4 讨论
脓毒症是由感染引起的全身反应,是潜在的致命并发症[12-14]。脓毒症早期表现为大量促炎细胞因子产生全身性炎症,先天免疫系统对细菌感染产生异常强烈反应[15]。脓毒症后期存在广泛的器官功能障碍,肺脏是其主要靶器官[16-17]。本研究采用盲肠结扎穿孔法建立脓毒症模型,发现大鼠肺组织结构破坏,肺泡间隔明显增厚,肺间质水肿,可见大量炎性细胞浸润,肺组织炎症评分、肺组织湿/干质量显著升高,肺泡灌洗液中IL-6、IL-1β、TNF-α和NF-κB水平显著升高,(CO2) 显著升高,(O2) 显著降低,表明模型组大鼠肺组织严重破坏,炎症反应强烈,肺功能障碍,脓毒症模型建立成功。
灵芝是我国传统中药,常用于扶正固本、增强身体抵抗能力[8]。灵芝多糖作为灵芝的主要有效成分,可抑制炎症反应、缓解机体损伤[18]。灵芝多糖可通过抑制肝脏组织Nod样受体蛋白3(Nod-like receptor pyrin domain3,NLRP3)炎性小体相关蛋白表达,减轻急性酒精性肝损伤小鼠的炎症反应,有效缓解肝组织损伤并恢复肝功能[19]。本研究结果显示,灵芝多糖组大鼠肺组织损伤减轻,肺泡完整性较好,炎症细胞浸润减少,肺组织湿/干质量、(CO2)降低,(O2) 升高,表明灵芝多糖能够改善脓毒症大鼠肺损伤,保护肺功能。灵芝多糖可显著降低脑组织中TNF-α、IL-1β和IL-6水平,减轻大鼠脑缺血再灌注继发的炎症反应[20]。本研究结果显示,灵芝多糖组大鼠肺组织炎症评分显著降低,肺泡灌洗液中IL-6、IL-1β、TNF-α和NF-κB水平均显著降低,且呈剂量相关性,表明灵芝多糖可通过抑制炎症反应,保护脓毒症大鼠肺组织。
研究表明,TLR4/NF-κB信号通路参与脓毒症大鼠炎症反应,姜黄素和升降散可通过抑制TLR4/NF-κB信号通路,减轻脓毒症大鼠的肠损伤炎症反应和心肌损害[21-22];紫杉醇可通过抑制TLR4/NF-κB信号通路,减轻脓毒症小鼠的急性肺损伤[23]。本研究结果显示,模型组大鼠肺组织中TLR4、p-p65/p65蛋白表达水平显著升高,表明脓毒症大鼠肺组织的炎症反应和肺损伤可能与TLR4/NF-κB信号通路活化有关。羧甲基化灵芝多糖可抑制脑缺血再灌注小鼠脑组织中NF-κB表达,从而减轻炎症反应[20]。本研究结果显示,灵芝多糖组大鼠肺组织中TLR4和p-p65/p65蛋白表达水平显著降低,且呈剂量相关性,表明灵芝多糖可能通过抑制TLR4/NF-κB信号通路,减轻脓毒症大鼠炎症反应。综上所述,灵芝多糖能够通过抑制TLR4/ NF-κB信号通路,从而抑制脓毒症大鼠炎症反应并保护肺脏功能。
利益冲突 所有作者均声明不存在利益冲突
[1] Evans T. Diagnosis and management of sepsis [J]., 2018, 18(2): 146-149.
[2] Hecker A, Reichert M, Reuß C J,. Intra-abdominal sepsis: New definitions and current clinical standards [J]., 2019, 404(3): 257-271.
[3] 徐媛, 许涛. 微小RNA-181b在脓毒症急性肺损伤大鼠的表达及其机制 [J]. 中华实验外科杂志, 2018, 35(10): 1811-1813.
[4] 田婧, 王桂平, 于泳浩, 等. 脓毒症小鼠肺损伤时PI3K/Akt信号通路与HO-1表达的关系 [J]. 中华麻醉学杂志, 2020, 40(2): 242-245.
[5] 袁园, 吴晓东, 龙安予. 熊果酸对脓毒症模型大鼠肺损伤的保护作用及对HMGB1/TLR4/NF-κB通路的影响 [J]. 中医学报, 2019, 34(3): 555-558.
[6] Cör D, Knez Ž, Knez Hrnčič M. Antitumour, antimicrobial, antioxidant and antiacetylcholinesterase effect ofterpenoids and polysaccharides: A review [J]., 2018, 23(3): 649.
[7] 肖玉焕, 韩丽, 李浩然, 等. 灵芝多糖防治中枢神经系统疾病的研究进展 [J]. 中草药, 2020, 51(24): 6391-6395.
[8] 杨燕燕, 谢金东, 周建华, 等. 灵芝多糖对ApoE−/−动脉粥样硬化小鼠TLR4/NF-κB信号通路的影响 [J]. 中国中医基础医学杂志, 2019, 25(1): 56-59.
[9] 李云鹏, 杨玉丹, 郭胜存, 等. 萝卜硫素对脓毒症小鼠心肌损伤的保护作用及机制研究 [J]. 中国药理学通报, 2020, 36(8): 1106-1110.
[10] 马静, 芮海波, 陈全战, 等. 灵芝多糖对链脲佐菌素诱导的糖尿病肾病小鼠抗炎活性及疗效研究 [J]. 南京医科大学学报: 自然科学版, 2019, 39(3): 326-331.
[11] 赵锋利, 王澍欣, 罗苑苑, 等. 调胃承气汤对肠源性脓毒症大鼠免疫功能的影响 [J]. 中国医药导报, 2019, 16(17): 18-22.
[12] Huang M, Cai S L, Su J Q. The pathogenesis of sepsis and potential therapeutic targets [J]., 2019, 20(21): 5376.
[13] Cecconi M, Evans L, Levy M,. Sepsis and septic shock [J]., 2018, 392(10141):75-87.
[14] Jain S. Sepsis: An update on current practices in diagnosis and management [J]., 2018, 356(3): 277-286.
[15] Opal S M, Wittebole X. Biomarkers of infection and[J]., 2020, 36(1): 11-22.
[16] Pool R, Gomez H, Kellum J A. Mechanisms of organ dysfunction in sepsis [J]., 2018, 34(1): 63-80.
[17] 章静, 杨成伟, 王云, 等. 香菇多糖对脓毒症小鼠急性肺损伤的保护作用 [J]. 中华医院感染学杂志, 2018, 28(10): 1463-1468.
[18] 陈玉胜, 陈全战. 灵芝多糖对CCl4诱导的急性肝损伤小鼠的抗炎和保肝活性 [J]. 食品科学, 2017, 38(17): 210-215.
[19] 孙艳辉, 张宏波. 灵芝多糖对急性酒精性肝损伤小鼠肝脏脂肪沉积及NLRP3炎性小体表达的影响 [J]. 世界中医药, 2020, 15(6): 842-845.
[20] 李亚巍, 陈丽红, 韩丽琴, 等. 羧甲基化灵芝多糖预处理对大鼠脑缺血再灌注损伤的影响及其机制 [J]. 山东医药, 2018, 58(4): 12-16.
[21] 张永虎, 张丹霞, 曾良. 姜黄素通过TLR-4/NF-κB信号通路减轻脓毒症相关的急性肠损伤 [J]. 实用医学杂志, 2020, 36(6): 735-740.
[22] 王蠡, 张珏, 钱风华, 等. 升降散调控TLR-4/NF-κB信号通路对脂多糖诱导脓毒症大鼠心肌损伤的影响 [J]. 上海中医药杂志, 2018, 52(10): 82-86.
[23] Wang Y M, Ji R, Chen W W,. Paclitaxel alleviated sepsis-induced acute lung injury by activating MUC1and suppressing TLR-4/NF-κB pathway [J]., 2019, 13: 3391-3404.
Effect ofpolysaccharides on lung function and TLR4/NF-κB pathway in sepsis rats with acute lung injury
HUANG Han, LI Feng-zhi, LI Yang, ZHANG Xiao-hong
Department of Respiratory and Critical Care Medicine, Zhengzhou Central Hospital Affiliated to Zhengzhou University, Zhengzhou 450000, China
To explore the effect ofpolysaccharides (GLP) on lung function and lung tissue inflammation in rats with septic acute lung injury caused by cecal ligation and perforation.SD rats were randomly divided into control group, model group, low-, medium-, high-dose (50, 100, 200 mg/kg) GLP groups and ulinastatin group. Except for rats in control group, rats in the other groups were used to establish sepsis model by cecal ligation and perforation method. GLP and ulinastatin were given to intervene, and(O2) and(CO2) of rats were detected by automatic blood gas analyzer; Middle lobe of the right lung of rats was taken to calculate the wet/dry weight of lung tissue; Levels of interleukin-6 (IL-6), IL-1β, tumor necrosis factor-α (TNF-α) and nuclear factor-κB (NF-κB) in alveolar lavage fluid of rats were detected by ELISA; Hematoxylin-eosin (HE) staining was used to detect pathological changes in rat lung tissue; Western blotting was used to detect expressions of toll like receptor 4 (TLR4), p65, and phosphorylated p65 (p-p65) in lung tissue of rats.Compared with control group, lung tissue structure of rats in model group was destroyed, the alveolar compartment was significantly thickened, with a large number of inflammatory cells infiltration, and the lung tissue inflammation score was significantly increased (< 0.05); Wet/dry weight of lung tissue was significantly increased (< 0.05);(CO2) was significantly increased (< 0.05),(O2) was significantly decreased (< 0.05); IL-6, IL-1β, TNF-α and NF-κB levels in alveolar lavage fluid were significantly increased (< 0.05); Expressions of TLR4 and p-p65/p65 in lung tissue were significantly increased (< 0.05). Compared with model group, lung tissue damage of rats in GLP group was reduced, alveolar integrity was improved, inflammatory cell infiltration was reduced, lung inflammation scores was significantly reduced (< 0.05); Wet/dry weight of lung tissue was significantly reduced (< 0.05);(CO2) was significantly reduced (< 0.05),(O2) was significantly increased (< 0.05); IL-6, IL-1β, TNF-α and NF-κB levels in alveolar lavage fluid were significant decreased (< 0.05); Expressions of TLR4 and p-p65/p65 in lung tissue were significantly reduced (< 0.05), in a dose-dependent manner.GLP can inhibit TLR4/NF-κB signaling pathway, thereby reducing the inflammatory response in septic rats and protecting lung function.
polysaccharide; sepsis; inflammatory reaction; TLR4; NF-κB
R285.5
A
0253 - 2670(2021)08 - 2351 - 06
10.7501/j.issn.0253-2670.2021.08.018
2020-10-20
黄 晗,硕士研究生,主治医师,主要从事呼吸与危重症医学方面研究。E-mail: hh901238@163.com
张小红,硕士,副主任医师。E-mail: zhangxh1970@126.com
[责任编辑 李亚楠]
