中性粒细胞/淋巴细胞比值对胰腺癌放疗预后的评估
2021-04-23邸玉鹏孟玲玲任刚李宏奇常冬姝李平李晶康晓黎庞海峰王轩王颖杰夏廷毅
邸玉鹏,孟玲玲,任刚,李宏奇,常冬姝,李平,李晶,康晓黎,庞海峰,王轩,王颖杰,夏廷毅
1. 中国人民解放军空军特色医学中心 放疗科,北京 100142;2. 中国人民解放军总医院 放射治疗科,北京 100853
引言
研究发现,胰腺癌治疗效果差,80%~90%的胰腺癌就诊时已无法手术切除[1]。幸而,立体定向放射治疗胰腺癌可显著提高肿瘤局部控制率,延长患者生存时间[2-3]。其中,外周血的中性粒细胞与淋巴细胞比值(Neutrophil to Lymphocyte Ratio,NLR)作为机体炎性反应指标,便捷有效,已被广泛用于多种恶性肿瘤的预后研究[4],但是关于NLR在胰腺癌放疗中的预后价值研究极少,本研究探讨NLR在胰腺癌放疗中的预后价值,为胰腺癌个体化治疗提供参考。
1 材料与方法
1.1 临床资料
1.1.1 纳入标准
纳入标准:① 经组织学或细胞学病理确诊;若无病理诊断,需有临床诊断(黄疸、腹胀/痛及消瘦三个症状中的1项或以上;血清CA19-9明显增高或动态增高超过正常值上线;内科常规治疗无效)、影像学诊断(CT诊断胰腺肿块,并经3期CT、PET/CT及核磁三项检查中至少两项确认)、多学科会诊确诊;② 确诊前后7 d内有完整的血常规报告者;③ 采用2010年胰腺癌UICC/AJCC TNM分期系统[5];④ 体力状态KPS评分≥60分;能平卧至少30 min者;⑤ 诊疗资料及随访资料完整并签订知情同意书。
1.1.2 排除标准
排除标准:① 既往接受胰腺癌局部放疗或系统治疗;② 治疗前存在感染;③ 治疗前合并有其他系统疾病,如心脑肾脏疾病者;④ 曾患有其他恶性肿瘤;⑤ 自身免疫相关性疾病;⑥ 怀孕、哺乳期妇女。
1.1.3 剔除标准
剔除标准:① 无法控制的肠道梗阻或胃十二指肠溃疡及出血;② 失访病例;③ 不可控制的腹水、治疗过程中疾病急速进展。
1.2 外周血NLR检测
在放疗前1周内,抽取患者末梢血或静脉血,血RT检测由中心临床检验科负责。根据血常规中中性粒细胞计数绝对值及淋巴细胞计数绝对值,计算得到NLR。患者放疗前外周血白细胞总数均为正常水平,放疗前外周血NLR数值介于1.10~13.29,中位数2.92。
1.3 放疗方案
1.3.1 胃肠显影
患者需空腹口服碘帕醇稀释液行肠道显影准备(浓度3%,上海博莱科信药业有限责任公司,37 gI/100 mL),CT定位扫描前15 min顿服,无需憋尿。
1.3.2 模拟定位
患者需双手上举,仰卧位,采用热塑成型体网进行胸腹部固定,碘帕醇100 mL快速静脉注射,平静呼吸,行增强扫描,层厚4 mm,扫描范围:肝脏膈顶至双侧髂骨上棘。
1.3.3 勾画靶区
定位影像需上传至TPS系统,行靶区勾画,肿瘤靶区(Gross Tumor Volume,GTV)=原发肿瘤加周边转移淋巴结(GTVnd);临床靶区(Clinical Target Volume,CTV)即GTV三维空间外扩5 mm,包括GTV(原发灶、转移淋巴结),少部分患者在此基础上临床靶区也包括了未受侵及可疑受侵的区域淋巴结。计划靶区(Planning Target Volume,PTV)定义为CTV垂直轴位方向外扩10 mm,水平轴位方向外扩5 mm。危及器官:十二指肠、脊髓、胃、小肠、肝脏及双侧肾脏。
1.3.4 制定计划
在螺旋断层放疗计划系统中制定物理计划,GTV、CTV、PTV剂量分别为 65~70 Gy、60 Gy、50 Gy,分次15~20 F 完成。十二指肠 D10≤35 Gy,D5≤40 Gy,D3≤45 Gy,D1≤ 50 Gy;胃、 小 肠 D10≤ 40 Gy,D5≤ 45 Gy,D3≤50Gy,D1≤55 Gy;肾脏V20≤30 Gy;脊髓 D1≤40 Gy;肝脏 V30≤30 Gy。
1.4 随访及评价
所有患者均采用门诊就诊、科室专员定期随访等方式随诊,治疗后第1个月及第3个月随访,之后每3个月进行1次随访。总生存时间(Overall Survival,OS)指放疗第1 d到随访终点或患者死亡时间。比较不同临床参数患者中位生存时间(Median Survival Time,MST)。
1.5 统计学方法
统计分析采用SPSS 26.0软件。生存分析采用Kaplan-Meier法,用Log-rank法检验比较生存曲线差异。NLR临界值的判断采用ROC曲线,以灵敏度和特异度之和最高的NLR为截断值,P≤0.05为差异有统计学意义。
2 结果
2.1 治疗及随访结果
自2011年5月至2013年5月共收治III期胰腺癌患者41例,其中男性24例,女性17例;中位年龄为64岁(36~82岁)。放疗前CA19-9结果有5例在正常范围,其余在45.67到5169 U/mL之间,中位值292 U/mL。疗前KPS<80者13例,≥80者28例。19例行减黄术或改道手术。根据2002AJCC分期标准,临床或手术分期均为III期,有27例经细胞学或病理学证实,其中26例为腺癌,1例肉瘤样癌。截至观察日期2017年5月10日,均未失访,随诊时间4到54个月,中位生存时间12个月。
放射治疗均采用螺旋断层放疗,单纯放疗30例。11例接受同步放化疗(26.8%)。同步化疗方案:3例为吉西他滨注射液静脉滴注(600 mg/m2/周,1.0g/支);8例为口服替吉奥(75 mg/m2/d,用4周停2周),放疗第1天口服替吉奥胶囊(20 mg/粒)。治疗过程中根据病人的实验室检查结果及临床反应,及时给予升白细胞治疗、抑酸及止吐等对症处理。
放疗结束后29例患者行序贯化疗至少1周期(吉西他滨注射液、紫杉醇注射液、奥沙利铂注射液、替吉奥胶囊、卡培他滨片、顺铂注射液、卡铂注射液)。12例未行化疗患者中3例因腹胀、恶心等严重胃肠道反应拒绝化疗;5例因心肺功能不全拒绝化疗(冠心病、冠脉支架置入术后、肺功能不全等);4例因严重骨髓抑制、身体状况差,无法行序贯化疗。
2.2 不同临床参数患者MST比较治疗
依据ROC曲线(图1),选取NLR=2.86(敏感度94.1%,特异度83.3%)为分界值将患者分为高NLR组者21例,低NLR组者20例。Log-rank检验结果显示(图2):高NLR组MST(9个月)与低NLR组(21个月)比较差异有统计学意义(P<0.05)。
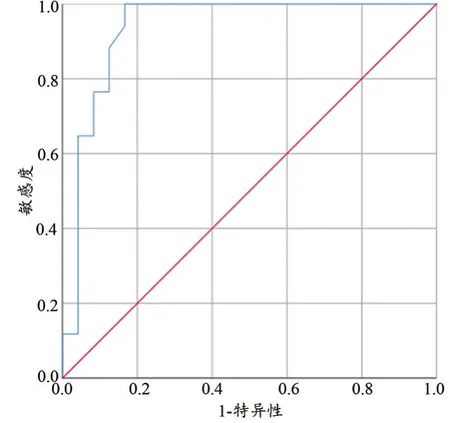
图1 ROC曲线确定NLR值

图2 放疗前不同NLR水平与胰腺癌患者中位生存时间的关系
两组患者的年龄、性别、KPS评分、放疗前是否行PTCD及支架减黄术、肿瘤位置、区域淋巴结转移有无、是否同步化疗、CA19-9水平差异无统计学意义(P>0.05),见表1。
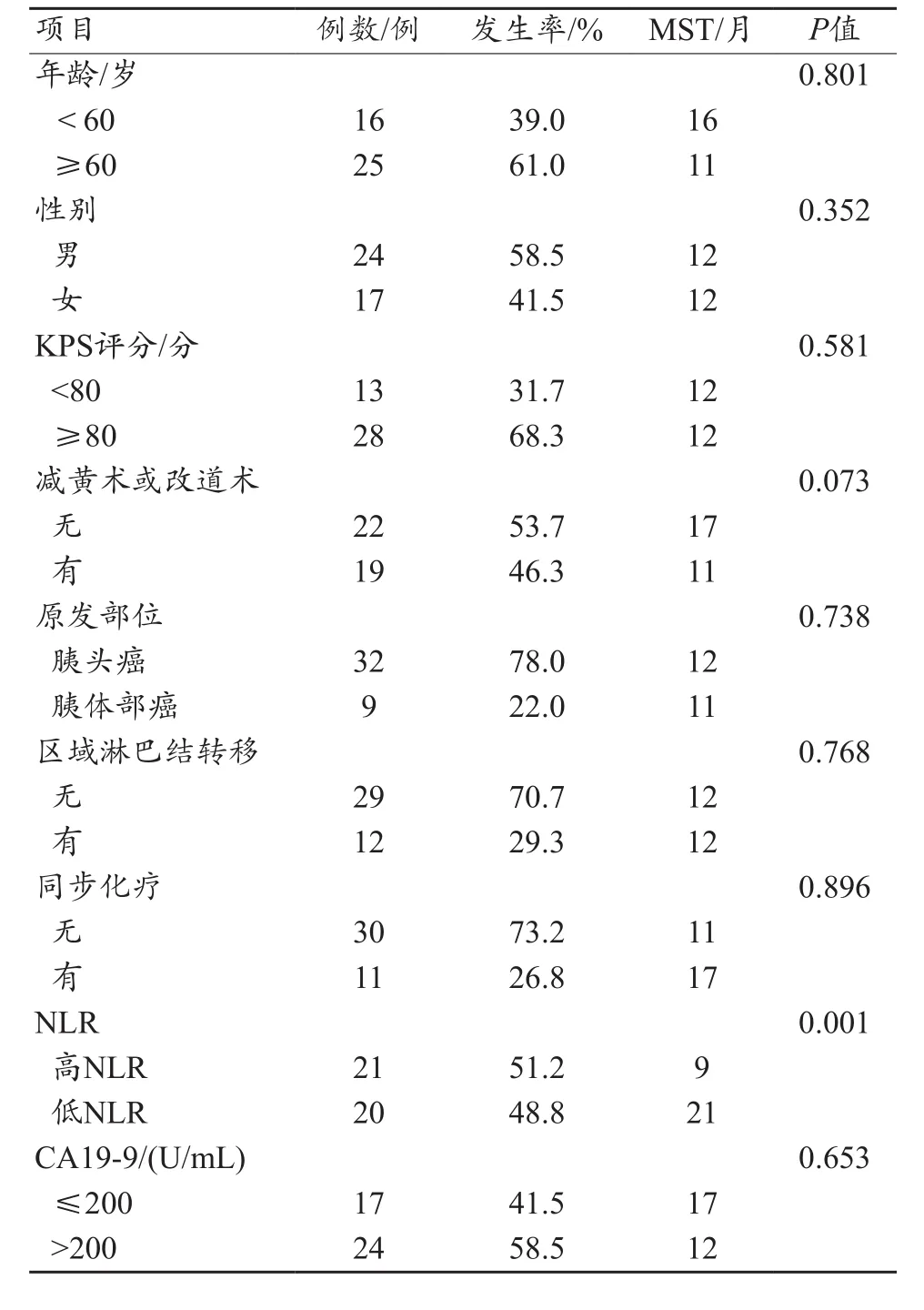
表1 不同临床参数患者MST比较
3 讨论
胰腺癌治疗效果极差,5年生存率仅2%~3%[6]。早期诊断困难,常规放化疗疗效有限。立体定向放射治疗实体肿瘤取得了显著疗效获益[7]。应用Tomotherapy系统进行高剂量少分次的放射治疗胰腺癌时,如何准确选择放疗剂量及分割模式仍是难题。TNM分期虽可用于胰腺癌的诊断及判断有无手术指征,但作为放疗预后指标却不尽如人意。临床现状是仍缺乏简易便捷的方法以评估胰腺癌预后[8-9]。
肿瘤细胞的发生发展与其微环境息息相关,二者互生互长。炎症因素是肿瘤微环境的重要组成部分。多项研究表明,作为机体炎症反应指标的NLR是探究肿瘤微环境的一项重要指标[10-12]。而且NLR作为全身炎症指标,更容易获取,更加经济准确。中性粒细胞可促进肿瘤生长及血管生成。其主要通过释放基质金属蛋白酶9和中性粒细胞蛋白酶来促进肿瘤新生血管,加快肿瘤细胞迁移及侵袭[13]。淋巴细胞参与免疫应答。其主要成分调节型T淋巴细胞,可经由细胞毒作用抑制肿瘤增殖[14]。体外共同培养中性粒细胞和淋巴细胞时,随着中性粒细胞的比例增加,其细胞溶解活性逐步受到抑制[15]。因此,NLR反映了对肿瘤的免疫能力,放疗前高NLR与预后差相关。
本研究提示高NLR组MST(9个月)少于低NLR组(21个月),差异有统计学意义(P=0.001);MST在年龄、性别、KPS评分、放疗前是否行PTCD及支架减黄术、肿瘤位置、区域淋巴结转移有无、是否同步化疗、CA19-9水平上差异无统计学意义;众多研究中NLR的分界值选择虽不尽相同,却都在2~5之间[16]。本研究通过ROC曲线得到最佳截断值,提示2.86是较好的指标。放疗前高NLR预后差,放疗耐受度低,OS更短,提示临床可适当更改治疗方案。
虽然NLR作为胰腺癌的独立预后因素仍存在争论,但其为血常规的简单衍生物,简便性极高,可反映胰腺癌肿瘤微环境的动态平衡,利于判断哪些患者将从放疗中获益,指导临床制定个体化的放疗方案及后续治疗,其意义重大。
近年来,放疗中低剂量照射区域体积对循环淋巴细胞数目研究较多,提示循环淋巴细胞较少的患者OS明显更低[17]。放疗中淋巴细胞绝对值的最低值可作为预后的独立影响因素[18]。脾脏的V5与淋巴细胞绝对值的最低值密切相关。放疗中保护脾脏,降低脾脏受照射剂量可减少放疗对循环淋巴细胞的影响[19]。下一步研究重点在于联合脾脏的低剂量照射区域体积及ALI、LMR等炎症指标,以更加精确地评估胰腺癌的预后。
