回顾性分析Catalyst HD引导双面膜固定摆位方法在头部肿瘤放疗中的可行性
2021-04-23郭腾杨敬贤王佳琦康加阜王振飞盛鹏飞于松茂岳海振
郭腾,杨敬贤,王佳琦,2,康加阜,王振飞,盛鹏飞,于松茂,岳海振
1. 北京大学肿瘤医院暨北京市肿瘤防治研究所 放疗科 恶性肿瘤发病机制及转化研究教育部重点实验室,北京 100142;2. 齐鲁医药学院 医学影像学院,山东 淄博 255300
引言
放疗是头部恶性肿瘤的主要治疗方法之一[1],治疗端的摆位精度和摆位重复性对放疗精度和疗效至关重要[2]。放疗体位和靶区空间位置的重复性和误差一直是大家关注的重点,图像引导放射治疗(Image Guided Radiotherapy,IGRT)技术的应用在一定程度上解决了此问题,采用电子射野影像系统(Electronic Portal Imaging Device,EPID)、锥形束 CT有助于修正摆位误差,是当前头部肿瘤放射治疗位置验证的有效方法,可保证放疗体位和靶区空间位置精度[3-7]。
图像引导放疗技术中锥形束CT(Cone Beam CT,CBCT)扫描后重建的三维立体图形,可以实时在线修正患者的摆位误差,由于其考虑了真实的解剖结构(例如骨与软组织),理论上是一种可以真实反映摆位误差的技术,是判断摆位误差和内部器官运动的金标准[8],现已被广泛使用。但在放疗过程中,CBCT验证时会增加患者额外辐射剂量和肿瘤复发风险[9-10]。
近年来,光学体表监测系统也已逐渐成熟并应用于临床[11-12],已逐步用于辅助分次间摆位评估和监测分次内患者运动幅度[13-14]。光学体表监测系统在摆位中具有大范围监测、实时动态误差反馈、不依赖于标记线、无创、无辐射等优势[15-17]。本文以头部肿瘤放疗为例,以CBCT为金标准,对光学表面成像系统Catalyst HD的稳定性和精确性进行研究探讨,旨在评价该技术应用中,本中心摸索的摆位流程和阈值等参数设置的可行性,为其他放疗中心相似技术的应用与研究提供参考。
1 材料与方法
1.1 病历选取与参数设置
随机选取2020年2月至10月在我院放疗的头部肿瘤患者60例,其中男性39 例、女性21例,均已签署知情同意书。患者年龄在18~78岁,平均年龄(57.93±10.52)岁,中位年龄61岁。入组条件:患者意识较清醒,依从性较好,可自主活动,发型固定。放疗处方剂量均为CTV 30 Gy/10次。
本研究所选患者均采用双面膜(Double Shell Positioning System,DSPS)和Or fit碳纤维治疗床板固定,在西门子大孔径CT(SOMATOM)完成定位,扫描范围为头顶至锁骨下缘,层厚为3 mm;分别在美国Varian公司Eclipse治疗计划系统(版本号15.5)和Edge 型号加速器(配置六维床)上完成方案设计与治疗,并采用C-Rad 公司OSI系统(Catalyst HD)进行在线校位和治疗过程中的位置监测。
Catalyst HD重要参数设置如下:三相机表面影像获取的增益均设定为200%,时间为6000 μs,体表范围为脸的全部及耳中线前部,参考图像和实时图像的Average time为3 s,非常规患者需针对其肤色进行优化调整。为确保系统精度,当天治疗前对系统进行日检并满足精度要求,系统偏差不补偿[18]。
1.2 摆位流程
首次治疗获取参考床值,利用CBCT图像和定位CT图像配准获取六个维度摆位误差,以Catalyst HD图像作为参考图像,后续治疗根据首次复位床值自动到位。通过Catalyst HD引导摆位,调整患者位置使x、y、z轴向误差在±2 mm以内;使Rtn、Pithch和Roll旋转角度在±1°以内。扫描条件为 100 kV、150 mAs,将CBCT图像与CT定位图像进行骨性的三维配准,获取3个平移方向(x、y、z轴向)和3个旋转方向(Rtn、Pitch、Roll)共6个维度的配准误差。配准误差即为摆位误差,其所有取值均取绝对值,不考虑方向问题[18]。
1.3 统计方法
利用GraphPad Prism8.0软件进行数据处理和作图,采用Pearson相关系数分析CBCT数据和光学体表引导放疗系统Catalyst HD数据的相关性,P<0.05为有统计学意义,并绘制线性回归图。计数资料以均数±标准差表示。对两组数据六个方向的误差数据进行均值分析和F检验,方差齐(P>0.05)进行独立样本t检验,方差不齐(P<0.05)行校正t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 Catalyst HD与CBCT摆位误差相关性分析
为探索两种校位方式的一致性,本研究对60例患者治疗过程中使用CBCT校位方式的分次治疗中六个维度摆位误差共180例,与当次治疗Catalyst HD摆位误差进行相关性分析,六个方向R值和P值分别为:x(r=0.5776,P<0.001)、y(r=0.5523,P<0.001)、z(r=0.3602,P<0.001)、Rtn(r=0.2699,P=0.006)、Pitch(r=0.1335,P=0.1789)、Roll(r=0.3615,P<0.001)。结果表明六个维度的摆位误差均为正相关,其中x和y方向为中等程度相关,其他四个维度相关性较弱。
2.2 Catalyst HD与CBCT引导频次摆位误差统计分析
对两组摆位误差数据进行F检验,结果显示x、z、Pitch和Roll方向方差不齐(P<0.05),进行校正t检验;y和Rtn方向方差齐(P>0.05),行独立样本t检验,统计量t1和P1值如表1所示。
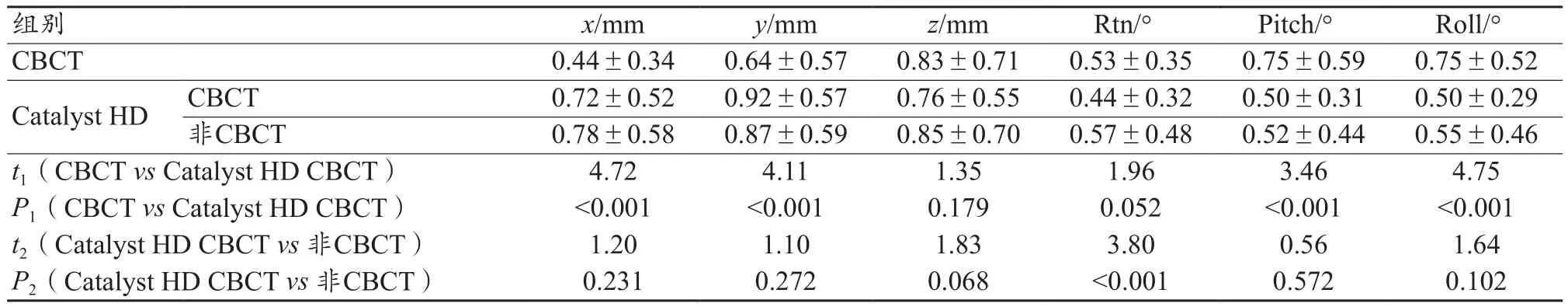
表1 CBCT与Catalyst HD六个维度的摆位误差统计分析
2.3 Catalyst HD摆位数据CBCT与非CBCT引导分次对比分析
对非CBCT引导频次的Catalyst HD摆位数据进行F检验,z、Rtn、Pitch和Roll方向方差不齐(P<0.05),对上述四个方向进行校正t检验,对方差齐(P>0.05)的x和y方向进行行独立样本t检验,统计分析结果t2和P2详见表1。结果显示除Rtn方向外,差异均无统计学意义,上述误差分布情况与统计结果详见图2。

图1 CBCT与Catalyst HD误差对比箱图
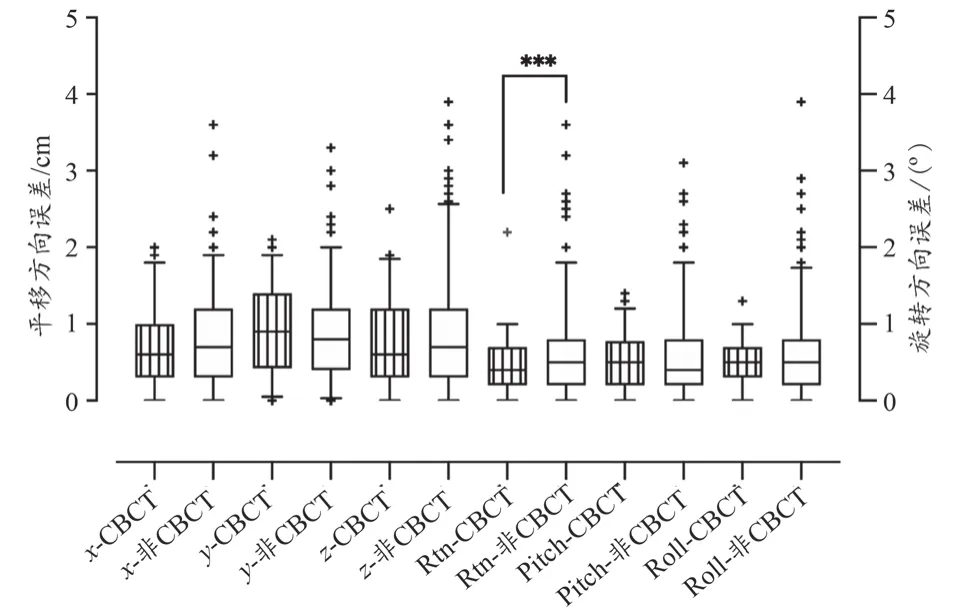
图2 CBCT验证时与非CBCT验证时Catalyst HD六方向误差对比箱图
3 讨论
头部肿瘤放疗时,由于结构复杂,微小的摆位误差可能导致靶区及其周围危及器官的较大的剂量影响,因此摆位精度和可重复性对放疗精度影响较大[19-20],基于CBCT的影像引导放疗技术可有效保证摆位精度[21]。出于减轻患者经济负担和额外无法评估的辐射损伤的原因,放疗临床一般采用每周一次CBCT引导的方式[22],无法实现每个分次的在线校位。随着光学体表监测系统的出现,很大程度上解决了上述难题。
光学体表监测技术在应用之初,普遍在首次治疗完成CBCT与CT图像配准后,记录该时刻床值作为参考床值,以后分次治疗时直接通过自动移床的方式进行摆位,很大程度上提高了摆位效率;另一方面,可以判断光学体表监测系统的引导精度,通过设置相应阈值,实现以后治疗分次摆位依据和治疗过程中的位置监控。结果显示,Catalyst HD相对CBCT的摆位误差在三个线性方向的平均值±标准差相对较大,而三个旋转方向相对较小,提示同样条件下,Catalyst HD系统在平移方向的阈值可适当放宽,旋转方向可相对减少。两种摆位系统在六个维度的摆位误差之间存在弱相关关系,提示两种原理不同的技术在对各个方向误差的探测能力和敏感度方面,存在差异。
本研究以CBCT引导的治疗分次摆位数据为参考,非CBCT分次治疗时利用光学体表引导摆位,患者总体六维方向摆位误差基本都在2 mm/2°以内,符合临床要求,六维方向相关性呈中等相关或弱相关,可能存在以下问题需要进一步改进:① 反射光束可能存在系统或偶然误差无法消除,导致位移存在一些偏差;② 病例选取数据量有限,今后可增加不同肿瘤的相关数据;③ 部分患者在放疗期间同步化疗,体重变化较大,肤色改变,对皮肤表面信息造成一定影响;④ 患者首次治疗由于紧张、不适应、呼吸幅度频率改变等因素,在去掉面罩获取体表信息时可能出现偏差;⑤ 首次治疗后行光学体表引导摆位并再次行CBCT记录并修正摆位误差,对光学体表系统引导放疗摆位的精度是否有所帮助还需进一步验证,要考虑CBCT剂量对患者的影响。
综上所述,光学体表引导摆位方法摆位精度较高,与CBCT校位方式一致性较好,可保证非CBCT校位分次中患者的体位一致性,是一种有效的低成本图像引导工具。可作为日常快速辅助患者摆位的有效手段,降低正常器官的辐射剂量,提高工作效率。
