鸡源大肠杆菌M1株的分离鉴定及遗传进化分析
2021-04-23王育伟刘亚东周玉刚张晓晖周爱民李廷见
王育伟,刘亚东,周玉刚,张晓晖,周爱民,李廷见
(绵阳市农业科学研究院畜禽水产研究所,四川 绵阳 621023)
大肠杆菌(E.coli)是养殖环境中存在最为广泛的病原菌之一[1],常单独或混合感染引起家禽细菌性疾病,每年给家禽养殖业造成了巨大的经济损失。E.coli单纯感染可引起禽大肠杆菌病[2],主要症状包括心包炎、失明、腹泻、滑膜炎、大肠杆菌性肉芽肿和脐炎等。常与沙门氏菌(Salmonella)和鸡毒支原体(Mycoplasma gallisepticum,MG)共同感染引起鸡白痢、鸡毒支原体病等疾病[3]。
细菌鉴定对精准的用药和疾病防控具有重要意义,除了常规的形态学鉴定方法以外,分子生物学鉴定方法因分型精确等优点而成为重要的鉴定方法。16S rDNA 序列是研究细菌系统发育和分类最常用的管家遗传标[4],atpD 基因等功能基因也非常有助于细菌进化分析[5]。本研究对从绵阳一养鸡场腹泻病例中分离到的M1菌进行鉴定,并建立16S rDNA 和atpD 基因遗传进化分析,为科学防控该类疾病提供参考。
1 材料与方法
1.1 试验材料 从四川省绵阳市游仙区一养鸡场腹泻病例中分离出1 株细菌,命名为M1 菌。
1.2 主要试剂 糖铁琼脂、麦康凯培养基,购自成都康迪生物科技有限公司;伊红美蓝培养基,购自青岛日水生物技术有限公司;微量生化反应管,购自杭州天和微生物试剂有限公司;细菌基因组DNA 提取试剂盒(TIAN amp Bacteria DNA Kit),购自天根生化科技(北京)有限公司。
1.3 菌株的分离培养 将采样拭子置于5 mL LB 培养基中,37 ℃振荡培养6~8 h,然后于普通固体培养基上划线,37 ℃培养24 h,革兰氏染色后镜检,观察细菌形态。用接种针挑取形态、大小不同的单菌落在固体培养基上培养24 h(37 ℃),挑取深紫色带有金属光泽的单菌落于麦康凯固体培养基上划线培养,观察菌落形态,然后进行革兰氏染色、镜检。
1.4 生化试验鉴定 将初步分离到的菌株纯化扩菌后,取菌液分别接种于硫化氢、苯丙氨酸、葡萄糖酸盐、蛋白胨水、葡磷胨水、枸橼酸盐、尿素、赖氨酸、鸟氨酸、棉子糖、山梨醇、侧金盏花醇、木胶糖、七叶苷培养基中,37 ℃温箱培养6~48 h,观察并记录试验结果。
1.5 细菌基因组DNA提取 取单菌落接种于5mL培养基中37 ℃培养24 h,取1.0 mL 菌液于1.5 mL离心管中,13 000 r/min 离心2 min,弃上清。沉淀重悬于1.0mL 0.85% NaCl中。室温下13000r/min离心2 min,弃上清。沉淀重悬于550 μL 1×TE缓冲液中。加17 μL 溶菌酶(35 mg/mL),37 ℃温育30 min。加3 μL 蛋白酶K(20 mg/mL),37 ℃温育30 min。加30 μL 10% SDS,37 ℃温育30 min。加100 μL 5 M NaCl 充分混匀。加80 μL CTAB/NaCl 溶液,混匀,65 ℃水浴10 min。加等体积(0.7~0.8 mL)氯仿/异戊醇(24∶1),轻轻振荡混匀。室温下13000r/min离心10 min。将上清液转移到一新的1.5 mL 离心管中,加入等体积酚/氯仿/异戊醇(25∶24∶1),轻轻振荡混匀。再将上清液转移到一新的1.5 mL离心管中,加入等体积氯仿/异戊醇(24∶1),轻轻振荡混匀。弃上清,加500 μL 70%乙醇,轻轻颠倒数次(洗盐)。4 ℃15 000 r/min离心7 min。重复洗盐两次。倒置离心管,干燥DNA沉淀7 min。DNA 沉淀溶于100 μL 1×TE缓冲液,-20 ℃保存备用。
1.6 16S rDNA系统进化分析 设计16S rDNA引物送生工生物工程(上海)股份有限公司合成,提取M1 菌株的16S rDNA,PCR 产物经回收纯化后测序,利用NCBI 中BLAST 程序将分离菌株的16S rDNA 序列与GenBank 数据库中已知基因序列进行比对。利用生物信息学软件DNAStar 和MEGA6 对分离菌株与部分大肠杆菌的核苷酸序列进行同源性比对分析,并构建系统进化树。16S rDNA 的PCR 扩增反应体系为100 mL:Taq(5 U/mL)0.8 mL,10×PCR Buffer(Mg2+Plus)10 mL,dNTP Mixture(2.5 mmol/each)8 mL,模 板DNA 2.5 ng,引物F1 和R1(10 mol/L)各2 mL,ddH2O 补足到100mL。反应条件为:95℃5min;95℃1min,57 ℃1 min,72 ℃60 s,30 个循环;72 ℃5 min。16S rDNA引物序列如表1所示。
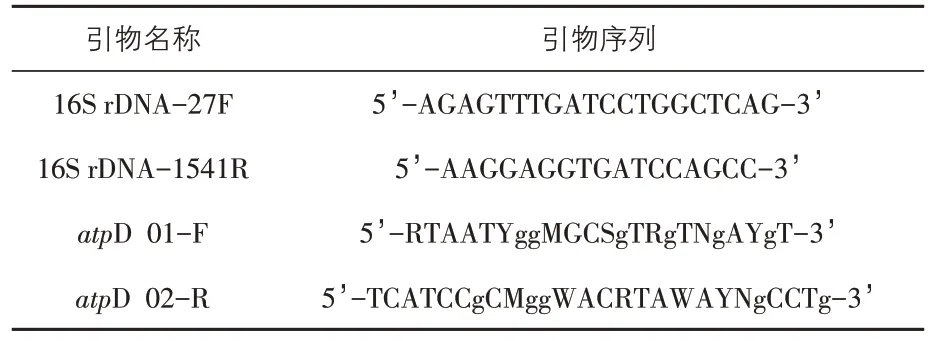
表1 16S rDNA与atpD基因引物序列
1.7atpD 基因系统进化分析 设计atpD 基因引物送生工生物工程(上海)股份有限公司合成,提取M1 菌株的atpD 基因,PCR 产物经回收纯化后测序,利用BLAST 软件对相似菌株的atpD 基因序列进行比对,利用MEGA6 软件中的最大可能性法构建系统进化树。100 mLatpD 基因反应体系为:Taq(5 U/mL)0.8 mL,10×PCR Buffer(Mg2+Plus)10 mL,dNTP Mixture(2.5 mmol/each)8 mL,模板DNA 2.5 ng,引物F1 和R1(10 mol/L)各2 mL,ddH2O 补足到100 mL。反应条件为:95 ℃5 min;95 ℃1 min,3 个循环;55 ℃135 s,72 ℃ 75 s,95 ℃ 35 s,30 个 循 环;55 ℃ 75 s,72 ℃5 min,72 ℃7 min。atpD 基因引物序列如表1所示。
2 结果与分析
2.1 细菌培养与分离鉴定 M1 菌接种在LB 肉汤纯化至镜检为单一细菌形态,在普通固体培养基上生长出圆形、光滑、边缘整齐或不太整齐的乳白色中等偏大菌落,在麦康凯培养基上呈桃红色。革兰氏染色后在油镜下可以观察到两端钝圆的粉红色短杆菌,革兰氏阴性,散在或成对出现。
2.2 生理生化试验 生理生化试验结果表明,M1菌可以发酵多种糖类,产酸产气;运动性试验为阳性;吲哚(I)试验、甲基红(M)试验为阳性;VP(V)试验和枸橼酸盐(C)利用试验为阴性;产硫化氢(H2S)试验为阴性;尿素酶试验为阴性;触酶试验为阳性。根据《常见细菌系统鉴定手册》判定,M1菌符合大肠杆菌的生化特征。

表2 M1菌与其他菌株的序列同源性表(同源性=1-差异率×100%)
2.3 16S rDNA 系统进化与同源性分析 将16S rDNA序列与GenBank中的相近序列进行比对,从16S rDNA 序列的同源性分析结果来看,M1 菌株与E.coli、痢疾志贺菌、马尔莫拉大肠杆菌等菌的同源性均在99%以上。利用MEGA6.0构建了M1与参考菌株的16S rDNA 序列系统进化树(见图1),结果表明,M1与鲍氏志贺菌(Shigella boydii)和宋氏志贺菌(Shigella sonnei)的同源性相近,判定M1属于肠杆菌科细菌。
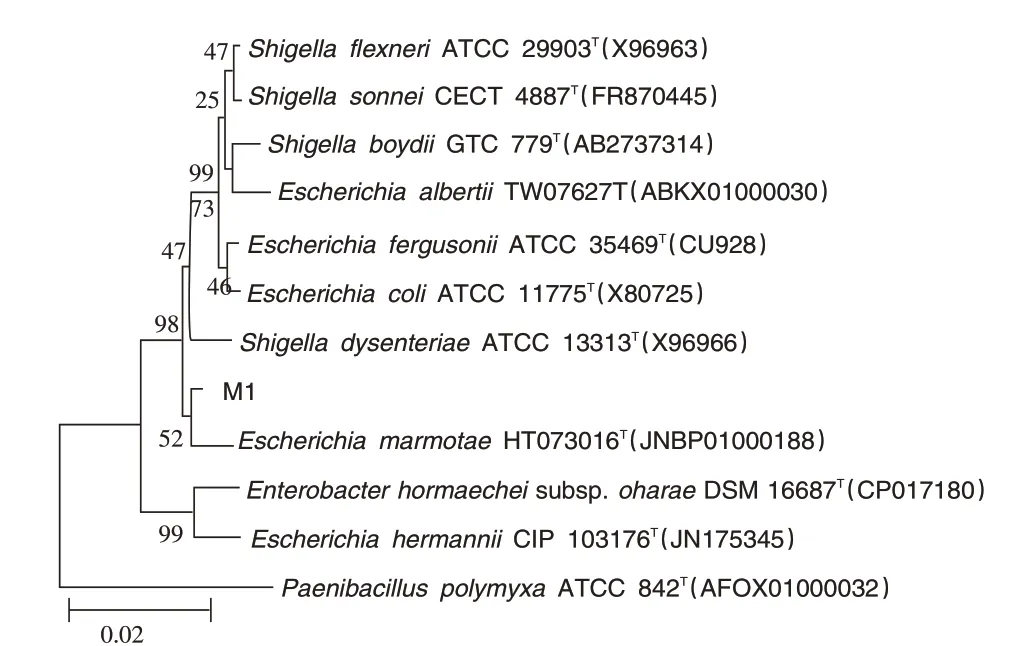
图1 M1菌株与相关种的16S rDNA序列系统进化树分析
2.4atpD 基因序列同源性与系统进化分析 将atpD 基因序列与GenBank 中相近序列进行比对,结果表明,M1 菌株与E.coli、鲍氏志贺菌(Shigella boydii)和宋氏志贺菌(Shigella sonnei)序列的同源性在99.9%以上(见表2)。利用MEGA6.0分子生物学软件构建M1 菌株和相关种的atpD 基因系统进化树(图2),表明M1分离株与志贺氏菌和E.coli的亲缘关系较近。从功能基因同源性分析结果来看,M1 菌株与E.coli的同源性最高,鉴定M1菌属于肠杆菌科大肠杆菌属。

图2 M1菌株与相关种的atpD基因序列系统进化树分析
3 结论与分析
为明确从腹泻肉鸡病例中分离到的M1 菌株的生物学特性,本试验进行了纯化培养和生物学鉴定。结果显示M1 菌落外观呈白色凸起,镜下外观为两端椭圆杆状G-菌;结合生化试验结果,发现M1 菌株符合大肠杆菌的生化特性,与由佳等[6]研究的结果一致。分子检测方法在细菌鉴定中具有高度特异性和敏感性特征,本研究借助16S rDNA 和功能基因atpD 基因序列进行类群及系统发育分类,并与GenBank 中相近序列进行比对,结果显示M1 菌株与E.coli、志贺菌等种的序列同源性在99%以上,进化树分析得出M1 与鲍氏志贺菌和宋氏志贺菌的家族关系较近。综合传统细菌鉴定、生理生化试验与16S rDNA、atpD 基因进化分析结果,证实所分离M1菌属于大肠杆菌。
