金属钌化合物的制备、表征及抗肿瘤活性评价*
2021-04-22邵长兴余群英
邵长兴,余群英
(九江学院药学与生命科学学院,江西 九江 332005)
有机金属钌抗癌治疗剂因具有良好的生物学特性被认为是铂类抗癌治疗剂的可替代品,一些金属钌抗癌剂甚至对顺铂产生耐药性的肿瘤细胞系也同样有效[1]。近年来,“钢琴凳式”类八面体有机金属钌(II)配合物的研究受到了广泛的关注,其中一个η6-π键合的芳烃配体形成“钢琴座”,其余三个配位基团形成“钢琴腿”(图1)。芳烃部分对配合物的活性有着重要的影响,它可以增加配合物的疏水性,促进亲脂类物质的吸收[2]。另外,有机金属钌的抗癌活性受配体配位方式的影响也很大。含P-或N-单齿配体、O,O-双齿配体、N,O-双齿配体的有机金属钌试剂对CH1 (PA-1) 以及A2780细胞无活性,而含S,O-、S,N-、C,N-和N,N-双齿配体的钌试剂抗增殖活性很高[2]。N,N-螯合配体可以是脂肪族二胺、芳香族二胺、联吡啶衍生物等含氮有机化合物,为芳烃钌配合物中常见的配体结构。Sadler等报道了具有典型代表性的以二胺为核心的芳烃Ru(II)试剂,他们将惰性双齿配体1,2-乙二胺(en)和氯作为离去基团配位到芳烃金属钌核上,合成出[(η6-芳烃)RuCl(en)]PF6(RM175) (图1),该钌试剂对人卵巢癌细胞株A2780具有很强的抗增殖活性[2-3],能与DNA共价结合从而提高了配合物对不同肿瘤细胞的抗增殖活性[4]。Palaniandavar等报道了含蒽基甲基二氮杂环庚烷配体的Ru(II)-芳烃配合物,同DNA和蛋白质显示出较高的结合力,比含简单的二氮杂环庚烷配体的Ru(II)-芳烃配合物具有更高的细胞毒活性[5-6]。Zheng等[7]开发了含4-苯胺喹唑啉(4-AQ)的钌(II)配合物(4~9)(图1),该配合物对EGFR的抑制活性强于4-AQ。
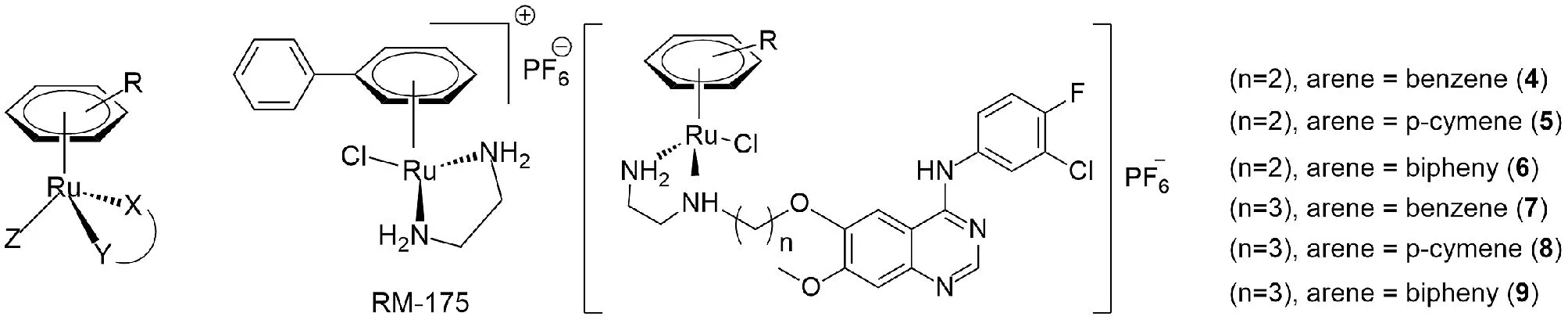
图1 “钢琴凳式”类八面体有机金属钌(II)配合物,RM-175以及含4-苯胺喹唑啉(4-AQ)配体的钌(II)配合物(4~9)的化学结构
鉴于以上研究结果,我们以芳基钌(II)配合物[Ru(η6-伞花烃)(2-氨甲基吡啶-N,N)Cl]PF6为研究对象,研究其体外对4种人癌细胞系的毒性,以抗癌药物顺铂为对照组,以期有所发现。
1 合成实验
1.1 仪器与试剂
所用化学试剂均为市售产品,分析纯,直接使用。采用X-4数字显微熔点测定仪测定熔点(温度未经校正);采用Bruker DRX-400核磁共振波谱仪测定氢谱和碳谱,以SiMe4为内标;采用NICOLET iS10傅里叶红外光谱仪测定4000~200 cm-1范围内的红外光谱。
1.2 合成方法
[(η6-cymene)RuCl(2-picolylamine-N,N)]PF6(1)的合成,室温下,将二氯(对甲基异丙苯)钌(II)二聚体(0.212 g,0.33 mmol)悬浮于无水甲醇(50 mL)中,并一次性加入2-氨甲基吡啶(0.108 g,1 mmol),搅拌3 h后过滤,滤液中加入NH4PF6(0.5 g,3.07 mmol),搅拌5 min后采用旋转蒸发仪减压浓缩体积约15 mL,在277 K下静置,待析出微晶后过滤收集产物,乙醚洗涤,甲醇-乙醚重结晶得到黄色晶体产物(0.206 g, 51.0% yield)。1H NMR谱图给出以下特征信号:在δ 9.40~7.30范围内出现的4个芳香族氢信号归为吡啶环上氢信号,两个dd耦合的芳烃质子信号归为伞花烃芳环氢信号。δ 4.30~3.90范围内的多重峰为N-CH2-质子信号峰。13C NMR谱图给出16个碳信号峰,包括11个芳香碳和5个脂肪碳,δ 81.70为 CH2-NH2碳信号峰。红外光谱给出3500~3100 cm-1范围内的宽峰,为N-H伸缩振动吸收带。1H NMR (400 MHz, DMSO-d6) δ 9.11 (d,J=5.4 Hz, 1H), 8.30~7.75 (m, 1H), 7.70~7.40 (m, 2H), 7.10~6.80 (m, 1H), 5.90 (d,J=5.8 Hz, 1H), 5.84 (d,J=5.9 Hz, 1H), 5.71 (d,J=5.9 Hz, 1H), 5.65 (d,J=5.8 Hz, 1H), 4.55~4.30 (m, 1H), 4.25~3.95 (m, 2H), 2.90~2.60 (m, 1H), 1.95 (s, 3H), 1.11 (d,J=6.8 Hz, 6H);13C NMR (101 MHz, DMSO-d6) δ 161.23, 154.54, 139.13, 124.87, 121.14, 103.05, 98.02, 84.84, 83.07, 82.27, 81.70, 52.04, 30.23, 22.32, 21.42, 17.63; IR (KBr) νmax(cm-1): 3438, 3334, 3227, 2973, 1613, 1469, 1441, 1386, 1312, 1165, 1105, 1037, 881, 839, 764, 558. Anal. Calcd for C22H39ClF6N2PRu: C, 43.1; H, 6.41; N, 4.57. Found: C, 42.96; H, 6.25; N, 4.41。
2 活性测试
2.1 材 料
HepG2(HCC)、Hela(cervical)、A549(lung)、MCF-7(breast)细胞系;RPMI1640培养基、DMEM/H培养基、PBS、75 cm2培养瓶、96孔细胞培养板均购自CORNING;MTT、0.25% Trypsin-EDTA、Pen Strep均购自GIBCO;Foetal Bovine Serum购自BIOLOGICAL INDUSTRIES;DMSO购自AMRESCO;SNAYO CO2培养箱;HEALES MB-580酶标仪。
2.2 采用 MTT 法测定抗肿瘤活性
将钌配合物1及顺铂分别用DMSO溶解,配制成100 mg/mL后于4 ℃下储存备用。将MTT用磷酸盐缓冲盐(PBS,pH=7.2)配成5 mg/mL溶液后通过0.22 μm微孔过滤器过滤备用。
将肿瘤细胞(HepG-2、Hela、A549、MCF-7)悬浮于10%的胎牛血清中于DMEM/H培养基常规培养(37 ℃,5% CO2)。用于实验的细胞保持在对数增长期。0.25% Trypsin-EDTA消化收集细胞并计数,以每毫升4×104个细胞数接种于96孔细胞培养板,每孔200 μL,孵育24 h使贴壁。测试化合物用培养液和DMSO稀释成不同浓度,每个浓度设6个平行孔,与癌细胞于CO2培养箱中共同孵育48 h。每孔加入浓度为0.5 mg/mL的MTT (50 μL),再孵育4 h后,轻轻吸去上清。每孔加入150 μL DMSO,摇床振摇至充分溶解后用酶标仪在490 nm处检测并记录各孔吸光度值。抑制率按照以下计算公式计算:抑制率%=(化合物组平均OD值-对照组平均OD值)/对照组平均OD 值×100%。SPSS 进行回归分析计算IC50值,实验重复3次,IC50最终结果以3次实验平均值±SD值表示。
2.3 活性测试结果
文章采用MTT法检测有机金属钌试剂1对人癌细胞系HepG-2(HCC)、A549(lung)、Hela(cervical)、MCF-7(breast)的体外抑制活性,以对临床抗癌用药物顺铂为对照组。将以上细胞系与不同浓度的化合物1和顺铂共同孵育48 h,结果表明有机金属钌化合物1对HepG-2、A549和Hela的抑制作用呈剂量依赖关系,浓度在10 μg/mL以下时效果不如顺铂,浓度在100 μg/mL左右时,效果逐渐与顺铂相当;对MCF-7(breast)几乎无抑制作用,不如顺铂(表1)。

表1 有机金属钌化合物1和顺铂与 HepG-2(HCC)、A549(lung)、Hela(cervical)、MCF-7(breast)共同孵育48 h后所测的半数最大抑制浓度(IC50)值
3 结 论
本文合成并表征了芳基钌(II) 配合物[Ru(η6-伞花烃)(2-氨甲基吡啶-N,N)Cl]PF6,首次测定了其体外对4种人癌细胞系HepG2(HCC)、Hela(cervical)、A549(lung)、MCF-7(breast)的抑制作用,以临床用药顺铂为对照。测试结果表明其对 MCF-7 (breast) 几乎无抑制作用,对HepG2(HCC)、Hela(cervical)、A549(lung)的抑制作用呈剂量依赖关系, 浓度在100 μg/mL左右时,抑制效果逐渐与顺铂相当,说明该配合物具有很好的抗肿瘤作用,具有进一步研究的价值。
