生、熟小米提取物降糖效果研究
2021-04-22尹瑞旸胡锦蓉胡小松
尹瑞旸,薛 勇,胡锦蓉,胡小松,沈 群
(中国农业大学食品科学与营养工程学院 植物蛋白与谷物加工北京市重点实验室国家果蔬加工工程技术研究中心 北京100083)
二型糖尿病(T2DM)是一种复杂的慢性代谢紊乱疾病,其特征是因胰岛素抵抗的进一步发展和胰岛素效率降低导致的胰岛素相对或绝对缺乏而引起高血糖症状[1]。T2DM 已成为全球公共卫生面临的一大挑战,据国际糖尿病联合会(IDF)估计,2017年有超过4.25 亿人患有糖尿病,到2045年这一数字预计将增加到6.29 亿人。很多科学家都在寻找合适的药物或者通过膳食干预来降低二型糖尿病对人体健康的影响。在1922年发现胰岛素之前,糖尿病的治疗主要是通过饮食控制和植物疗法[2]。如今,人们普遍认为植物性食品具有较高的营养价值,其中超过400 种植物被用于糖尿病的治疗。流行病学研究表明,谷类食物可以降低二型糖尿病的发展[3]。
作为粟类代表的小米,由于其种植地域的限制,对其研究也受到一定程度的限制。早在《神农本草》中就记载其具有消渴的功效。国内外的一些研究也指出其具有潜在的健康功效。人群实验表明,小米膳食可以显著降低糖耐量减低受试者的空腹血糖、糖耐量后2 h 血糖、胰岛素抵抗指数和肥胖程度[4]。小米的膳食纤维含量是大米的2~10倍,并含有一定量的抗性淀粉[5],能够改善餐后血糖反应,避免应激性低血糖[6]。小米中还富含多酚物质(0.30%~3.00%)[7],有较强的抗氧化作用。然而,关于小米多酚的降糖效果存在争议。有研究表明小米多酚可显著促进脂肪分解,降低胰岛素及瘦素,达到降糖的效果[8];也有研究认为小米多酚对α-淀粉酶和α-葡萄糖苷酶抑制活性不及高粱等其它杂粮,无法调节餐后血糖[9]。然而,目前的研究均未明确解析小米的降糖成分。此外,小米作为粮食作物,加工方式也决定了其营养特性。加热为最常见的处理方式,加热过程可破坏小米中热敏性物质,使淀粉糊化及蛋白变性。通过对生、熟小米提取物的功效比较可以更好地了解其降糖组分的性质。
针对上述情况,本试验系统分析了生、熟小米70%乙醇提取物对STZ 诱导的SD 大鼠糖脂代谢的影响。依次用正己烷、乙酸乙酯、正丁醇、水4 种不同极性溶剂萃取生、熟小米70%乙醇提取物,比较其抗氧化及α-淀粉酶抑制作用,从而初步判定小米的活性组分。本试验结果可为小米的生物功能研究提供借鉴。
1 材料与方法
1.1 试验材料
1.1.1 实验动物 8 周龄雄性SD 大鼠(动物合格证号:11400700149680),购至北京维通利华实验动物技术有限公司(SCXK(京)2012-0001)。
1.1.2 试剂 以山西东方亮小米为研究对象,淀粉(68.2%)、蛋白(11.0%)、脂肪(6.7%)、总膳食纤维(2.04%)、维生素E(6.58 mg/kg)、阿魏酸(15.6 μg/100 g)。STZ,美国Sigma 公司;其它试剂均为分析纯。
1.2 试验方法
1.2.1 样品提取 小米与水比例为1∶1.6 (小米500 g,加入800 mL 水),用电饭锅蒸20 min,焖10 min。50 ℃,12 h 左右烘干,过80 目筛。此时糊化度达85%以上。
生、熟小米500 g,打粉机每30 s 停歇1 次,1次10 min,防止打粉机过热,过80 目筛。料液比1∶10(小米∶70%乙醇),超声5 s,停5 s 共30 次破碎。在50 ℃旋涡提取2 h。抽滤后将上清减压蒸馏并冷冻干燥,得生小米70%乙醇粗提取物(UMC)、熟小米70%乙醇粗提取物(M-C),于-80 ℃保存。
将生、熟小米70%乙醇粗提物(UM-C、M-C)溶解在水中,加入与水等体积的正己烷,常温萃取3 次,合并上相萃取液并减压浓缩,得生、熟正己烷相粗提物(UM-HX、M-HX);下相依次用乙酸乙酯、正丁醇萃取,合并萃取液并减压浓缩,得乙酸乙酯相生、熟粗提物(UM-EA、M-EA),正丁醇相生、熟粗提物(UM-BT、M-BT)。有机溶剂萃取后的水相减压浓缩,获得水相生、熟粗提物(UM-W、MW)。将上述得到的5 种粗提物冷冻干燥,氮吹过夜,于-80 ℃保存。
1.2.2 动物试验
1.2.2.1 大鼠的常规饲养 所有SD 大鼠用维持饲料适应性饲养1 周,饲养环境为SPF 级,昼夜对半交替,保证自由摄食及摄水。随后随机选取6 只为正常对照组,采用10%低脂饲料喂养,直至试验结束。其余改用60%高脂饲料喂养,维持4 周。
1.2.2.2 糖尿病大鼠的制备及分组 高脂饲养4周后的大鼠,经隔夜禁食后,腹腔注射35 mg/kg 的STZ 溶液,继续60%高脂饲养。STZ 注射3 d 后,隔夜禁食,尾尖取血测空腹血糖,以空腹血糖>10 mmol/L 为造模成功标准,筛选出血糖达标的糖尿病大鼠,随机分为模型对照组(D)、二甲双胍阳性对照组(Met,100 mg/kg bw)、生小米70%乙醇粗提物低剂量组 (UM-CL,200 mg/kg bw)、熟小米70%乙醇粗提物低剂量组(M-CL,200 mg/kg bw)、熟小米70%乙醇粗提物高剂量组(M-CH,400 mg/kg bw)。
1.2.2.3 口服糖耐量试验(OGTT)大鼠禁食(不禁水)12 h,各组大鼠经口给予2.0 g/kg bw 葡萄糖溶液。在随后120 min 内,分别在0,30,60,120 min 割尾静脉采血,血糖仪测定血糖。糖耐量曲线下面积(AUC)采用梯形法计算:

1.2.2.4 脏器系数测定 实验动物处死后,立即取脏器,滤纸吸干表面水分称其湿重,计算脏器系数:
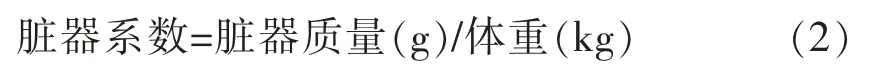
1.2.3 DPPH 自由基清除能力测定 0.45 mmol/L DPPH 乙醇溶液与样品溶液(0.5,1.0,2.0,4.0,8.0 mg/mL)1∶1 混合,室温避光1 h 后,离心取上清,517 nm 波长处测定吸光值。利用5~50 μmol/L Trolox 制作标准曲线。DPPH·清除率的计算公式为:
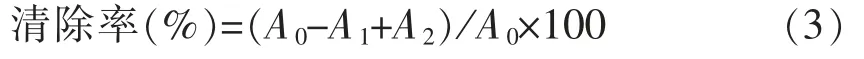
式中:A0——DPPH 溶液3 mL+无水乙醇/蒸馏水3 mL 的吸光度;A1——DPPH 溶液3 mL +样品溶液3 mL 的吸光度;A2——样品溶液3 mL+无水乙醇3 mL 的吸光度。
1.2.4 总抗氧化能力测定 将生、熟小米70%乙醇粗提物、正己烷、乙酸乙酯、正丁醇和水配制成不同的浓度梯度5.0,10.0,15.0,20.0,25.0 mg/mL,提取物消化液为5 mg/mL,沉淀物消化液为25 mg/mL,取1.0 mL 样品溶液加入到3.0 mL 工作液中 (10 mmol/L 2,4,6-三吡啶基三嗪(TPTZ)、20 mmol/L FeCl3、0.3 moL/L 醋酸缓冲液以1∶1∶10 的比例混合,预热至37 ℃备用),摇匀后于37 ℃水浴中静置10 min,593 nm 波长处测定其吸光值。另 以0.0125,0.0250,0.050,0.100,0.150,0.200,0.250 和0.300 mmol/L FeSO4作标准曲线(吸光度0.087~0.952),样品的抗氧化活性以达到同样吸光度值所需FeSO4的摩尔数表示。标准曲线为:y =3.0485x + 0.0458,R2=0.999。
1.2.5 α-淀粉酶抑制作用测定 10 μL 样品与50 μL 酶液混合(2 U/mL),加入50 μL 磷酸钠缓冲溶液 (0.02 mol/L,pH 6.9),37 ℃孵育10 min。加入90 μL 可溶性淀粉溶液(0.5%),37 ℃反应20 min。加入100 μL 二硝基水杨酸(DNS)溶液沸水浴10 min。冷却至室温后,540 nm 下测定。当吸光值在0~2.22 时,吸光值与葡萄糖浓度有较好的线性关系,此方法所用酶及底物浓度、反应时间产生的葡萄糖含量落在标准曲线内(y=452.64x-0.064,R2=0.992)。
1.2.6 数据处理方法 采用Excel 软件统计数据,所有数据均为4 次重复试验的平均值和标准误。采用SPSS 16.0 软件进行显著性分析,P<0.05表示差异显著性。
2 结果
2.1 粗提取物对大鼠体重及脏器指数的影响
由表1可知,随着干预时间的延长,各组大鼠体重持续增长,但干预组与模型组体重并无差异。脏器指数能够反映药物对相关器官的影响。各组大鼠的脾、睾丸及睾丸脂肪系数与D 组均无显著差异。与正常对照组(ND)相比,D 组大鼠肾脏及肝脏系数均显著增加,灌胃小米提取物的大鼠肝脏系数没有明显变化(与D 组相比)。Met、UM-CL组肾脏系数有所降低,但与D 组相比均无显著差异。M-CL 组、M-CH 组大鼠肾脏系数升高,其中M-CH 显著高于D 组大鼠(P<0.05)。
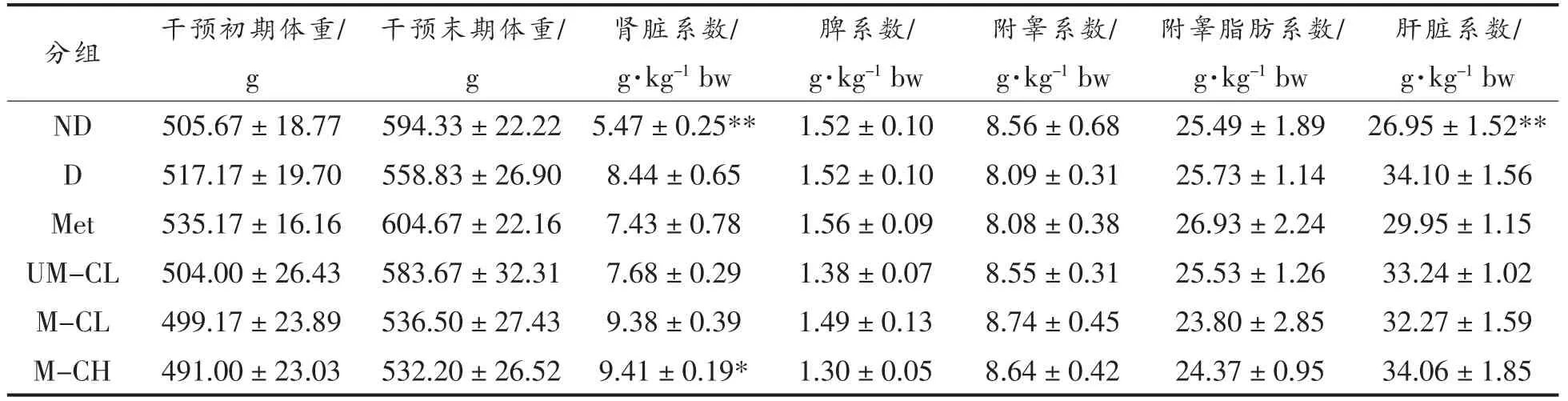
表1 粗提物对大鼠脏器指数的影响Table 1 Effects of crude extracts on visceral index in rats
2.2 粗提物对糖耐量及空腹血糖影响
注射STZ 成模后,经过为期4 周的高脂喂养,D 组及干预组的空腹血糖显著高于ND 组 (图1a),并出现了糖耐量受损(IGT),OGTT 曲线下面积(AUC)增加(图1b),与ND 组有极显著差异(P<0.01)。二甲双胍可显著改善由STZ 联合高脂诱导的大鼠IGT 及空腹血糖,AUC 及空腹血糖与D 组比有显著差异(P<0.05)。UM-CL 可显著改善大鼠IGT 及空腹血糖,其效果与二甲双胍相当,Met 组及UM-CL 组小鼠AUC 分别降低38.97%,19.95%。而熟小米粗提取物效果较差,在低/高浓度下AUC 及空腹血糖均与D 组无显著差异。
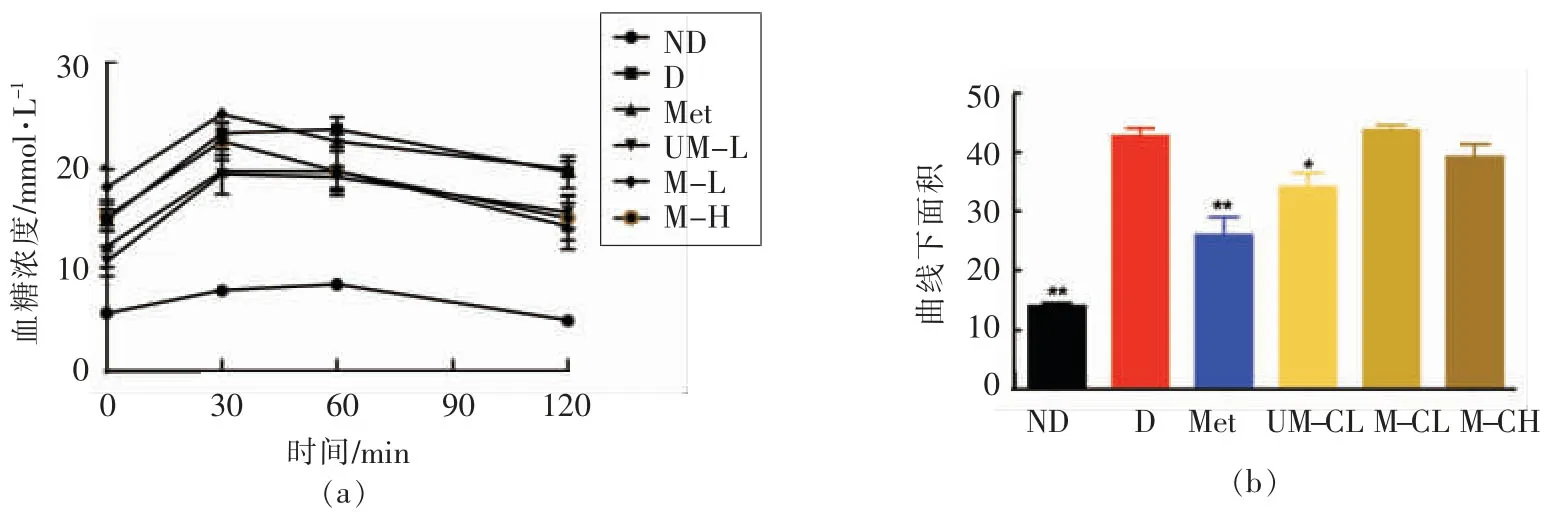
图1 粗提物对大鼠糖耐量影响Fig.1 Effect of crude extract on glucose tolerance in rats
2.3 粗提取物对大鼠血脂的影响
由表2可知,D 组大鼠血清中胆固醇(TC)及高密度脂蛋白(HDL)含量显著低于ND 组大鼠(P<0.05)。经过为期4 周的干预,干预组的TC、甘油三酯、低密度脂蛋白与模型组相比均无显著性差异(P>0.05)。UM 组大鼠血清HDL 显著高于D组(P<0.05)。
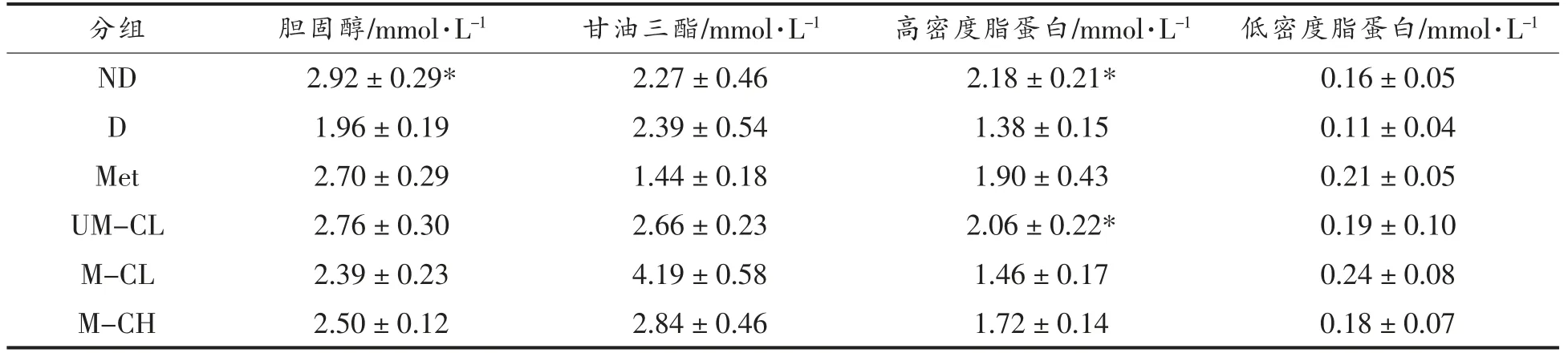
表2 粗提物对大鼠血脂的影响Table 2 Effect of crude extract on blood lipid in rats
2.4 生、熟小米提取物的DPPH 清除能力
如图2所示。各提取物对DPPH 的清除效果与样品浓度呈剂量依赖关系。各提取物的抗氧化能力存在较大差距,在样品质量浓度为8 mg/mL时,生小米组UM-C、UM-HX、UM-EA、UM-BT、UM-W 的DPPH 清除能力分别为(73.26±0.22)%,(50.91±0.40)%,(48.14±0.74)%,(80.19±1.31)%及(69.91±0.85)%(图2a);熟小米组M-C、M-HX、M-EA、M-BT、M-W 的DPPH 清除能力分别为(85.14±0.43)%,(37.57±0.73)%,(74.29±0.16)%,(87.61±0.32)%,(65.61±0.5)%(图2b)。由图2a 和图2b 可知,各提取物的DPPH 清除能力为MBT>M-C>UM-BT>M-EA>UM-C>UM-W>M-W>UM-HX>UM-EA>M-HX。可见,通过熟化处理后的M-C、M-BT 的DPPH 清除能力高于UM-C、UM-BT,说明熟化后小米可能具有更好的DPPH清除能力。
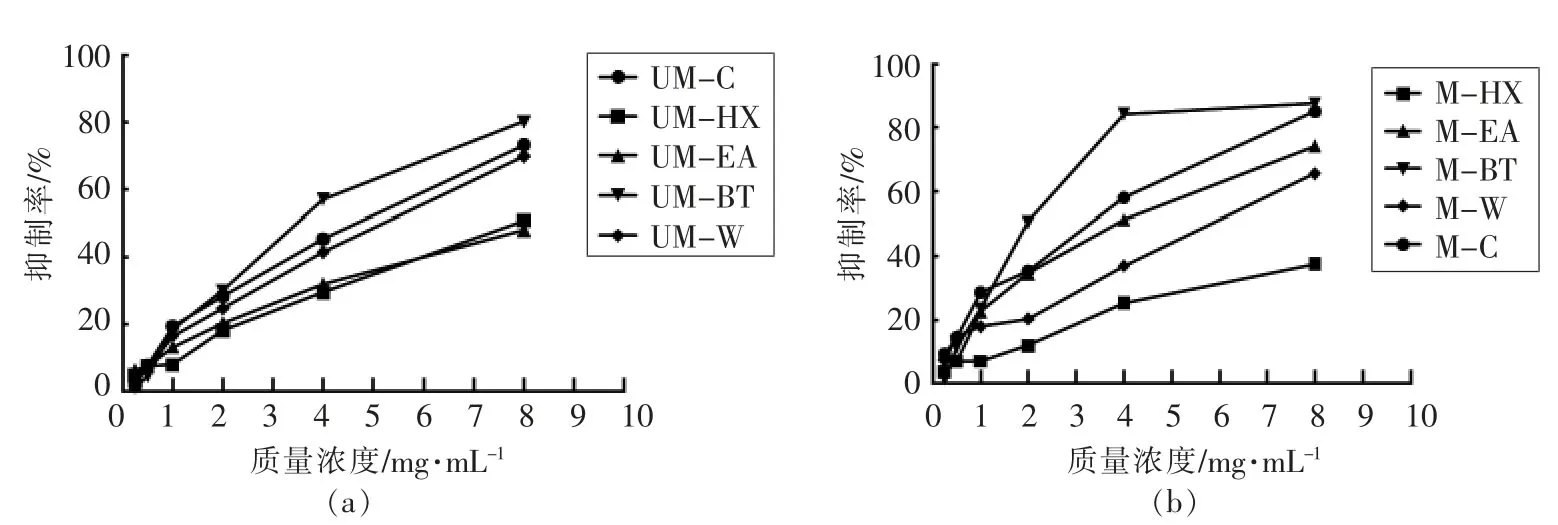
图2 生、熟小米提取物DPPH 清除能力Fig.2 DPPH scavenging capacity of raw and cooked millet extracts
2.5 生、熟小米提取物的总抗氧化能力比较
由图3可知,不同提取物浓度与总抗氧化能力呈剂量依赖关系。当样品质量浓度为30 mg/mL时,UM-C、UM-HX、UM-EA、UM-BT 和UM-W 的总抗氧化能力分别为 (1.25±0.00),(0.33±0.01),(0.50±0.00),(0.93±0.01)及(1.92±0.02)mmol/L/mg(图3a)。说明生小米水提物的抗氧化能力优于有机溶剂相,随提取溶剂极性的减小,相应提取物的总抗氧化能力减弱。当样品质量浓度为30 mg/mL时,M-C、M-HX、M-EA、M-BT 及M-W 的总抗氧化能力分别为 (0.97±0.00),(0.17±0.00),(1.09±0.00),(0.91±0.01)及(1.51±0.01)mmol/L/mg。小米熟化后的70%乙醇提取物、正己烷及水提物总抗氧化能力降低,乙酸乙酯提取物总抗氧化能力升高。
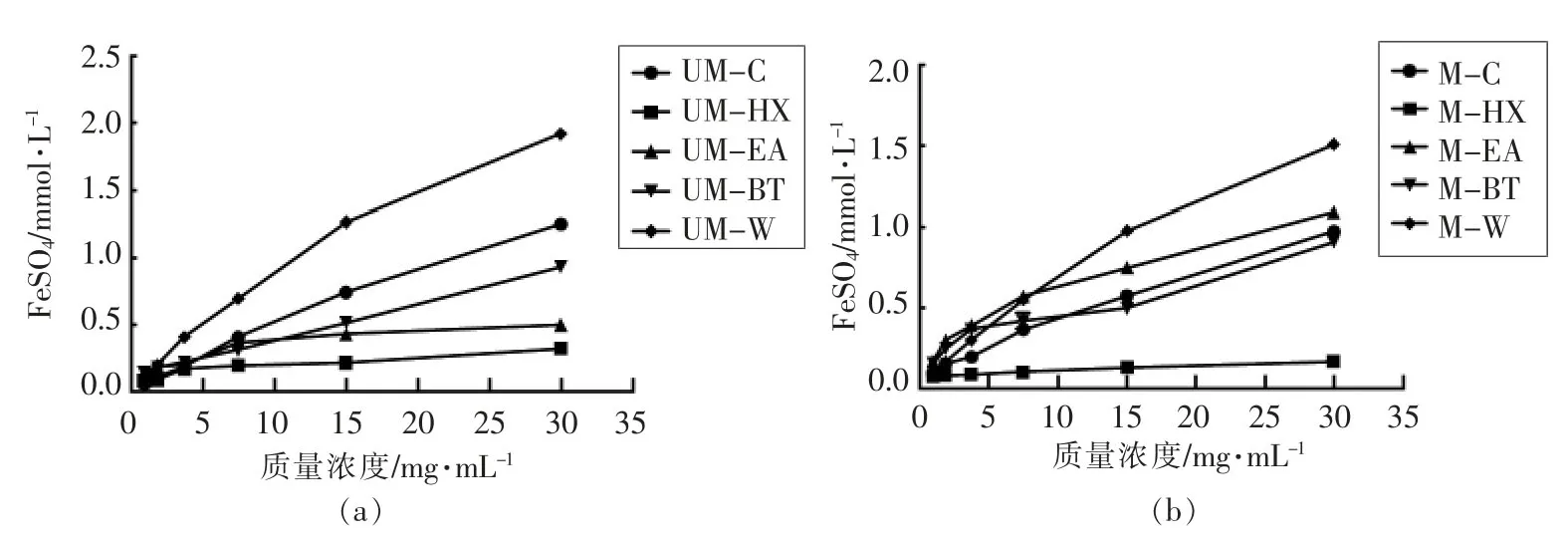
图3 生、熟小米提取物总抗氧化能力Fig.3 Total antioxidant capacity of raw and cooked millet extracts
2.6 各提取物对α-淀粉酶抑制作用
α-淀粉酶抑制剂是一种糖苷酶抑制剂,通过抑制消化道内淀粉酶活性,降低碳水化合物的水解和吸收,从而降低餐后血糖,用于糖尿病的预防与治疗。各提取物对α-淀粉酶作用如图4所示,其中,70%乙醇粗提物、正己烷提取物、乙酸乙酯提取物及正丁醇提取物对α-淀粉酶均有一定的抑制作用,而水提取对α-淀粉酶则有促进作用。说明在小米中,起到降低餐后血糖作用的物质主要集中在70%乙醇粗提物、正己烷提取物、乙酸乙酯提取物及正丁醇提取物中,在0.125~8.00 mg/mL 范围内,这4 种提取物对α-淀粉酶的抑制作用随浓度的增高而增强。在样品质量浓度4~8 mg/mL 范围内,抑制作用趋于平稳,整体的抑制率未达到50%。当质量浓度为8 mg/mL 时,UM-C、UM-HX、UM-EA 及UM-BT 的抑制率分别为(29.89±0.64)%,(40.06±1.66)%,(40.86±0.26)%及(31.47±0.76)%(图4a)。
熟小米提取物对α-淀粉酶作用结果与生小米类似,M-W 有较强的酶促进作用。而M-HX 及M-EA 对酶的抑制作用相近(图4b)。当质量浓度为8 mg/mL 时,M-C、M-HX、M-EA、M-BT 的α-淀粉酶作用分别为 (13.61±2.94)%,(39.61±0.36)%,(39.00±0.01)%,(21.08±1.85)%。
由图4a、图4b 和表3可知,各提取物的α-淀粉酶抑制作用为UM-EA>UM-HX>M-HX>MEA>UM-BT>UM-C>M-BT>M-C。除M-HX、MEA、UM-HX 及UM-EA 相近外,其它两种熟小米提取物的酶抑制作用都低于生小米相应的提取物,说明小米中抑制α-淀粉酶活性的物质具有热敏性。但无论是生小米还是熟小米提取物的酶抑制作用都不及阳性对照阿卡波糖 (IC50为0.545 mg/mL)。
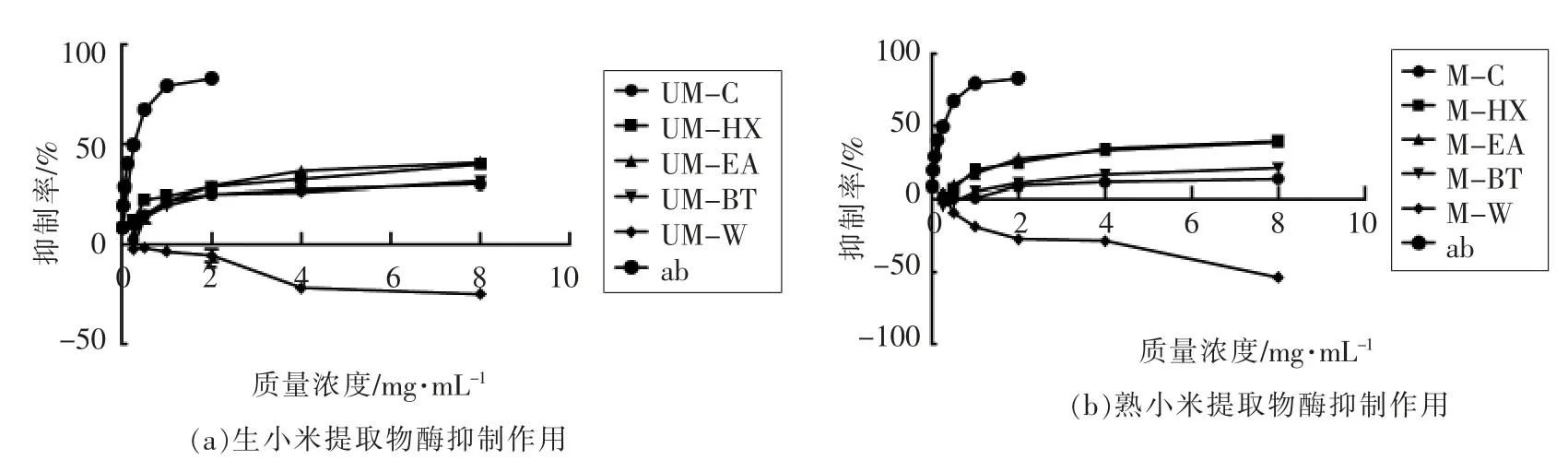
图4 生、熟小米提取物α-淀粉酶抑制率Fig.4 Inhibitory of α-amylase activities of raw and cooked millet extracts
3 讨论
小米作为一种粮食作物,其主要成分为淀粉、蛋白、脂肪、膳食纤维,还包含一些微量物质如多酚、胡萝卜素等。小米中的类黄酮主要为黄酮类化合物,有异/东方红素、异/牡荆素、木犀草素、芹菜素等[10]。有研究表明异/东方红素及异/牡荆素等黄酮类化合物可有效抑制α-淀粉酶作用,调节餐后高血糖,调节由高糖诱导的炎症反应,降低糖尿病并发症及粥样动脉硬化[11-12]。70%乙醇提取物中富含丰富的蛋白、黄酮及维生素,赋予了其较高的生物活性[13]。与本研究结果一致,小米70%乙醇提取物对糖尿病大鼠的糖脂代谢具有一定的调节作用,并且生、熟小米的差距较大。其中生小米70%乙醇提取物的降糖效果显著高于熟小米70%乙醇提取物。生小米70%乙醇提取物虽然不会降低大鼠血清中TG、TC 含量,但可显著提高HDL 含量。为进一步确定小米中的降糖活性成分,利用不同极性溶剂对粗提物进行分级萃取,得到4 种溶剂萃取物。通过抗氧化活性及酶抑制作用进一步比较,发现具有较高抗氧化活性的水提物,对α-淀粉酶反而有促进作用。这可能是由于水提物中的某类物质改变了催化α-淀粉酶所需的3 个酸性氨基酸残基从而促进了α-淀粉酶。有待进一步确定水提物中的成分及与α-淀粉酶的作用,才能更好地解释促进作用机制。抗氧化活性很低的正己烷提取物有较好的酶抑制作用,说明降糖效果的高低与抗氧化活性并无必然关系,小米中主要起降糖作用的物质集中在极性较低的溶剂中。熟化后,正己烷萃取物的DPPH 及总抗氧化能力均降低,但是酶抑制作用没有改变,说明起降糖效果的物质为非热敏性组分。而正己烷萃取物中主要富集脂肪酸类物质,小米中脂肪酸含量为2.54%~5.85%,大部分品种在4.00%左右,高于大米和小麦,并且脂肪酸结构合理。脂肪酸组成中,油酸、亚麻酸、亚油酸含量在75.00%以上,其中亚油酸为主要脂肪酸。有研究表明亚油酸可降低血脂及改善血糖。而熟小米70%乙醇提取物的降糖效果低于生小米70%乙醇提取物,可能是由于其中水溶性成分负面作用的增强。有待对小米降糖组分筛选及降糖机制进一步研究。
4 结论
生、熟小米提取物的抗氧化及降糖能力存在差异。其中生小米70%乙醇提取物可显著改善糖尿病大鼠的糖代谢异常,而熟小米70%乙醇提取物没有此效果。除乙酸乙酯提取物外,熟化降低了小米萃取物的总抗氧化活性;但提高了70%乙醇提取物及正丁醇萃取物的DPPH 清除能力。抗氧化较低的低极性溶剂正己烷及乙酸乙酯萃取物有较好的α-淀粉酶抑制作用,并且降糖物质为非热敏性。
