迪庆州核桃种质资源的遗传多样性与遗传结构*
2021-04-22陆婷陈少瑜吴涛肖良俊
陆婷,陈少瑜,吴涛,肖良俊
(1.云南省林业和草原技术推广总站,云南 昆明 650224;2.云南省林业和草原科学院 经济林研究所,云南 昆明 650201;3.云南省林业和草原科学院/云南省森林植物培育与开发利用重点实验室/国家林业和草原局云南珍稀濒特森林植物保护和繁育重点实验室,云南 昆明 650201)
胡桃属(JuglansL.)植物在世界上有23个种,我国有13个种[1],其中分布较广且栽培较多的是核桃(J.regia)和深纹核桃(J.sigillata)2个种[2]。深纹核桃广泛分布于西南地区,为我国特有种[3],云南作为深纹核桃的主要分布区之一,深纹核桃栽培历史悠久,种质资源非常丰富。迪庆藏族自治州位于滇西北,滇、藏、川3省(区)交界处,世界上著名的“三江并流”腹心地带,其间高山峡谷纵横,境内海拔最高处是6 740 m的梅里雪山主峰卡瓦格博峰,最低处海拔为1 486 m的澜沧江河谷,绝对高差5 254 m,小范围内的巨大高差导致了境内的垂直气候和立体生态环境[4]。经初步调查此区域核桃种质资源具有丰富的多样性,然而,随着近年来核桃产业的发展,良种和无性系的推广种植,核桃天然资源遭到破坏,致使当地核桃种质资源遗传多样性逐渐丧失。开展核桃种质资源遗传多样性研究是对资源科学保护和利用的重要理论基础,因此在了解迪庆州核桃种质资源的遗传多样性水平及遗传结构特征基础上,制定并积极采取科学的保护和开发利用措施显得尤为必要。
作为评价遗传多样性的一种重要技术,DNA分子标记广泛应用于各种植物的多样性研究中[5]。在最为常用的几种分子标记技术中,简单重复序列(simple sequence repeats,SSRs)标记是基于PCR的核酸多态检测技术,具有灵敏性和稳定性高、通用性强、共显性等优点,广泛用于植物的指纹分析、品种鉴定、遗传结构和系统进化等研究中[6-8],对于核桃种质资源的遗传多样性也有一些研究报道[9-13],但对迪庆州核桃种质资源的遗传多样性状况仍未有了解。本研究基于SSR分子标记技术对云南省迪庆藏族自治州3个群体共161份深纹核桃种质资源进行遗传多样性分析,揭示资源的遗传多样性水平及遗传结构特征,为其保护和利用提供科学依据。
1 材料与方法
1.1 研究地概况及材料来源
迪庆藏族自治州位于云南省西北部(90°35′~100°18′ E,26°52′~29°16′ N),地处青藏高原东南边缘,横断山南段北端,滇、川、藏3省(区)交界处。全州土地面积23 870 km2,平均海拔3 380 m,最高海拔为梅里雪山主峰卡瓦格博峰(6 740 m),最低海拔为澜沧江河谷(1 486 m)。迪庆州属温带-寒温带气候,年平均气温10.6 ℃,年极端最高气温25.1 ℃,最低气温-27.4 ℃,该州辖德钦县、维西傈僳族自治县和香格里拉市,3个县(市)皆有核桃的分布。
试验分析的161份深纹核桃单株样品分别采自迪庆州的3个县(市)(各单株相距100 m以上),每个县(市)的资源作为1个群体进行遗传多样性分析,3个群体的地理信息及样本数量见表1。以采集的单株穗条(二倍体)作为1个样本,穗条采回后取韧皮提取DNA。

表1 核桃群体的地理信息及样本数量
1.2 试验方法
1.2.1 核桃基因组DNA的提取
核桃基因组DNA的提取采用改进的CTAB法[14],其浓度和纯度用1%的琼脂糖凝胶电泳及紫外可见分光光度计(thermo scientific)进行检测,将DNA样品浓度用Tris-EDTA缓冲液调至20 ng/μL,-20 ℃冰箱保存备用。
1.2.2 引物确定及SSR-PCR扩增和扩增产物的毛细管电泳检测
参照陈少瑜等[15]的方法,用20对初步筛选的引物[16]对3个群体中随机抽取的3~5份样品进行扩增,丙烯酰胺电泳确定有扩增结果且条带清晰稳定的引物。将确定的引物用以全部样品的扩增,扩增结果采用毛细管电泳[17]检测记录。
1.3 统计及分析
将检测到的SSR片段录入Exel表,利用GenAIEx 6.5[18]及POPGENE 1.32[19]计算分析群体的观察等位基因数(Na)、有效等位基因数(Ne)、观察杂合度(Ho)、期望杂合度(He)、Shannon信息指数(I)等遗传多样性参数;群体间的遗传距离(D)、遗传一致度(I)、F-统计量(FIS、FIT、FST)及基因流(Nm)[20]等群体遗传分化参数。
基于群体的遗传距离,运用Mega 6.06软件进行UPGMA聚类并绘制各群体遗传关系树状图[21]。
利用STRUCTURE 2.3.2软件分析核桃群体的遗传结构[22]。将聚类参数K设置为2~15,每个K值独立重复运算10次,运行参数“Length of Burn-in Period”为10 000次,“Number of MCMC Reps of Burning”设为100 000次。采用ΔK值最大原则选取最佳K值[23],结果通过Distruct软件[24]绘制群体遗传结构图。
2 结果与分析
2.1 引物及扩增结果
经丙烯酰胺电泳检测最终确定18对引物用以161份样品的扩增,引物序列及相关信息参见文献[16],扩增结果列于表2。由表2可见,18对引物对161份样品扩增片段的大小为96~250 bp,共检测到171个等位基因,平均每个引物检测到9.5个等位基因,其中引物CUJRB103a和CUJRB220检测到的等位基因最多(各16个),引物JUG-13和ZMZ-11的最少,分别只有3个。

表2 18对SSR引物及扩增结果
2.2 核桃群体的遗传多样性
18对引物对3群体161份样品的扩增结果经POPGENE 1.32软件分析得到群体的遗传多样性参数(表3)。由表3可见,3个群体的观察等位基因数(Na)的变化范围为5.556~7.111,平均为6.574;有效等位基因数(Ne)的变化范围为2.862~3.174,平均为3.030;观察杂合度(Ho)的变化范围为0.390~0.580,平均为0.467;期望杂合度(He)的变化范围为0.580~0.619,平均为0.598;Shannon信息指数(I)介于1.153~1.313之间,平均为1.231,3个群体的多态位点百分率(P)均为100%。除了多态位点百分率,各群体的其他遗传参数存在明显差异。综合比较3个群体的遗传参数可以发现,维西群体的Ne、He和I最高(Ne=3.174,He=0.619,I=1.313),德钦群体的最低(Ne=2.862,He=0.580,I=1.153),说明3个群体中维西群体拥有相对较高的遗传多样性,德钦的相对较低。
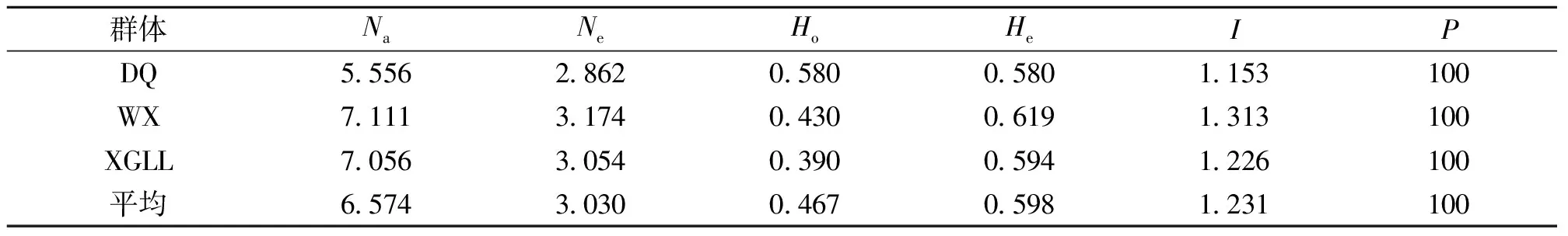
表3 迪庆州3个核桃群体的遗传多样性
2.3 核桃群体的遗传分化及遗传结构
表4显示了迪庆州3个核桃群体间遗传分化状况。由表4可知,群体间的近交系数(FIS)介于-0.168 5~0.495 9之间,平均为0.218 7,其中1个位点(JSI-63)杂合子过剩。群体间的遗传分化系数(FST)介于0.005 2~0.225 3之间,平均为0.065 2。数据表明遗传变异主要存在于群体内,来源于群体间的遗传变异只占总变异的6.52%。各位点的基因流(Nm)差异较大,变化范围在0.859 5~9.454 9之间,平均为4.266 3。
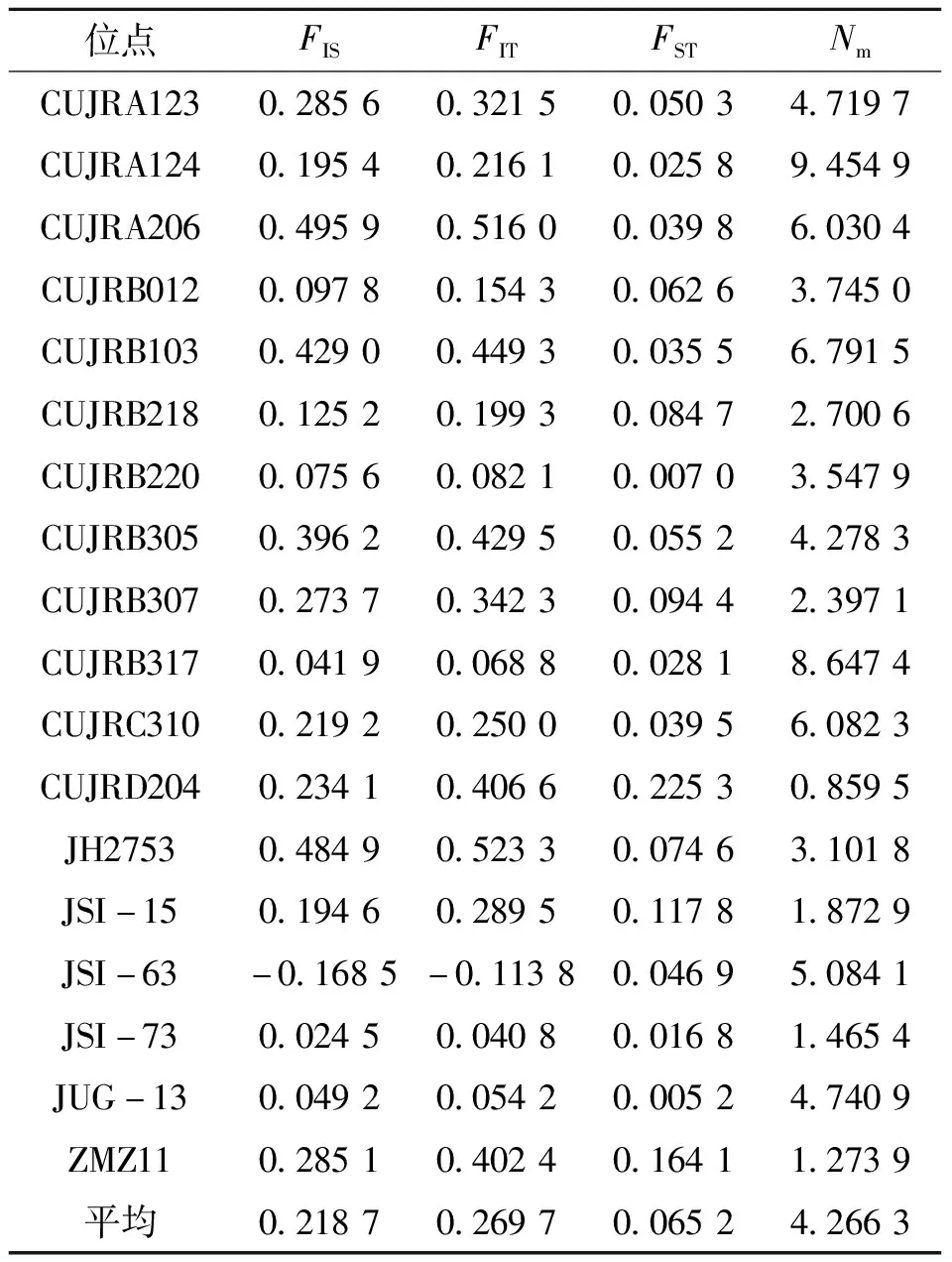
表4 迪庆州3个核桃群体的遗传分化与基因流
利用STRUCTURE分析迪庆州核桃种质资源群体的遗传结构,当K=3时ΔK值最大(图1),表明161份核桃资源具有3个不同类群(图2),红色、绿色和紫色分别代表3个类群,由图2可见虽然类群间存在一定的遗传混杂和基因交流现象,但仍可看出较为明显的分化,其中德钦群体遗传混杂程度相对较小,维西和香格里拉群体较为相似,3个类群的单株基本均匀分布。

图1 最佳类群数(K)与推断值(ΔK)的关系
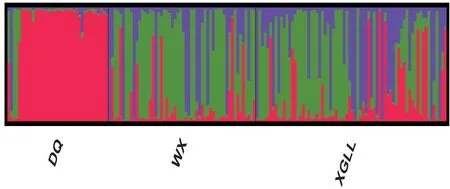
图2 基于STRUCTURE分析的迪庆州3个核桃群体的遗传结构
2.4 群体间的遗传关系及UPGMA聚类
为了进一步了解迪庆州3个核桃群体间的遗传关系,利用群体间的Nei’s遗传距离(表5)进行UPGMA聚类。由表5可见,3个群体遗传距离(D)的变化范围为0.127 8~0.201 3。其中,维西和香格里拉的遗传距离最小(D=0.127 8),维西和德钦的遗传距离最大(D=0.201 3)。从聚类图(图3)可以看出,3个群体在遗传距离0.13处可以划分成2个组,维西和香格里拉聚为一组,德钦单独为一组。

表5 迪庆州3个核桃群体间的Nei’s遗传距离(D)与遗传一致度(I)
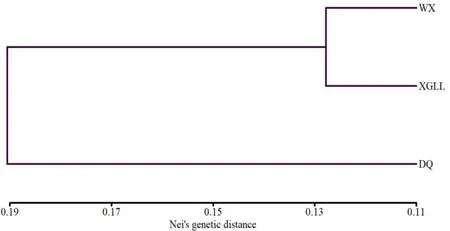
图3 基于Nei’s遗传距离的3个群体的UPGMA聚类图
3 讨论与结论
遗传多样性是物种长期生存和保持进化的基础[25]。通常采用Shannon’s信息指数(I)和期望杂合度(He)作为评估群体遗传多样性的重要指标,其中He不仅可以衡量群体的遗传多样性,还可以反映群体中等位基因的丰富度和均匀程度[26-27]。本研究中,3个核桃群体He的平均值为0.598,I的平均值为1.231,高于此前刘晓丽等[28](He=0.282;I= 0.422 5),Wang H 等(He=0.525[9];He=0.586[11])以及吴涛等[16](He=0.591;I= 1.157)基于SSR分子标记的核桃群体(J.regia或J.sigillata)的遗传多样性,低于王滑等(He=0.617[26];He=0.678[29]),徐永杰等[10](He=0.657;I= 1.324)采用相同分子标记技术对核桃群体的遗传多样性研究结果。可见,迪庆核桃种质资源的遗传多样性处于中等水平。
评估一个树种的遗传多样性对于这个树种的基因保存和优树选择非常重要[30-31]。一个物种遗传多样性和它的生活史和生态特征密切相关,通常稀有种、特有种、分布范围狭窄的物种具有较低的遗传多样性,广布、异交、动物传播种子的物种会有较高的遗传多样性[32]。其次,繁育系统、遗传漂变、基因突变、基因流等内部因素,环境变化、人为干扰等外部因素对一个物种的遗传多样性水平及分布格局有很大影响[33]。本研究的对象深纹核桃是我国特有种,在云南分布广泛,全省127个县海拔850 ~2 900 m范围内均有栽培和分布[34-35]。此外,迪庆州具有垂直气候和立体生态环境,再加之核桃的异花授粉,实生后代遗传基础多样、变异丰富,以上诸多因素导致了该区域核桃种质资源的遗传多样性水平较高。然而,生境的片段化以及其他诸如种质交换、良种推广种植、野生资源砍伐等人为干扰又降低了种质的遗传多样性水平。其中生境的片段化会减小有效种群规模,降低物种的适应能力,引起某些等位基因的消失,造成群体遗传多样性的丧失[36],同时,有效种群规模的下降会增加种群的近交频率,进而降低物种的遗传多样性及生产能力[37]。本研究分析的18个位点中仅有JSI-63位点的近交系数小于0(FIS=-0.168 5),其他位点的近交系数均大于0,杂合子不足,数据表明迪庆州核桃种质资源群体内存在近亲繁殖,缺乏足够的杂合子(Ho= 0.467,He= 0.598,Ho 遗传分化系数(FST)可以很好地反映群体的遗传结构[32]。迪庆州3个核桃群体的遗传分化系数FST=0.065 2,数据表明遗传变异主要来自群体内的个体间。此分化系数高于Victory E 等采用SSR分子标记对黑核桃居群的研究结果(FST=0.017)[38],低于Wang H等采用SSR标记对西藏核桃居群(FST=0.103)和泡核桃居群(FST=0.111)的研究结果[11],低于王滑等对中国8个核桃居群(FST=0.196)的研究结果[26],比较结果表明迪庆州核桃群体间的遗传分化水平较低。 基因流(Nm)是影响群体间遗传变异程度的重要因素[20],一般来说,大的基因流可以阻止群体间的遗传分化,因此基因流大的物种,群体间的遗传分化较小[39]。Hamrick等研究结果,当Nm>1时,基因流就足以抵制遗传漂变的作用,阻止群体间的分化;当Nm<1时,遗传漂变便会导致群体间的遗传分化[40]。迪庆州3个核桃群体Nm的平均值为4.266 3(Nm>1),表明基因交流抵制了遗传漂变的作用,降低群体的遗传分化水平,这与陈良华等对四川核桃资源的遗传多样性研究结果相似[41]。Nm一方面与物种的繁殖方式、地理分布有关,另一方面与环境变化和人为活动密切相关。作为一种非常重要的经济林树种,核桃尽管以异交为主,但其风媒传粉、种子或嫁接繁殖、人为实生选种以及种质交换等因素都强化了群体间的基因交流,这些应该是群体遗传分化较低的主要原因。 基于遗传距离的UPGMA聚类显示迪庆州的3个核桃群体,维西群体和香格里拉群体间的遗传距离最小,在遗传距离0.13处聚为一组;德钦群体和维西群体的遗传距离最大,另外成为单独的一组。STRUCTURE分析将161份资源分成3个类群,类群间存在一定的遗传混杂和基因交流,但也存在较为明显的分化,其中维西和香格里拉群体间的分化较小,德钦群体与二者的分化相对较大,与UPGMA聚类结果相同。德钦核桃群体海拔为1 992~2 750 m,维西群体1 450~2 300 m,香格里拉群体1 680~2 560 m,德钦核桃群体相对于其他2个群体资源分布的海拔较高;其地理位置与深纹核桃的另一个主要分布区西藏相邻,与西藏深纹核桃种质产生基因交流,以上因素有可能是导致3个核桃群体的遗传结构和聚类结果的主要原因。 遗传多样性是资源利用的基础,本研究揭示了迪庆州深纹核桃种质资源中等水平的遗传多样性,具有进一步选育利用的价值和潜力。3个群体中,维西群体的遗传多样性相对较高,开展核桃资源选育和保护工作时,维西应作为重点选择群体,德钦群体分布海拔较高,可作为高海拔特征优株的选择群体。此外,因迪庆州深纹核桃群体间的遗传分化水平较低,应侧重于群体内单株的选择。
