TTK1在卵巢癌铂类耐药中的生物学功能分析
2021-04-22刘懿萱文泽轩卢仁泉
刘懿萱,文泽轩,郭 林,卢仁泉
1.复旦大学附属肿瘤医院检验科,复旦大学上海医学院肿瘤学系,上海 200032;2.复旦大学公共卫生学院流行病学教研室,上海 200030
卵巢癌是女性常见的生殖系统恶性肿瘤之一[1]。尽管有研究[2]显示,早期卵巢癌患者术后5年生存率可达80%~90%,但卵巢癌起病隐匿,早期缺乏明显临床症状,因此大部分患者发现时已处于肿瘤晚期,失去了根治性切除的机会。目前以铂类为主的药物治疗仍然是卵巢癌治疗不可或缺的手段,虽然大多数患者经手术和术后化疗可获得完全缓解,但还是有80%的患者会在治疗后2年左右复发,随着化疗药物使用时间的延长,几乎所有患者最终都会对化疗药物产生耐药,化疗耐药是导致卵巢癌患者预后差的主要原因[3]。通过铂类药物的细胞毒作用从而达到杀伤卵巢癌细胞的目的,其主要机制是形成铂-DNA交联物,造成肿瘤细胞基因组高度不稳定,干扰DNA复制与转录。因此,卵巢癌细胞能否有效地应对铂类药物造成的DNA损伤是铂类药物是否发挥作用的关键。卵巢癌患者一旦发生铂类药物耐受,就会严重影响临床治疗效果。探索导致卵巢癌细胞铂类药物耐受的关键基因,并阐明其作用机制,对于卵巢癌患者的诊断、治疗和预后预测都具有重要意义。
肿瘤细胞主要通过细胞DNA损伤修复能力增强,细胞对药物产生拮抗作用,药物在被细胞吸收后失活以及细胞生长因子或抗凋亡蛋白的增加等几种途径对铂类药物产生耐受性,但DNA损伤修复能力增强是最关键因素[4]。尽管临床上已经开发了多种新型化疗药物和化疗方案,但当前化疗的整体效果并不理想,解决卵巢癌患者临床耐药问题已成为进一步提高疗效、改善患者预后的关键。
苏氨酸酪氨酸激酶1(threonine tyrosine kinase 1,TTK1)作为一种经典的细胞周期依赖性蛋白激酶,是纺锤体组装检查点的必需组分,可确保染色体的正确分离[5]。TTK1的高表达使得细胞在分裂期间经历大量的染色体倍增或缺失,从而可能损害其正常的生理功能。有研究[6-7]表明,TTK1可通过调控纺锤体组装检查点的方式保护细胞基因组的稳定性,因此,TTK1的高表达对于肿瘤细胞在铂类药物造成细胞毒性的环境中维持细胞增殖可能至关重要,TTK1在多种肿瘤组织中高表达,是乳腺癌、肺癌、脑肿瘤和结直肠癌预后不良的预测因子,然而TTK1在卵巢癌铂类耐药中的报道少见。
本研究利用生物信息学分析,筛选与TTK1相互作用的基因,进行生物学功能分析,并建立耐药机制网络模型,结合RNA测序(RNA-sequencing,RNA-seq)分析TTK1在铂类耐药的卵巢癌细胞中的相关信号通路。
1 材料和方法
1.1 蛋白间相互作用网络的构建和分析
通过STRING数据库(https://string-db.org/)v11.0[8]进行基因间相互作用分析。STRING数据库可以研究蛋白间相互作用网络,有助于挖掘核心的调控基因。
1.2 差异表达基因的数据分析
对敲低TTK1的铂类耐药卵巢癌细胞和对照组细胞RNA的测序结果,应用edgeR软件包[9]对表达量M-值的加权截尾均值(trimmed mean of M-values,TMM)和每一百万次读数的记数(counts per million reads,CPM)标准化,筛选至少一个在样本中表达值CPM大于1对的基因进行差异分析比较。显著差异表达基因的筛选标准为:adjustP<0.05且|logFC|≥1。
1.3 基因富集分析
使用基因本体论(gene ontology,GO)对相关基因进行生物学过程、分子功能和细胞组分分析。使用京都基因与基因组百科全书(Kyoto Encyclopedia of Genes and Genome,KEGG)对相关基因进行通路富集分析。
1.4 芯片数据的获取与预处理
从GEO(http://www.ncbi.nlm.nih.gov/geo/)下载GSE114206基因芯片原始数据[10],平台为GPL13497,芯片探针的注释来自美国Agilent Technologies公司,含34 184条信息。利用美国国家生物技术信息中心(National Center of Biotechnology Information,NCBI)提供的GEO2R平台检测,将全部数据保存为Excel格式,利用R软件中的clusterProfiler包对芯片结果进行处理并进行通路富集。
1.5 细胞培养
铂类耐药细胞系A2780DDP由复旦大学附属肿瘤医院罗建民赠予,在含有铂类药物的培养基中继续诱导。HOSPIC、A2780和A2780DDP均在含10%胎牛血清(美国Gibco公司)和1%青霉素-链霉素(美国Gibco公司)的RPMI-1640培养基(美国Gibco公司)中培养。HEK-293T细胞在含10%胎牛血清和1%青霉素-链霉素的DMEM培养基(美国Gibco公司)中培养。
1.6 免疫组织化学
操作步骤请参照参考文献[11]。免疫组织化学分析使用抗TTK1鼠抗体(sc-376842,美国Santa Cruz公司),用磷酸盐缓冲液(phosphate-buffered saline,PBS)以1∶50稀释。卵巢癌组织和卵巢癌耐药组织取自2014—2016年复旦大学附属肿瘤医院妇科收治的卵巢癌患者,并通过病理学检查确诊。该研究得到复旦大学附属肿瘤医院伦理委员会的批准,所有患者均签署书面知情同意书。
1.7 建立TTK1敲低的卵巢癌细胞株
使用RNAi Designer程序设计短发夹RNA(short hairpin RNA,shRNA),序列见表1。将shRNA克隆到pLKO.1-puro双酶切质粒(Age1和EcoR5)(美国Addgene公司)中构建重组质粒。使用LipofectamineTM3000转染试剂(美国Invitrogen公司)将重组质粒、包装质粒psPAX2和包膜载体pMD2.G(美国Addgene公司)以4∶3∶1转染到HEK-293T细胞中。48 h后收集病毒上清液,于4 ℃低温下4 000×r/min离心10 min后过滤,使用浓度为8 µg/mL的凝聚胺溶液(美国Sigma公司)将其转移到A2780DDP中感染24 h。使用2 mg/mL的嘌呤霉素(美国Sigma-Aldrich公司)筛选稳定转染的细胞7 d。最后通过蛋白质印迹法(Western blot)验证敲低效率。
表1 shTTK1序列Tab.1 Sequence of shRNA
1.8 Western blot
具体操作方法参照参考文献[11]。TTK1鼠抗体(sc-376842,美国Santa Cruz公司)以1∶500稀释,β-actin鼠抗(60008-1-lg,武汉三鹰生物技术有限公司)以1∶3 000稀释,PI3K(4257,美国Cell Signaling Technology公司)以1∶1 000稀释,p-PI3K(4228,美国Cell Signaling Technology公司)以1∶1 000稀释,AKT(4685T,美国Cell Signaling Technology公司)以1∶1 000稀释,p-AKT(4056,美国Cell Signaling Technology公司)以1∶1 000稀释,NF-κb(ab114150,美国Abcam公司)以1∶500稀释,p53(ab26,美国Abcam公司)以1∶500稀释,TNF-α(6954S,美国Cell Signaling Technology公司)以1∶1 000稀释。
1.9 细胞免疫荧光
将细胞以适当密度接种于24孔板的盖玻片上,待细胞长至对数生长期,用预冷PBS洗涤3次,室温下用4.0%多聚甲醛溶液固定10 min,然后用0.5%的Triton X-100进行破膜15 min。牛血清白蛋白封闭1 h后将样品与所需的一抗4 ℃温育过夜。第2天用PBS洗涤一抗,将样品与1∶5 000稀释的二抗(Alexa Fluor 488和594,美国Life Technologies公司)在室温下避光温育45 min。PBS洗涤后,用含有4’,6-二脒基-2-苯基吲哚(4’,6-diamidino-2-phenylindole,DAPI)(美国Invitrogen公司)的Prolong Gold防褪色试剂固定样品。使用多光子共聚焦显微镜系统(LAS-AFLite,德国Leica公司)捕获图像。
1.10 统计学处理
使用R软件进行统计分析,P<0.05为差异有统计学意义。
2 结果
2.1 TTK1相关的生物学功能分析
研究蛋白之间的相互作用网络,有助于挖掘关键的调控基因。首先,通过STRING数据库对10个与TTK1相互作用的相关基因(表2)进行基因之间的相互作用分析(图1A)。然后对11个相互作用的相关基因进行功能富集分析,找到不同条件下显著相关的生物学功能或通路。GO是描述基因功能的综合性数据库,可以分为生物学过程、细胞组成和分子功能3个部分。通过GO富集分析找到与TTK1主要相关的生物学功能(图1B)。发现TTK1参与有丝分裂、细胞分化等过程,在染色体分离过程中发挥重要作用。另外,通过KEGG通路富集分析发现,TTK1相关基因显著富集于细胞周期相关通路(图1C)。铂类药物是否发挥作用其关键就在于卵巢癌细胞能否有效地应对铂类药物造成的DNA损伤[12]。因此,我们构建了耐药机制网络模型,从相关基因的功能中找到与DNA损伤修复、染色体分离和细胞周期相关的生物通路(表3),并结合蛋白相互作用构建调控模型,使用Cytoscape软件实现可视化(图1D)。以上结果表明,TTK1可能通过CDK1作用于p53信号通路,影响细胞周期进而改变肿瘤细胞对铂类药物的敏感性。
2.2 卵巢癌铂类耐药通路分析
芯片GSE114206的样本取自卵巢癌患者,其中铂类耐药患者6例,铂类敏感患者6例。利用GEO2R平台对数据进行处理,获得4 178个差异基因(图2A)。根据adjustP<0.05且|log2FC|≥1的标准,筛选出1 071个上调基因,进行通路富集。GO分析显示,生物学过程方面,上调基因主要参与免疫细胞激活、细胞黏附及细胞因子产生;细胞组成方面,上调基因主要富集在囊泡腔和含胶原蛋白的细胞外基质中;分子功能方面,上调基因主要参与受体-配体活动和细胞因子受体结合(图2B)。KEGG分析显示,通路富集主要集中在细胞因子间受体相互作用和自然杀伤细胞介导的细胞因子相关通路(图2C)。

表2 TTK1相互作用的分子Tab.2 Molecules interacting with TTK1
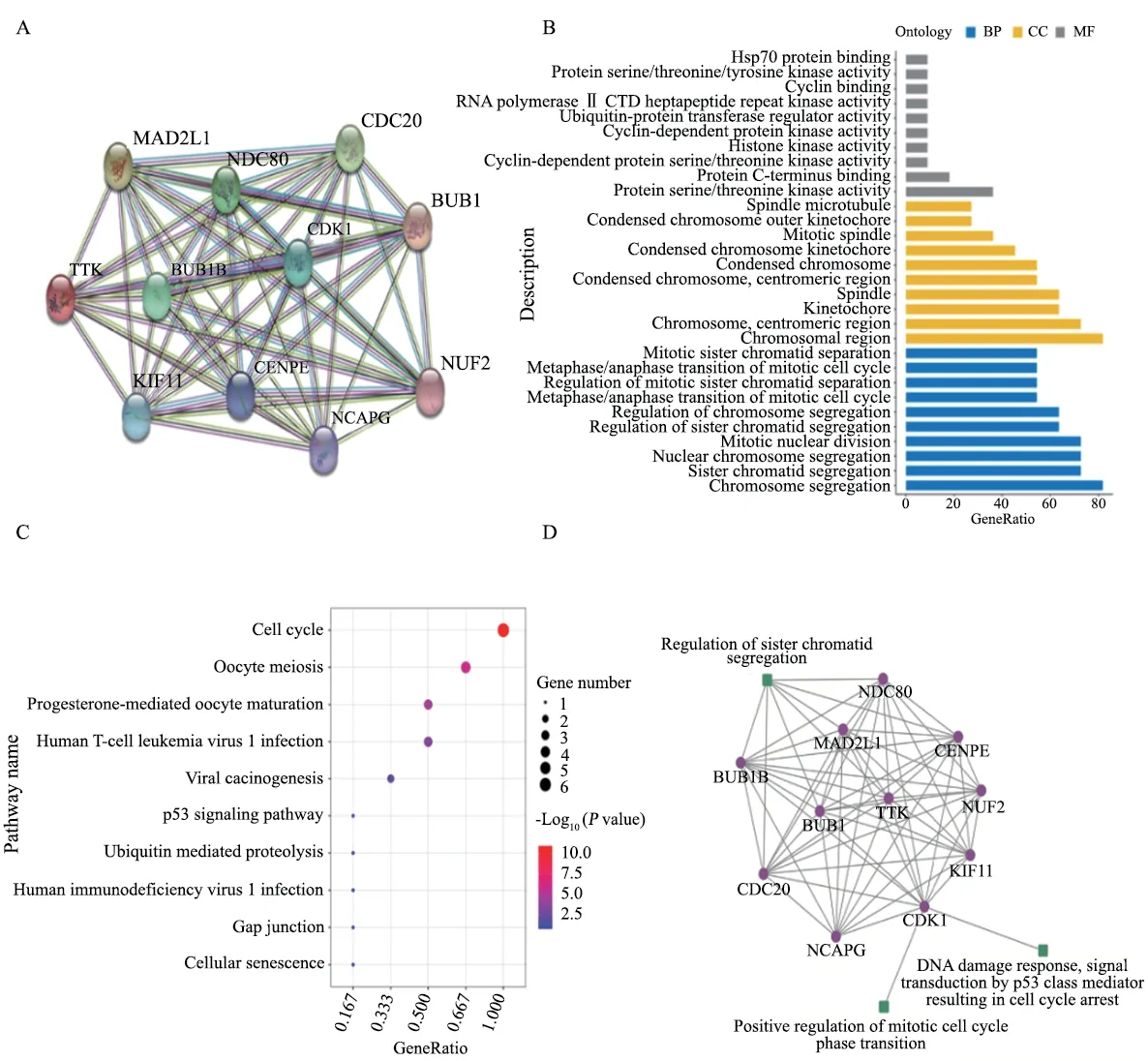
图1 数据库分析TTK1生物学功能Fig.1 Database analysis of biological function of TTK1
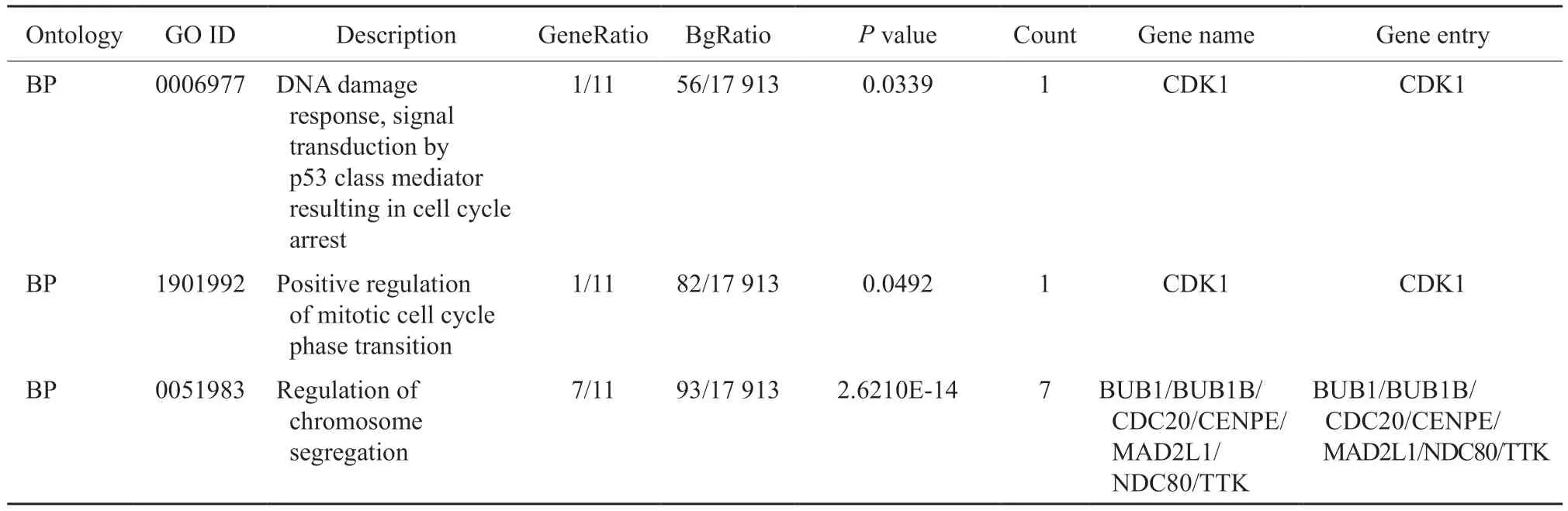
表3 DNA损伤修复、染色体分离和细胞周期相关的生物通路Tab.3 Biological pathways related to DNA damage repair,chromosome segregation and cell cycle
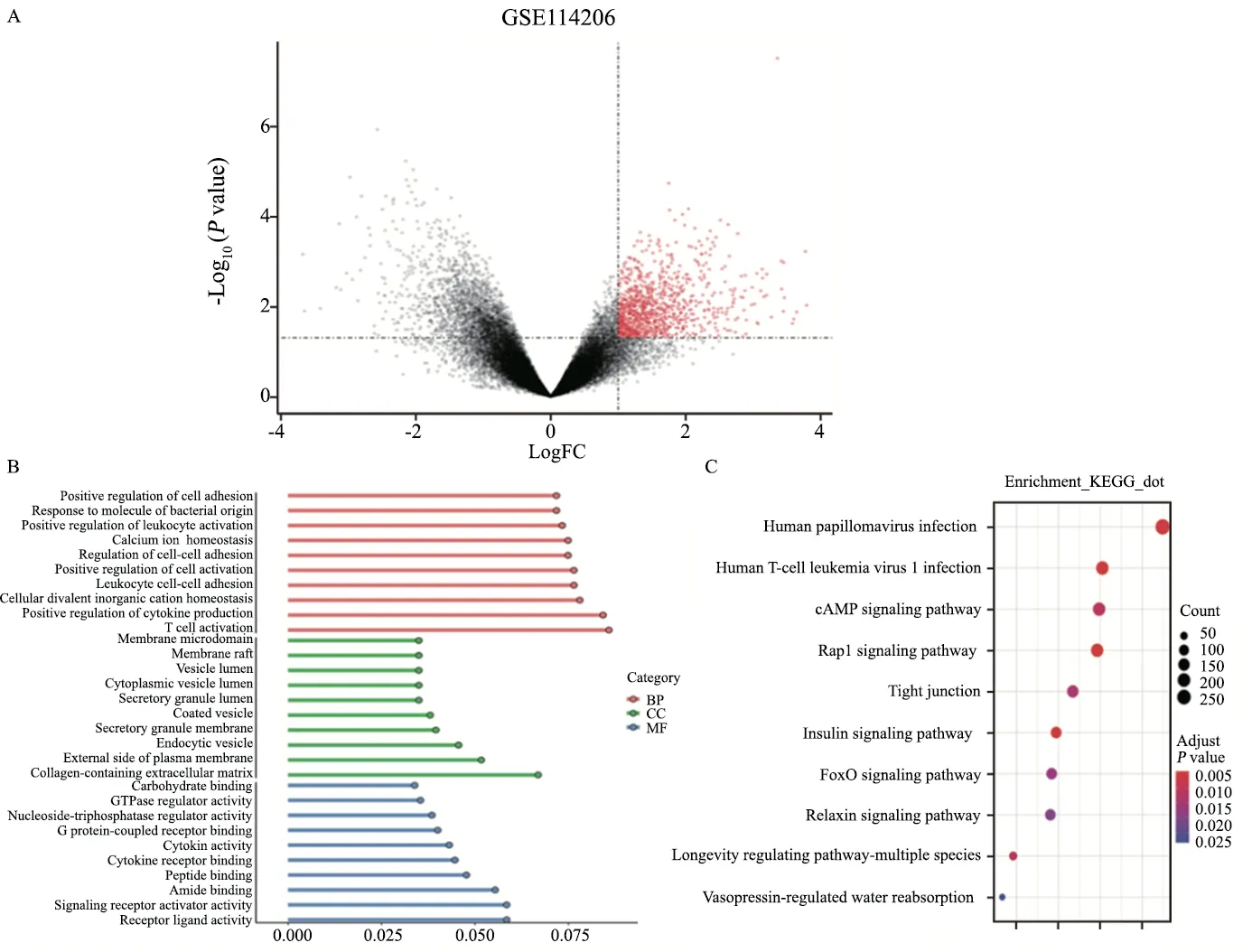
图2 卵巢癌铂类耐药通路分析Fig.2 Analysis of platinum resistance pathway in ovarian cancer
2.3 TTK1在卵巢癌中的表达情况
首先,使用TIMER数据库(https://cistrome.shinyapps.io/timer/)分析多种人类肿瘤中TTK1的表达情况,结果显示,TTK1在多种人类肿瘤中均高表达(图3A)。为研究TTK1在卵巢癌中的表达情况,使用细胞免疫荧光技术在细胞中对TTK1进行定位,用DAPI对细胞核进行染色,发现TTK1存在于细胞质和细胞核中,以细胞质为主(图3B)。接下来分别提取正常卵巢细胞HOSPIC、卵巢癌细胞A2780和铂类耐药的卵巢癌细胞A2780DDP的蛋白检测TTK1的表达情况,发现与卵巢癌细胞相比,铂类耐药后的卵巢癌细胞中TTK1表达明显上调(图3C)。使用免疫组织化学法对患者来源的卵巢癌组织及铂类耐药后的卵巢癌组织进行染色,发现与卵巢癌组织相比,TTK1在铂类耐药后的卵巢癌组织中高表达(图3D)。以上结果提示,卵巢癌发生铂类耐药后TTK1表达上调,证明TTK1可能参与卵巢癌铂类耐药的过程。
2.4 对TTK1敲低的卵巢癌铂类耐药细胞进行测序
为探索TTK1在卵巢癌铂类耐药过程中的作用机制,使用铂类耐药的卵巢癌细胞A2780DDP构建TTK1敲低的细胞株,并分别提取未敲低组与敲低组的细胞RNA进行测序。通过差异表达分析,根据adjustP<0.05并且|log2FC|≥1的标准,筛选出TTK1敲低后的161个上调基因和199个下调基因。对敲低TTK1后下调的差异表达基因进行GO和KEGG通路富集分析。GO通路富集显示,敲低TTK1主要影响耐药细胞中与细胞因子相关的活动(图4A)。为更好地展示KEGG相关信号分子的变化倍率,我们基于差异基因制作了相关热图(图4B)。KEGG通路富集显示,TTK1可能通过影响卵巢癌耐药细胞的TNF信号通路、NF-κB通路、PI3K/AKT通路和p53信号通路等影响卵巢癌细胞对铂类药物的敏感性(图4C),利用Western blot 和实时荧光定量聚合酶链反应(real-time fluorescence quantitative polymerase chain reaction,RTFQ-PCR)分别在蛋白水平和mRNA水平上对测序结果进行验证(图4D)。
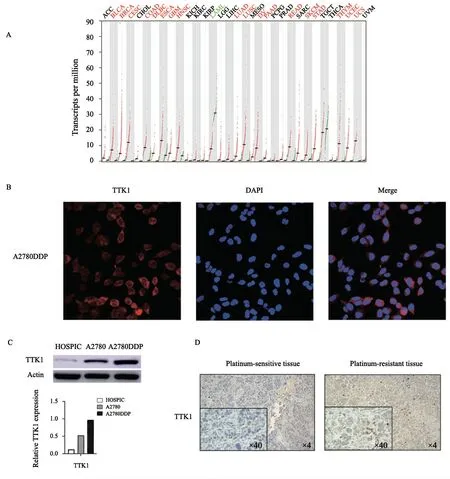
图3 TTK1在卵巢癌中的表达情况Fig.3 The expression of TTK1 in ovarian cancer
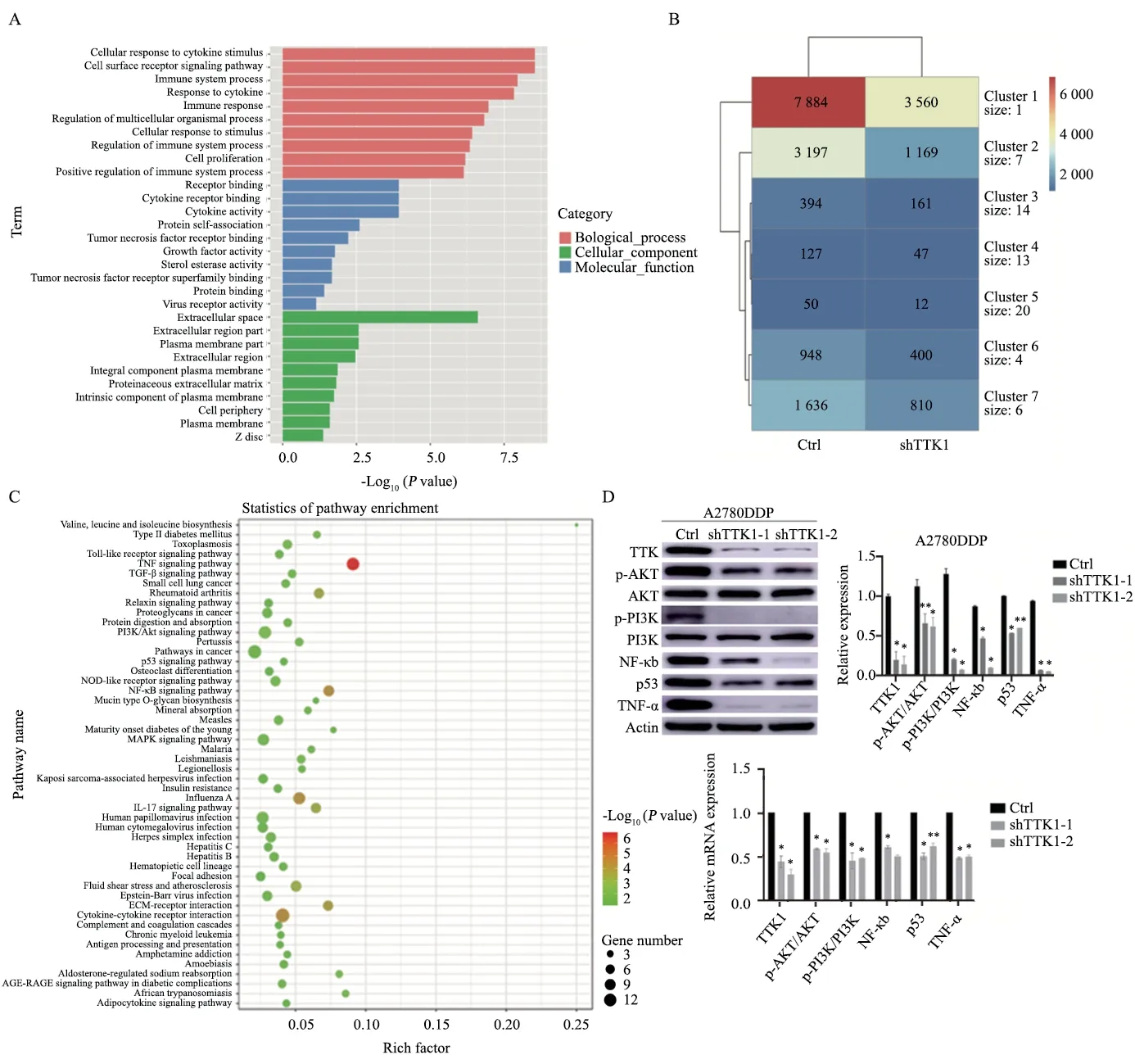
图4 对TTK1敲低的卵巢癌铂类耐药细胞进行RNA-seq结果Fig.4 RNA-seq results were performed on TTK1 knockdown ovarian cancer platinum-resistant cells
3 讨 论
本研究利用生物信息学分析,筛选出10个与TTK1相互作用的基因进行功能富集,并根据相关生物学功能构建耐药模型。同时,根据GEO芯片对卵巢癌铂类耐药后上调的差异基因进行通路富集分析,接着又通过卵巢癌细胞RNA测序结果分析TTK1参与卵巢癌铂类耐药的机制。本研究发现,针对铂类耐药的卵巢癌患者,TTK1相关分子可能成为卵巢癌患者治疗的潜在靶点。
细胞周期对哺乳动物生长发育至关重要,细胞周期相关蛋白变化和异常往往导致肿瘤发生[13]。细胞周期检查点在细胞周期的不同阶段均发挥重要作用,例如,启动基因修复或凋亡信号以确保细胞正常进入下一阶段。因此,细胞周期检查点相关蛋白常被作为治疗肿瘤患者的关键靶点[14]。本研究对TTK1相关基因进行基因富集分析,发现关键基因集中在细胞周期,说明TTK1可能通过细胞周期相关通路发挥生物学功能。
本研究发现,铂类耐药后的卵巢癌组织中TTK1呈高表达,推测TTK1在卵巢癌铂类耐药过程中发挥重要作用。因此,本研究对TTK1敲低的卵巢癌铂类耐药细胞株进行RNA测序,与未敲低组相比,筛选出差异基因进行生物信息学分析。通过KEGG富集通路,本研究发现,敲低TTK1后低表达的基因主要富集于TNF信号通路、NF-κB通路、PI3K/AKT通路和p53信号通路等。p53是一个重要的抑癌基因,参与细胞分化、细胞凋亡、DNA修复、周期调控等重要生物学过程。p53信号通路是铂类药物引起肿瘤细胞DNA损伤的重要途径[15-16]。有研究[17]表明,p53蛋白的聚集损害不同类型肿瘤细胞中p53基因的正常转录及其凋亡功能,并且可以促进卵巢癌发生铂类耐药。本研究结果证明,TTK1可能通过p53的改变而影响卵巢癌对铂类药物的敏感性。有研究[18]表明,PI3K/AKT/NF-κB信号通路参与肿瘤发生、发展、侵袭和转移。PI3K/AKT信号通路在肿瘤细胞的增殖、迁移、侵袭及化疗耐药过程中发挥重要作用[19]。目前,PI3K抑制剂已被应用于治疗多种人类肿瘤(卵巢癌[20]、乳腺癌[21]和淋巴瘤[22])并且展现出较好疗效。本研究通过对比GEO芯片分析结果与细胞RNA测序结果,发现在卵巢癌铂类耐药过程中,细胞因子发挥重要作用,并且TTK1可能通过细胞因子相关通路参与卵巢癌铂类耐药的过程。JAK/STAT信号转导通路是众多细胞因子的共同途径,广泛参与细胞增殖、分化、凋亡及炎症等过程[23]。有研究[24-25]表明,JAK/STAT通路在肿瘤的发生、发展及耐药中发挥重要的作用,可能成为肿瘤治疗的新靶点。
本研究应用生物信息学分析了TTK1相关分子的生物学功能并讨论了TTK1参与卵巢癌铂类耐药的分子机制,TTK1可能通过上述多种途径使卵巢癌产生耐药现象,同时提出基于TTK1抑制剂的联合模式治疗卵巢癌可能成为一种新的治疗模式。
