血小板在抵御细菌感染和增强免疫中的地位
2021-04-22易观群综述谢双锋马丽萍审校
易观群 综述,谢双锋,马丽萍 审校
(中山大学孙逸仙纪念医院血液内科,广东 广州 510120)
很多无脊柱动物和早期脊柱动物有一种血细胞同时具有止血和免疫防御功能。在哺乳动物的进化过程中,细胞类型及其功能变得更加特异,如血小板、白细胞、淋巴细胞分别执行止血、炎症、免疫调节功能[1]。作为止血细胞的血小板,长期以来人们关注更多的是其与出血、血栓性疾病的关系,在其他领域的研究进展不多。尽管在1901年Levaditi就发现霍乱弧菌引起血小板聚集的现象,并提出血小板与细菌直接接触的相关观点[2],但一直以来的研究似乎更多集中在细菌如何激活血小板并诱发血栓。直到1997年,Yeaman 等[3]再次提出和证实血小板仍保留免疫效应细胞的关键结构和免疫防御功能,有关血小板作为细菌感染的“第一哨兵”理论才再次受到重视。随之,使用富血小板血浆(platelet-rich plasma,PRP)或血小板衍生物抗细菌感染开始成为近些年新兴的研究方向。体外研究证实,PRP对金黄色葡萄球菌、耐甲氧西林金黄色葡萄球菌、耐万古霉素肠球菌以及肺炎克雷伯菌和铜绿假单胞菌的生长均有明显的抑制作用[4-5],提示PRP逐渐成为预防术后切口感染、治疗慢性伤口或骨感染的有效补充治疗。PRP与抗菌药物具有协同作用,尤其在抗菌药物耐药时具有独特优势[6-7]。复发性细菌膀胱炎患者膀胱内灌注PRP,能明显降低1年内膀胱炎复发率[8]。可见血小板抵御细菌的地位逐渐得到认可,本文就血小板如何有效抵御细菌的研究进行综述。
1 血小板的特点
血小板是由巨核细胞产生的无核细胞,在外周循环中寿命约为10 d,在此期间大部分以静息的状态存在[1]。虽然血小板无核,但具有巨核细胞残余mRNA,可独立合成蛋白质[9]。血小板还包含许多独特的结构元素,如细胞质膜及其表面的各种分子受体,膜内陷形成的开放微管系统(open canalicular system,OCS)以及细胞颗粒,包括致密颗粒、α颗粒和溶酶体颗粒等[10-11],其中血小板受体和储存在血小板颗粒中的分子很大程度控制着血小板的功能。
血小板表面含有大量的糖蛋白,这些糖蛋白不仅参与血栓的形成和止血,还参与机体的炎症反应。当血小板被激活,部分受体通过脱落、质膜与颗粒的融合表达下调或上调[12-13]。血小板胞内储存三种颗粒,分别为α颗粒、致密颗粒和溶酶体颗粒[14](见表1),有学者提出还有一种潜在的T颗粒[15]。 α颗粒的数量最多(80个/血小板),体积最大(直径200~500 nm),包含约有300种活性蛋白,包括杀微生物蛋白(platelet microbicidal protein,PMP),大量趋化因子如CXCL4、CXCL7及衍生物、RANTES(CCL5)等,在血小板黏附、凝血、止血、卒中后血栓炎症、创面愈合、肿瘤生长、血管生成和抗微生物宿主防御等不同过程发挥作用[16]。相对于α颗粒,致密颗粒的数量和体积都较少/小(3~9个/血小板,直径250 nm),贮存二磷酸腺苷(ADP)、三磷酸腺苷(ATP)、无机磷酸盐、磷酸盐、组胺、血清素、钙离子等。ADP是一种较弱的血小板激动剂,可引起血小板形状改变、颗粒释放和聚集[17]。溶酶体颗粒含有蛋白酶、糖苷酶和具有杀菌活性的阳离子蛋白,协助降解细菌蛋白[18]。
2 血小板抵御细菌感染的机制
组织、黏膜受损或静脉导管置入,是引起病原菌入侵血流最常见的途径。血小板是血流中数量最多的细胞之一,细胞表面具有多种病原体识别受体,能快速识别病原菌[1]。细菌与血小板的直接结合,血小板与受损处内皮下胶原的结合,还有受损内皮启动凝血途径生成的凝血酶,均能活化血小板,进一步引起血小板变形和脱颗粒,发挥抵御细菌感染的功能。
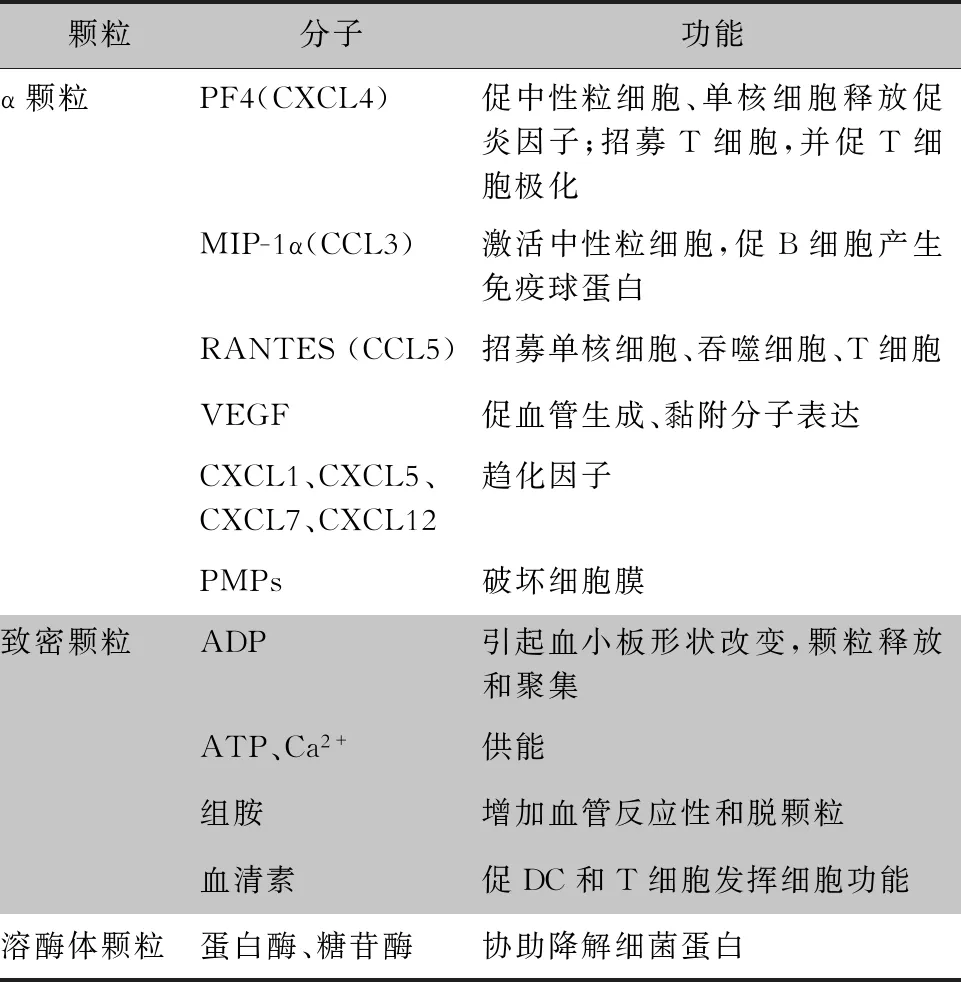
表1 血小板来源的分子及其免疫功能
2.1 血小板识别并结合细菌 血小板与细菌一旦结合,最终都引起血小板活化,部分引起血小板聚集,从而使血小板表面的病原体模式相关受体表达增多和亲和力增强,正反馈刺激血小板迅速识别并结合更多的细菌。血小板与细菌的结合有以下三种形式[19]:①细菌释放产物接触或结合到血小板。感染的细菌释放一系列细菌毒素等产物,通过直接接触或改变血小板膜结构,活化血小板。如金黄色葡萄球菌释放的α毒素可结合到血小板的磷脂双分子层,扩大和形成跨膜孔,使大量Ca2+内流,引起血小板活化[20];牙龈卟啉单胞菌产生的半胱氨酸蛋白可引起血小板胞内Ca2+增多,促使血小板迅速聚集[21]。②细菌直接与血小板的受体结合。血小板表面与细菌识别相关的受体有GPIb、GPIIb/IIIa、TLR2、TLR4、gC1qR、FcγRIIa等。部分细菌蛋白可以识别或直接结合到血小板膜上的上述受体,如血液中链球菌富丝氨酸蛋白A(SrpA)可结合血小板GPIb,表皮葡萄球菌SdrG可结合GPIIb/IIIa,肺炎链球菌脂肽与B族链球菌可结合TLR2,大肠埃希菌的脂多糖(LPS)可结合TLR4等[13, 22-24]。 ③血浆蛋白作为血小板和细菌结合的桥梁。作为血小板与细菌结合的连接桥梁, 研究最多的是vWF和纤维蛋白原。如葡萄球菌通过vWF结合血小板GPIb,葡萄球菌凝聚因子A(ClfA)通过纤维蛋白原结合血小板GPIIb/IIIa[23]。见图1。
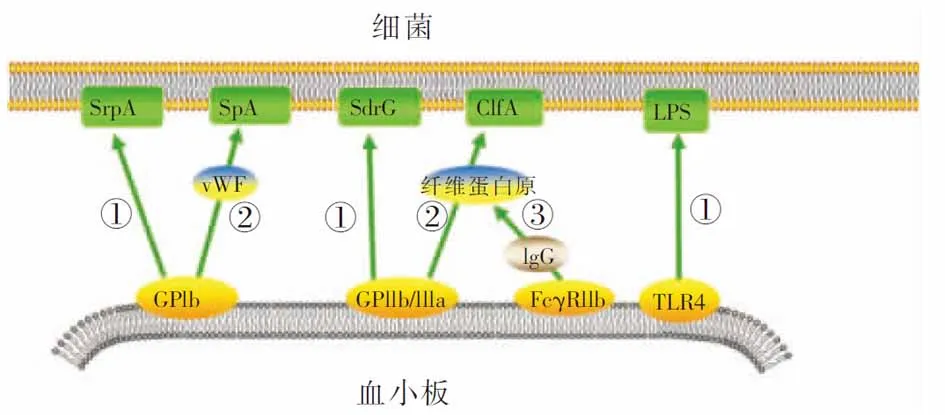
注:①血小板与细菌直接结合;②血小板通过vWF或纤维蛋白原与细菌间接结合;③血小板的FcγRIIa首先与IgG的Fc段结合,再通过纤维蛋白原与细菌间接结合。图1 血小板糖蛋白与细菌表面蛋白相互作用示意图
2.2 血小板内吞细菌 血小板一旦与细菌结合,就会发生一系列自身结构和功能变化,包括变形、捆绑、内吞、吞噬,最后杀灭细菌。早在1980年Clawson等[25]发现血小板可以内吞金黄色葡萄球菌到OCS。Youssefian等[26]进一步研究并证实内吞细菌过程:首先是血小板伸出伪足将细菌包围,随后血小板质膜内陷,形成内吞泡。内吞泡可与OCS膜融合,使包含细菌的内吞泡位于OCS中。然而内吞泡中的细菌能否被杀灭,并不是很清楚。White等[27]研究认为,血小板能内吞金黄色葡萄球菌到OCS,但不能杀灭细菌,因为血小板不具有髓过氧化物酶等吞噬酶。也有学者认为血小板α颗粒能与内吞泡融合,并释放颗粒内容物如PMPs,可与内吞泡中的细菌相互作用[26],有可能杀灭内吞泡中的细菌。Trier等在体外对血小板和细菌进行混合培养,发现血小板的数目决定了其自身的杀菌能力,当血小板数目远高于金黄色葡萄球菌数量时(1 000倍),可杀灭95%的胞外细菌[28],而单个血小板是无法杀灭细菌的。如果不能有效杀菌,那内化到血小板OCS的金黄色葡萄球菌是否会成为病原体逃逸免疫系统的一种方式,甚至成为细菌的“庇护所”值得进一步研究。
然而,并非所有细菌和血小板都存在上述内化作用。已有研究证明血小板可捆绑大肠埃希菌(包括结合及不结合IgG),但只能内吞并杀灭已与IgG结合的大肠埃希菌,机制是血小板FcγRIIa(即IgG受体)和肌动蛋白重排介导血小板对已结合IgG的大肠埃希菌进行吞噬和杀灭,该杀灭机制与活性氧代谢产物无关[29],说明血小板FcγRIIa在杀灭内吞泡细菌机制中起着关键作用。
2.3 血小板释放PMPs直接杀灭细菌 当血小板被入侵的细菌激活后,血小板即脱颗粒,释放出PMPs、趋化因子、活性氧和过氧化氢等直接杀灭细菌。PMPs是一种小的阳离子多肽,通过电压依赖性通道直接破坏病原体的细胞膜,导致细胞膜的动能障碍、渗透性改变[30],从而杀灭细菌。体外研究[31]证明,PMPs的C端(即羧基端)螺旋结构域具有杀菌活性,而N端具有趋化基序(趋化性);正是这种结构允许这些蛋白的修饰和改变,因此也确保了PMPs蛋白水解后仍具有杀菌活性。
3 血小板增强固有免疫
机体感染时,血小板最先到感染前线,一旦识别并与细菌结合,除内吞作用,血小板由光滑圆盘状变成多刺的球形,细胞表面伸出指状、丝状伪足,能有效捆绑细菌并提呈给中性粒细胞和其他吞噬细胞[32](见图3),使上述细胞趋化到感染灶。同时也激活补体系统发挥固有免疫作用。
3.1 血小板协同中性粒细胞抗菌 血小板通过表面受体和释放趋化因子,趋化并募集中性粒细胞到感染灶。同时,活化的血小板还可促进中性粒细胞释放活性氧和形成胞外诱捕网(neutrophil extracellular trap,NET),不仅高效诱捕细菌,增强吞噬功能,还能引起“细胞呼吸爆发”杀灭细菌。
3.1.1 血小板激活并招募中性粒细胞 ① 血小板主要通过表面受体和分子与中性粒细胞相互作用(见图2),包括血小板CD62P可结合中性粒细胞P选择素糖蛋白配体1(PSGL-1),血小板GPIb可结合中性粒细胞的整合素αMβ2,以及血小板GPIIb/IIIa通过纤维蛋白原间接结合整合素αMβ2[33-34]。② 活化血小板释放CD40L可上调中性粒细胞整合素的表达,释放血清素趋化中性粒细胞募集到炎症处[35-36]。 ③ 当血管损伤时,因无完整的内皮常导致中性粒细胞募集所需的黏附分子缺失。此种情况下,血小板GPIb-IX-V复合体和GPVI通过血浆蛋白vWF黏附到内皮下的胶原;一旦黏附,血小板表达大量P选择素,为中性粒细胞PSGL-1提供结合位点[37],此时中性粒细胞的其他分子也可以结合到血小板的其他受体或分子,从而使中性粒细胞有效募集到血管损伤处。因此,在缺乏或仅有少量黏附分子情况下,血小板可充当中性粒细胞募集的“着陆点”,甚至扩大中性粒细胞趋化的信号。

图2 中性粒细胞黏附分子与血小板黏附分子间相互作用示意图
3.1.2 血小板在中性粒细胞抗菌活性中的作用 ①释放活性氧。中性粒细胞的主要功能是产生和释放活性氧(reactive oxygen species,ROS),ROS对细胞毒性较大,能杀灭病原体[38]。血小板与中性粒细胞的结合能大大增加ROS的生成效率,由于过程的耗氧量激增,因此该过程又称为细胞呼吸爆发[39]。②吞噬作用。在中性粒细胞吞噬牙周病原体(放线菌、牙龈卟啉单胞菌)的研究中发现,中性粒细胞的吞噬效率依赖于血小板与中性粒细胞复合物的形成; 20 min内,活化的血小板介导中性粒细胞的吞噬细菌效率约增加20%[40]。因此,血小板可大大增强中性粒细胞的吞噬功能。 ③NETs的形成。NETs由中性粒细胞释放的染色质、蛋白水解酶和其他抗菌分子组成,可以诱捕并直接杀灭细菌[41-42]。尽管这个诱捕网的产生使中性粒细胞失去细胞核,但细胞仍具有血管内爬行和转位等功能[43];正是保留了这些细胞运动功能,更利于NETs对细菌的捕获和清除。体外研究表明,在血小板激动剂(ADP、胶原、凝血酶、花生四烯酸、TLR配体)存在时,可观察到血小板驱动NETs的形成(见图3);缺乏这些血小板激动剂时,NETs则不能形成[44],因此,激活的血小板是体外NETs形成的必要条件。但体内血小板的活化是否也是NETs形成的先决条件,尚不清楚。
3.2 血小板协同库普弗细胞吞噬细菌 血小板作为免疫哨兵巡逻于血管中[45]。肝活体成像显示:无菌状态时,在肝血管窦内的血小板GPIb与库普弗细胞表面vWF短暂结合,在循环中形成短暂的 “接触-移动”交替(短于1 s);当细菌侵入肝血管时,库普弗细胞就会迅速捕获细菌,并迅速触发血小板由“接触-移动”的短暂黏附状态转换为血小板GPIIb/IIIa与库普弗细胞表面vWF结合的持续牢固黏附状态,从而使大量血小板迅速将这些细菌包围起来,形成血小板聚集圈[46](见图3)。这种血小板聚集圈,既可直接中和细菌[45],也可防止细菌逃离库普弗细胞,进一步增强巨噬细胞的吞噬作用。此似乎是肝脏的一种监视机制,即血小板通过“接触-移动”交替监视血管内巨噬细胞的活动,因在不含巨噬细胞的大脑、肌肉、皮肤、耳等组织内很少看到血小板的这种短暂交替活动[46]。CD40L是吞噬细胞的一种重要激活剂,能增强吞噬细胞的吞噬功能;而循环中大部分的CD40L由活化的血小板分泌[47],因此,活化的血小板可增强吞噬细胞吞噬细菌,协同发挥机体的固有免疫。
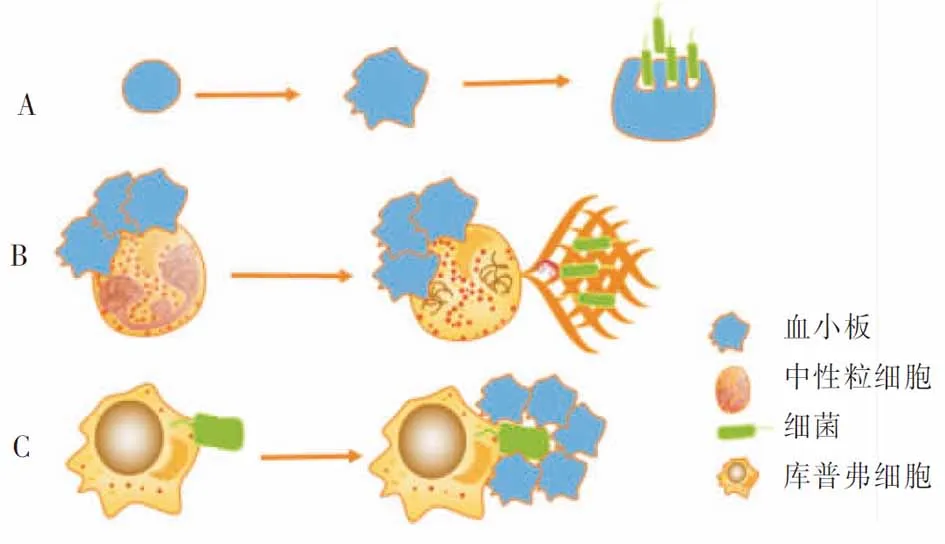
注:A为血小板活化后,血小板变形伸出伪足,捆绑细菌,并将细菌提呈中性粒细胞或吞噬细胞进行吞噬;B为活化的血小板与中性粒细胞结合后,促NETs的形成,NETs有效地诱捕细菌,并杀灭细菌;C为细菌侵入血流后,库普弗细胞捕获细菌,随后血小板迅速在库普弗细胞的周围将细菌包围起来。
3.3 血小板增强补体的免疫效应 补体(complement,C)是固有免疫系统的重要组成部分,血浆中的补体多以非活化形式存在,只有在被激活后才有生物学功能。活化的血小板表达部分补体受体及其他分子,结合补体,并可通过启动经典途径或旁路途径激活补体,促补体发挥抗菌作用。
3.3.1 血小板通过经典途径激活补体 补体C1通常以C1q(C1r)2(C1s)2复合大分子形式存在血浆中。研究表明,活化血小板表达的补体受体gC1qR可结合并激活C1q,进而激活补体C4(即启动经典途径激活补体)。另外血小板分泌的硫酸软骨素,通过结合C1q,同样也启动经典途径活化补体[48]。见图4。
3.3.2 血小板通过旁路途径激活补体 旁路途径是从补体C3开始,C3可被C3转化酶裂解为C3a和C3b。来源活化血小板的P选择素是C3b的受体;P选择素与C3b结合,可刺激旁路途径的级联酶促反应激活补体[49]。活化的血小板α颗粒分泌因子D,因子D能激活并裂解因子B为Ba和Bb[50],促补体转化酶形成;同时补体C3转化酶能正反馈裂解更多补体C3,加强旁路途径激活补体。见图4。
3.3.3 膜攻击复合物的形成 经典途径和旁路途径最后均能形成C5转化酶,将C5裂解成C5a和C5b。试验证明洗涤、活化的血小板可释放C8、C9,小剂量的C5、C6、C7。C5b与C6、C7、C8、C9结合,形成C5b-9复合物,又称膜攻击复合物(membrane attack complex, MAC)[50](见图4)。MAC通过跨膜通道的形成使细胞裂解,从而裂解细菌;MAC也可使内皮释放TF、vWF启动凝血途径,诱发凝血酶和微血栓的形成,最终激活血小板并促血小板脱颗粒[51]。因此,活化的血小板增强补体系统裂解细菌,反过来激活后的补体也增强血小板的活化和脱颗粒,这种正反馈效应最终增强整体杀菌作用。

图4 活化的血小板与补体间的相互作用示意图
4 血小板增强适应性免疫
适应性免疫(包括体液免疫和细胞免疫)是体内T、B淋巴细胞接受外源物质的刺激后,自身活化、增殖、分化为效应细胞,发挥清除病原体等生物学效应。活化的血小板可直接或间接作用于T、B淋巴细胞,启动和增强适应性免疫反应。
4.1 血小板与T淋巴细胞 一方面血小板可以识别和结合细菌,将其传送至脾。如补体C3修饰的李斯特菌可以与血小板上GPIb结合,结合细菌的血小板在脾被CD8α+树突状细胞识别,将该信号(抗原)提呈给T细胞,启动细胞免疫;另一方面,血小板本身的CD40L能促进树突状细胞成熟和启动T淋巴细胞的免疫反应[52];同时,血小板释放的血清素和RANTES(CCL5),也能介导T细胞的激活和分化[53]。
4.2 血小板与B淋巴细胞 体外血小板与B淋巴细胞混合培养3 d后发现,B淋巴细胞产生的免疫球蛋白(IgG1、IgG2、IgG3)增多[53],表明血小板能激活外周血B淋巴细胞和促免疫球蛋白的产生;同时提示血小板可能有促机体产生体液免疫的潜在作用。另外,血小板表达抗体Fcγ受体,能结合IgG抗体[54],协助启动适应性免疫反应并杀灭细菌。
4.3 血小板与淋巴结 淋巴结是T、B淋巴细胞定居的场所。活化的血小板表达C型凝集素样2受体(CLEC-2),可结合淋巴内皮细胞的平足蛋白,以维持淋巴结、淋巴管的完整性[55-56],有助适应性免疫应答的发生。
5 总结
血小板虽是无核的细胞碎片,但在细菌感染发挥关键的免疫防御作用。随着对“血小板作为机体监测细菌的第一哨兵”的理解和研究的深入,将为临床抗感染提供新的思路。
