外源24-表油菜素内酯对NaCl胁迫下桑树幼苗的缓解效应
2021-04-22董亚茹张艳波赵东晓娄齐年李云芝王照红
董亚茹 张艳波 赵东晓 耿 兵 娄齐年 李云芝 王照红 郭 光
(山东省蚕业研究所,山东 烟台 264002)
土壤盐渍化是自然界中主要的非生物胁迫之一,不仅制约植物的生长发育,还严重影响土地利用率。一方面可以通过改良盐渍土壤以减少盐碱地面积,但该项任务实施过程中困难重重;另一方面则可以通过提高植物耐盐性来应对盐渍胁迫,如抗盐锻炼、培育耐盐品种、加入生长调节剂等[1-2]。因此,关于植物对盐胁迫适应能力的研究也已成为时下热点。桑树(MorusL.)是一种宝贵的植物资源,不仅能为养蚕业提供原料,也可广泛用于防风固沙,园林绿化,同时还是重要的食、药用资源。此外,桑树耐干旱瘠薄、适应性强并具有一定的耐盐能力,在改善和利用盐碱地方向也具有广阔的应用前景。
油菜素内酯(brassinolide,BR)是甾醇类植物激素,广泛存在于植物的花粉、种子、茎、叶、果实等植物器官中,并参与植物细胞分裂和伸长、光形态建成、开花及产量和品质的形成等生长发育过程[3-5]。近年来,人们对BR做了大量的研究,发现24-表油菜素内酯(24-epibrassinolide,EBR)和28-高油菜素的活性最强[6]。众多研究结果表明,外施一定浓度的油菜素内酯能有效提高植物对多种非生物胁迫的抗性,缓解温度胁迫[7-8]、盐胁迫[9]、干旱胁迫[10]及重金属(铜[3]、镉[11]、砷[12]、汞[13]等)胁迫对植株造成的伤害。目前有关BR抗逆性研究大部分基于农作物、草本植物,而对木本植物的研究相对较少,刘良松等[14]研究表明,低温胁迫下喷施外源EBR能减轻低温引起的氧化损伤,从而增加华山松的抗寒能力。Yue等[15]研究表明,外源EBR能够明显缓解盐胁迫对刺槐幼苗生长的抑制作用,其中蘸根处理效果最佳。樊玉花[16]研究结果表明,施加外源BR能够提高杜鹃的光合能力,降低活性氧积累和膜质过氧化水平,增强其抗旱能力。Zhou等[17]研究表明,外源BR可降低葡萄扦插的氧化损伤,提高其对铜胁迫的耐受性。但有关外源EBR对提高桑树耐盐性影响的研究尚鲜见。
因此,本研究通过分析外施EBR后盐胁迫下桑树幼苗的生长、根系形态、光合色素含量、活性氧自由基(reactive oxygen species,ROS)含量、相对电导率、丙二醛(malondialdehyde,MDA)、抗氧化酶活性、渗透调节物质含量和叶片染色等的变化,以揭示外源EBR对桑树幼苗胁迫的影响,及其在辅助植物修复盐胁迫中的潜在生理作用。
1 材料与方法
1.1 试验材料
供试材料为杂交桑桂桑优12,其母本为沙2,父本为7722,购自广西壮族自治区蚕业技术推广总站。试验所用24-表油菜素内酯(EBR)购自北京Coolaber公司。
1.2 试验设计
试验于2019年4月,在山东省蚕业研究所温室大棚进行。培养条件为:光周期14 h/8 h、温度25℃,相对湿度60%~70%。挑选健康、饱满的桂桑优12种子,播种于10 cm×10 cm×9 cm育苗盆中,草炭土和蛭石比例为2∶1,四叶一心期间苗,每盆留苗4棵,期间浇灌1/2 Hoagland营养液以补充营养。
培养两个月后,挑选长势一致的桑树幼苗,分别用200 mmol·L-1NaCl和不同浓度EBR进行浇灌处理。试验共设置5个处理,分别为:1)CK:蒸馏水;2)S:200 mmol·L-1NaCl;3)S1∶200 mmol·L-1NaCl+0.01 μmol·L-1EBR;4)S2∶200 mmol·L-1NaCl+0.10 μmol·L-1EBR;5)S3∶200 mmol·L-1NaCl+1.00 μmol·L-1EBR,每个处理3次重复,每重复15盆,每重复灌溉处理液总体积均为6 L,于处理第7天取材测定相关生理指标。
1.3 测定项目与方法
1.3.1 植株质量测定及根系扫描 每个重复取6株植株,用去离子水清洗干净,然后用吸水纸吸干表面水分,将地上和地下部分开,用FA1004型万分之一天平(上海菁海)称取鲜质量,然后于105℃杀青30 min,80℃烘干至恒重,称干质量。将另一份清洗好的根系放入盛水托盘内,利用V850 Pro扫描仪(日本爱普生)和Win-RHIZO根系分析系统对根系进行扫描并分析总根长、表面积、平均直径、总体积等指标,主根长用直尺测定,每个重复6株植株。
1.3.2 叶片化学染色 每处理取大小一致的6片叶分别进行氮蓝四唑(nitrotetrazolium blue chloride,NBT)染色、3,3-二氨基联苯胺(3,3-Diaminobenzidine,DAB)染色和伊文斯兰(Evans blue)染色。NBT染色:将叶片置于100 mL烧杯中,加入80 mL NBT染色液,于室温染色过夜后,弃去染色液,加入96%乙醇沸水浴10 min脱色。DAB染色:将叶片置于100 mL烧杯中,加入80 mL DAB染色液,于室温染色过夜后,弃去染色液,加入96%乙醇沸水浴10 min脱色。Evans blue染色:将叶片置于100 mL烧杯中,加入80 mL Evans blue染色液,将烧杯置于真空干燥器中,抽真空15 min,并保持真空6 h,弃去染色液,用10 mmol·L-1磷酸盐缓冲液(pH值7.8)清洗叶片3~5次去其浮色,加入96%乙醇沸水浴10 min脱色。
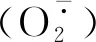
1.4 数据处理
所有试验进行3次重复。采用IBM SPSS Statistics 20进行数据分析,采用单因素方差分析(ANOVA),LSD检验各处理间的差异显著性(P<0.05),采用GraphPad Prism 8.0.2统计数据并制图。
2 结果与分析
2.1 外源EBR对NaCl胁迫下对桑树幼苗生长的影响
由表1可知,与CK相比,200 mmol·L-1NaCl(S)胁迫显著抑制了桑树幼苗的生长,地上部鲜质量、地下部鲜质量、地上部干质量、地下部干质量,分别为CK的0.60、0.53、0.64、0.50倍。而外源添加EBR后,随着EBR浓度的增加,地上部和地下部鲜质量及干质量均呈先升高后降低的趋势,S1(200 mmol·L-1NaCl+0.01 μmol·L-1EBR)、S2(200 mmol·L-1NaCl+0.10 μmol·L-1EBR)、S3(200 mmol·L-1NaCl+1.00 μmol·L-1EBR)地下部鲜质量和干质量均与S差异显著,S1、S2的地上部鲜质量和干质量均与S差异显著,且均以S2最高,其地上部鲜质量、地下部鲜质量、地上部干质量、地下部干质量分别是S的1.47、1.56、1.36、1.43倍。
由表2可知,单一NaCl胁迫处理(S)对桑树幼苗根系形态发育产生了抑制作用,其主根长、总根长、根表面积、根体积和平均直径分别为CK的0.84、0.65、0.59、0.55、0.85倍。NaCl胁迫下外源添加EBR后桑树幼苗根系各项指标出现不同幅度增加,且随着EBR浓度的增加表现为先增加后降低的趋势,在S2达到最高值,其主根长、总根长、根表面积、根体积和平均直径分别是S处理的1.33、1.14、1.35、1.56和1.28倍,且均与S差异显著。

表2 外源EBR对NaCl胁迫下桑树幼苗根系特征的影响
2.2 外源EBR对NaCl胁迫下桑树幼苗叶片叶绿素和类胡萝卜素含量的影响
由表3可知,与CK相比,单一NaCl胁迫(S)显著降低了桑树幼苗叶片光合色素含量,其叶绿素a、叶绿素b、总叶绿素和类胡萝卜素含量分别为CK的0.61、0.63、0.62、0.62倍。NaCl胁迫下外源添加EBR缓解了桑树幼苗叶片光合色素含量的降低,且随着添加EBR浓度的增加,叶绿素a、叶绿素b、总叶绿素和类胡萝卜素含量均呈先升高后降低的趋势,且在S2达到最大值,分别是S的1.48、1.48、1.48和1.41倍,并与S差异显著。
2.3 外源EBR对NaCl胁迫下桑树幼苗ROS含量的影响

2.4 外源EBR对NaCl胁迫下桑树幼苗丙二醛含量及相对电导率的影响
由图2可知,与CK比较,单一NaCl胁迫(S)显著提高了桑树幼苗叶片及根系的MDA含量和相对电导率,分别为CK的1.82、1.52(叶片、根)和2.42、1.83倍。随着添加EBR浓度的增加,叶片及根系中的MDA含量和相对电导率均呈先降低后升高的趋势。其中S2叶片和根系的MDA含量显著低于S,分别为S的0.70和0.77倍。同样,S2叶片和根系的相对电导率显著低于S,分别为S的0.65和0.69倍。
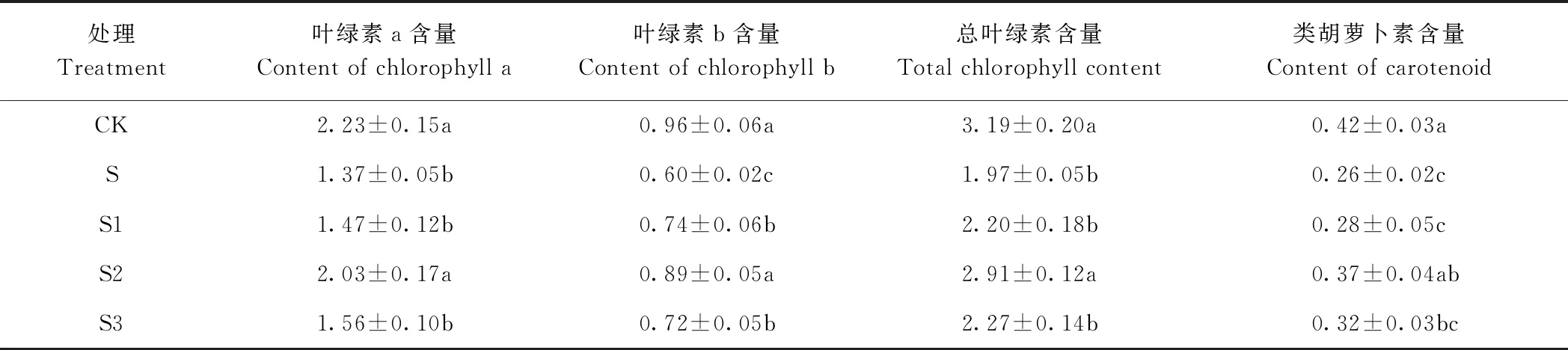
表3 外源EBR对NaCl胁迫下桑树幼苗叶片叶绿素和类胡萝卜素含量的影响
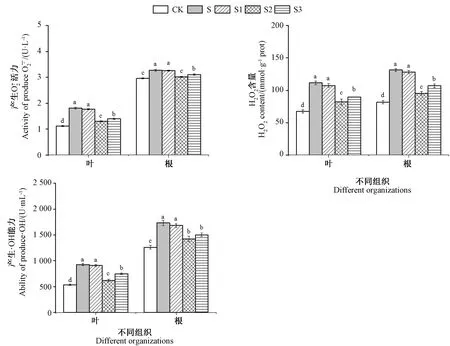
注:不同小写字母表示处理间差异显著(P<0.05)。下同。
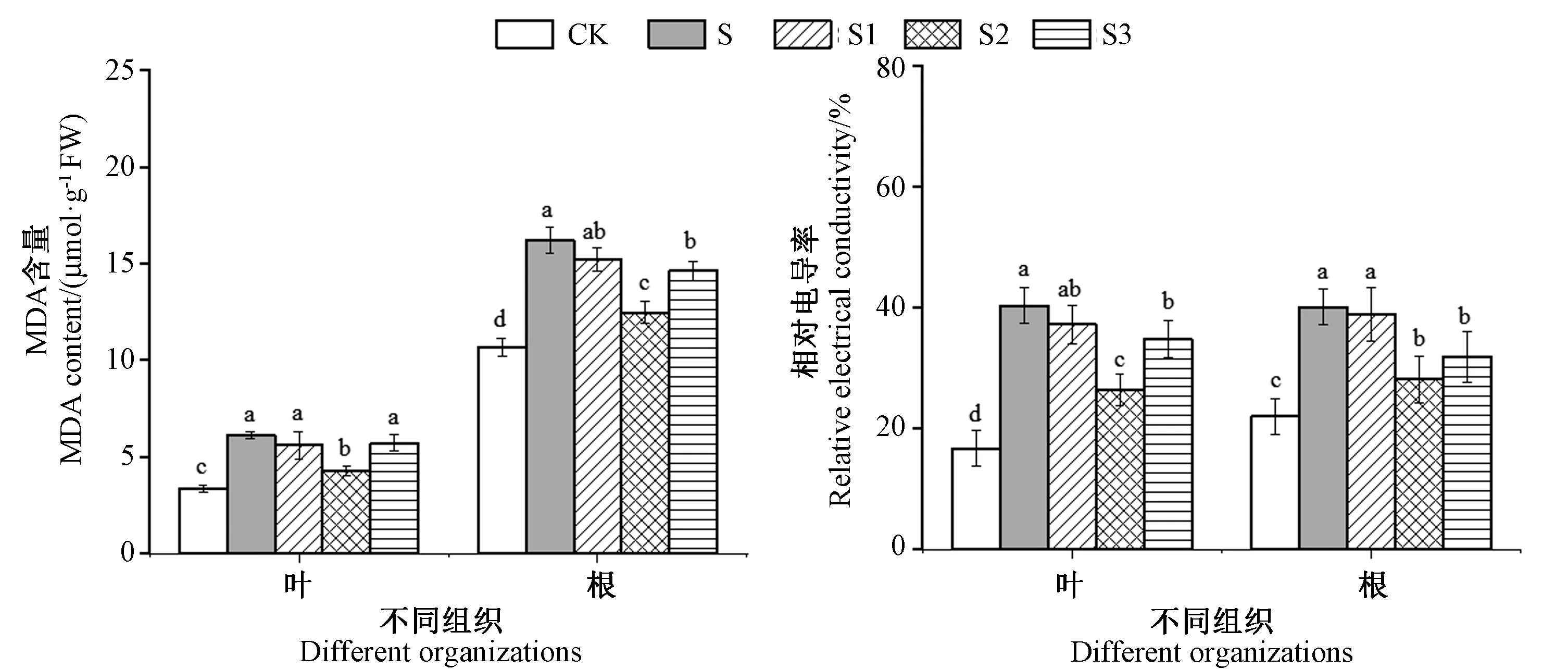
图2 外源ERB对NaCl胁迫下桑树幼苗叶片及根系中MDA含量及相对电导率的影响
2.5 外源EBR对NaCl胁迫下桑树幼苗叶片染色的影响
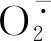
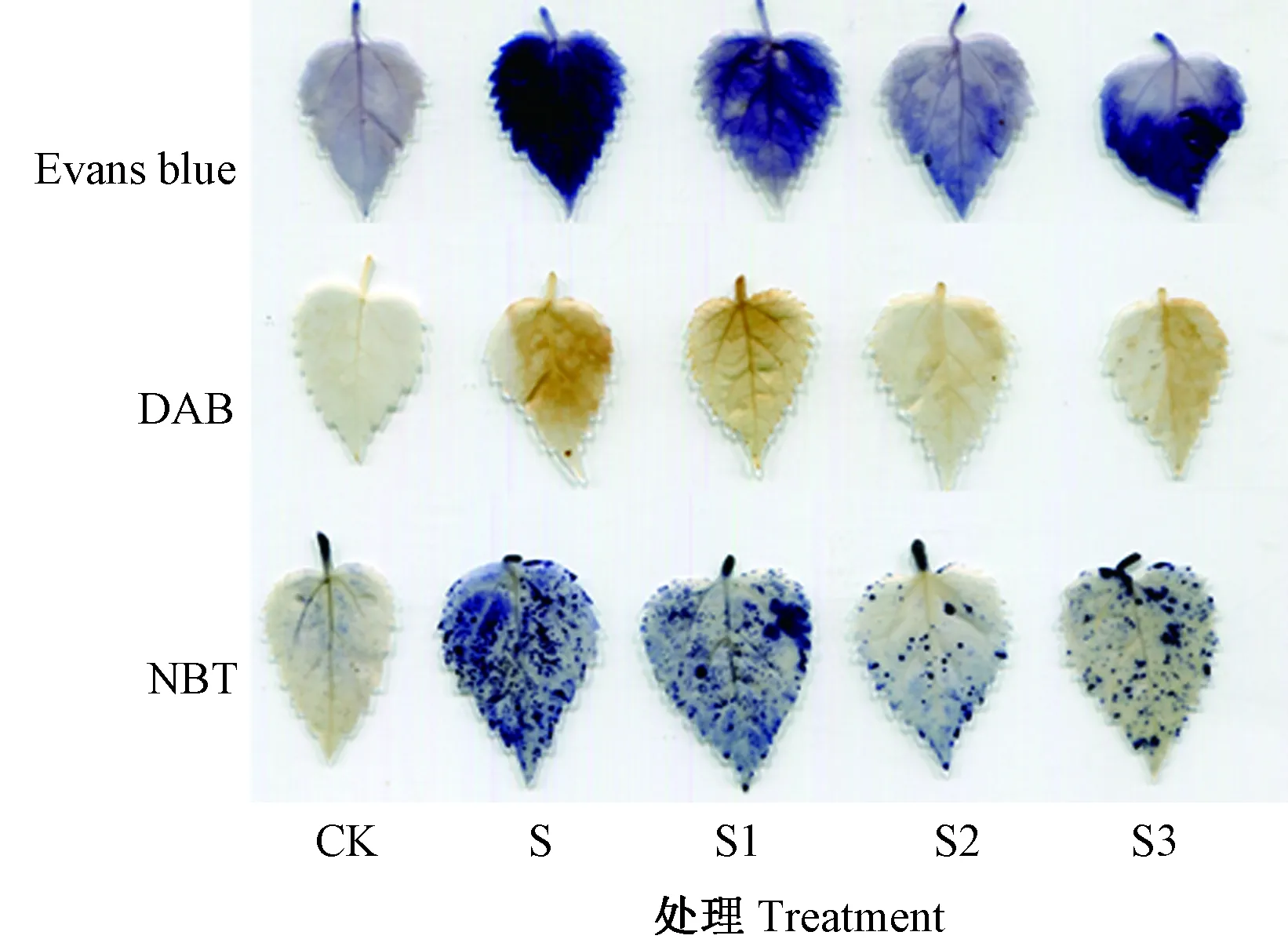
图3 外源EBR对NaCl胁迫下桑树幼苗叶片染色的影响
2.6 外源EBR对NaCl胁迫下桑树幼苗抗氧化酶系统的影响
由图4可知,单一NaCl胁迫(S)下桑树幼苗叶片和根系的抗氧化酶活性均较CK显著提高,其中SOD、POD、CAT活性,在叶片中分别为CK的1.45、1.48、1.48倍,在根系分别为CK的1.38、1.35、1.30倍。随着添加ERB浓度的增加,抗氧化酶活性呈先升高后降低的趋势,其中S2的抗氧化酶活性最高,且其叶片和根系中抗氧化酶活性均显著高于S,叶片中SOD、POD、CAT活性分别是S的1.37、1.33、1.57倍,根系中为S的1.47、1.36、1.43倍。
2.7 外源ERB对NaCl胁迫下桑树幼苗渗透调节物质的影响
如图5所示,与CK相比,单一NaCl胁迫总体显著增加了桑树幼苗叶片和根系渗透调节物质Pro、可溶性糖和可溶性蛋白含量,分别为CK的1.53和1.56倍、1.40和1.26倍、1.66和1.15倍。随着外源EBR浓度的增加,3种渗透调节物质含量均呈先增加后降低的趋势,均于S2达到最大值,且与S存在显著差异。S2叶片和根系产生Pro含量为S的1.40和1.42倍,可溶性糖含量为S的1.68和1.43倍,可溶性蛋白含量是S的1.40和1.42倍。
3 讨论
3.1 外源ERB对NaCl胁迫下桑树幼苗生长的影响
盐胁迫严重影响植物生长发育,并可显著降低植物生物量的积累[20]。本研究结果表明,200 mmol·L-1NaCl胁迫显著降低了桑树幼苗地上和地下部的鲜质量及干质量,并显著降低了主根长、总根长、根表面积、根体积和平均直径等根系形态特征,说明200 mmol·L-1NaCl胁迫抑制了桑树幼苗的生长。这可能是因为盐胁迫使土壤中可溶性盐浓度升高,导致植物根系细胞产生脱水和渗透胁迫,从而损害植物的正常代谢,使根系吸水困难,导致植物生长缓慢,最终使生物量积累下降[21-22]。
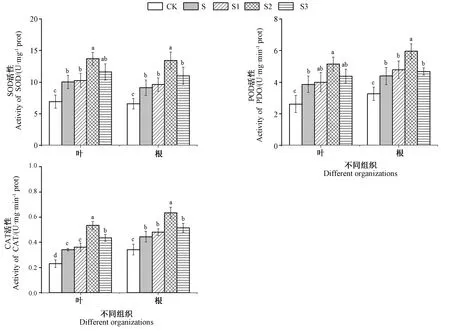
图4 外源ERB对NaCl胁迫下桑树幼苗叶片和根部SOD、POD和CAT活性的影响

图5 外源EBR对NaCl胁迫下桑树幼苗叶片和根部Pro(A)、可溶性糖(B)和可溶性蛋白(C)含量的影响
外源生长调节剂EBR可诱导和增强盐胁迫下植物的耐受性[23]。本研究表明,浓度为0.10 μmol·L-1EBR(S2)显著提高了NaCl胁迫下桑树幼苗主根长、总根长、根表面积、根体积和平均直径以及地上和地下部的鲜质量及干质量,这与Yuan等[24]的研究一致。表明外源添加EBR可减缓盐胁迫对植物的毒害作用,这可能是由于EBR可以通过激活细胞壁松弛酶来调节细胞的伸长和分裂[25]。
3.2 外源EBR对NaCl胁迫下桑树幼苗叶片光合色素的影响
盐胁迫对色素系统和光合作用机制具有负面影响,表现为植物叶绿素含量降低并导致光合作用效率下降,主要是由于盐可以加速叶绿素分子的分解并导致叶绿素生物合成受阻[26]。本研究结果表明,200 mmol·L-1NaCl胁迫显著降低了光合色素含量,而在盐胁迫的同时外源添加0.10 μmol·L-1EBR时,光合色素含量降低得到了最佳的缓解。这可能是由于EBR在植物体内可充当信号分子,诱导盐胁迫下叶绿体形态的恢复,并促进叶绿体颗粒的形成[27]。此外,施加EBR后叶绿素含量的恢复也可能是由于mRNA的转录调控以及信号转导促进了叶绿素的生物合成,同时EBR可使叶绿素酶编码基因下调,减少叶绿素分子的降解[28]。
3.3 外源ERB对NaCl胁迫下桑树幼苗ROS水平、脂质过氧化程度和细胞质膜完整性的影响
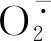
盐胁迫可以显著影响植物细胞质膜脂质过氧化,从而改变质膜渗透性,进而调节离子的渗透模式[34]。MDA是脂质过氧化作用的最终产物,其积累反映了ROS引起的细胞膜损伤程度[35]。在本研究中,单一NaCl胁迫下桑树幼苗的根系和叶片中MDA和相对电导率均较CK显著增加,表明盐胁迫引起了桑树幼苗的氧化胁迫反应。这与在薄荷[36]、草莓[37]、水稻[38]中的结果相似。Evans blue叶片化学染色结果进一步说明NaCl胁迫加剧了桑树幼苗叶片的脂质过氧化程度,破坏了细胞质膜的完整性。外源添加EBR后降低了桑树幼苗MDA的产生,促进了电解质渗透率的下降,表明EBR可以在盐胁迫下增加膜的稳定性。这可能与EBR可以稳定膜蛋白并能清除产生的ROS有关[39]。
3.4 外源ERB对NaCl胁迫下桑树幼苗抗氧化酶的影响
在自然界中,ROS的生成速度非常缓慢,并且在生成和淬灭之间保持了适当的平衡。但当盐胁迫打破这种平衡时,会引起细胞内和细胞间ROS水平的快速升高,从而对植物造成氧化损伤[40-41]。为了避免这种损害,植物自身会提高抗氧化酶和非酶物质来清除ROS。本研究中,单一NaCl胁迫下桑树幼苗叶片和根系的SOD、CAT、POD活性均较CK显著增加,表明植物为了清除盐胁迫下产生的过量ROS,启动了抗氧化系统,提高了抗氧化酶活性。然而在NaCl胁迫下外源添加EBR后,桑树幼苗叶片和根系的抗氧化酶活性随EBR浓度的增加呈先升高后降低的趋势,但整体活性仍高于单一Nacl胁迫处理。这可能是因为BR通常可以作为受体/配体复合物,与细胞核或细胞质结合,调节特定应激相关基因的表达,从而增强抗氧化酶活性[42-43]。
3.5 外源ERB对NaCl胁迫下桑树幼苗渗透调节物质的影响
Pro作为一种渗透保护剂,被认为是一种膜稳定剂和ROS清除剂,作为信号分子,Pro是植物从环境胁迫恢复过程中必不可少的分子[44]。可溶性糖在植物体内具有渗透保护、碳储存和清除自由基的作用[45]。可溶性蛋白作为细胞的重要组成部分,可以响应外界胁迫,参与渗透调节。在本研究中,单一NaCl胁迫引发了Pro、可溶性糖、可溶性蛋白含量的增加,而外源添加EBR后Pro、可溶性糖、可溶性蛋白含量呈先增加后降低的趋势,在S2(EBR浓度为0.10 μmol·L-1)积累量达到最高,这表明EBR增强了桑树幼苗叶片和根系的渗透调节能力,从而减轻了氧化应激。
4 结论
综上所述,将桑树幼苗经200 mmol·L-1NaCl胁迫处理会引起氧化应激,从而抑制桑树幼苗叶片和根系的生长,降低了鲜/干质量和光合色素含量,提高了活性氧积累量、抗氧化酶活性、MDA含量、电解质渗透率和渗透调节物质含量。外源添加浓度为0.10 μmol·L-1EBR,可有效缓解NaCl胁迫对桑树幼苗叶片和根系生长抑制作用,使得桑树叶片和根系鲜/干重、光合色素含量、抗氧化酶活性和渗透调节物质含量显著增加,并显著降低了ROS积累量、膜脂过氧化水平和相对电导率,缓解了NaCl对桑树幼苗叶片和根系的氧化损伤,增强了桑树幼苗的耐盐性。
