pH敏感水凝胶微球的制备及二甲酸钾缓释和抗菌性能分析
2021-04-21郭小炜李玉妍王秀丽杨忠鑫陈南春解庆林
郭小炜,李玉妍,王秀丽,杨忠鑫,陈南春,解庆林
(1 桂林理工大学 材料科学与工程学院,广西 桂林 541004;2 桂林理工大学 化学与生物工程学院,广西 桂林 541006;3 桂林理工大学 广西岩溶地区水污染控制与用水安全保障协同创新中心,广西 桂林 541006)
水凝胶是聚合物链通过物理、离子或共价相互作用交联而合成的大分子聚合物凝胶,可通过氢键吸收大量的水[1]。水凝胶可以设计成具有优选特性的药物递送系统,理想的水凝胶可以根据温度和pH等物理变化选择性释放药物[2-3]。
复合水凝胶是巨大的三维网状聚合物,彼此通过化学或物理交联而结合,它们的水合和多孔结构可以模拟组织固有的特性、结构和微环境。可通过聚合物结构中的功能基团获得改进性能的复合水凝胶[4]。沸石分子筛具有独特的孔结构、较大的比表面积、可调节的酸碱位点等特征。同时沸石分子筛有较好的生物相容性和无毒性,使其在药物递送中得到广泛的引用[5],在聚合物中加入无机材料沸石分子筛,可以大大提高材料的力学性能[6]。CMC分子链中有多个羧基,与金属离子具有出色配位能力[7]。由于CMC无毒性、良好的配位能力、可生物降解性和低成本优势,已经开发出许多基于CMC的水凝胶。壳聚糖[8]是自然界中唯一的一个带正电荷的天然高分子,其分子链上存在着大量的氨基基团。CMC和CS两者可以形成有效的结合,会使两种高分子在水溶液中交联,形成聚电解质复合物,壳聚糖(CS)[9]和羧甲基纤维素(CMC)[10]已被用作pH敏感的药物递送系统。
二甲酸钾(KDF)是一种略显负电性的新型的绿色抗菌剂,添加到动物饲料中具有降低胃肠道pH值、调节肠道微生物生态平衡、提高饲料营养物质的消化和吸收等功能[11]。但直接饲喂KDF主要在小肠前端发挥作用,利用率不高,不能充分发挥二甲酸钾调节肠道的作用。为解决这一问题,本工作制备了全新的与Fe3+交联的壳聚糖-羧甲基纤维素-P型分子筛复合水凝胶微球,具有高pH敏感性,可使二甲酸钾稳定到达肠道释放并发挥抗菌作用。
因为pH因素是控制药物释放的关键,本工作为控制KDF的释放,提出了一种使用CS,CMC作为pH敏感聚合物的改进方法。通过凝聚法制备了CS@CMC@Zeolite P@KDF复合水凝胶抗菌微球,用于在生理pH条件下选择性释放药物,为KDF的有效利用提供了一种可行的模型。
1 实验材料与方法
1.1 试剂与仪器
壳聚糖(脱乙酰度:>90.0%),羧甲基纤维素(黏度:800~1200 mPa·s),国药集团化学试剂有限公司,化学纯CP;氯化铁(FeCl3),冰醋酸(CH3COOH),西陇科学股份有限公司,分析纯AR;二甲酸钾晶体(≥98%),武汉远成科技有限公司;PBS磷酸盐粉剂(pH 7.2~7.4),Phygene Scientific公司;Zeolite P实验室[12]和去离子水,实验室自制。
Zeolite P表面和水凝胶微球内表面(剖开)微观形貌采用JSM-6380LV型扫描电子显微镜进行观察。Zeolite P物相分析采用X′Pert PRO型X射线粉末衍射仪对样品进行测试。采用ZS90 Zeta电位仪对不同pH下Zeolite P电位进行测试。材料官能团变化采用Thermo Nexus 470FT-IR傅里叶变换红外光谱仪进行测试分析。材料的稳定性采用Q500 TGA热重分析仪进行测试表征。
1.2 水凝胶微球的制备
1.2.1 复合水凝胶微球的制备
Zeolite P(0%,0.5%,1.5%,质量分数,下同)于100 mL去离子水中超声分散10 min,缓慢加入3.0 g CMC,边加边搅拌,待CMC溶解后静置12 h,得到溶液A。称取2.0 g CS加入到100 mL冰醋酸(2%),溶解后静止12 h脱泡,得到溶液B。用5 mL针筒缓慢把溶液A滴加到4.0% FeCl3溶液中,交联30 min,过滤洗涤,把CMC@Zeolite P凝胶微球放入溶液B,搅拌30 min,过滤洗涤,冷冻干燥即可得CS@CMC@Zeolite P复合水凝胶微球见图1。

图1 复合水凝胶微球
1.2.2 抗菌微球的制备
Zeolite P(0%,0.5%,1.5%)于100 mL去离子水中超声分散10 min,加入0.4 g KDF搅拌3 h,加入3.0 g CMC,边加边搅拌,待CMC溶解后静置12 h,得到溶液C。用5 mL针筒缓慢把溶液C滴加到4.0% FeCl3溶液中,交联30 min,过滤洗涤,把CMC@Zeolite P@KDF凝胶微球放入溶液B,搅拌30 min,过滤洗涤,冷冻干燥即可得CS@CMC@Zeolite P@KDF复合抗菌微球。
1.3 测试分析
1.3.1 溶胀性分析
通过浸泡法测定水凝胶微球吸水性,研究其溶胀行为。配置3种不同pH值分别为1.2(模拟胃液)、6.8(模拟小肠液)、7.4(模拟大肠液)磷酸盐缓冲溶液。准确称量0.02 g干燥后均匀复合水凝胶微球颗粒,浸泡在相应pH磷酸盐缓冲溶液中。缓慢搅拌,间隔一定的时间,取出微球,用滤纸吸附表面黏附的液体,立即称重。通过公式(1)计算微球的溶胀率(S):
(1)
式中:Mt为某一时间t水凝胶微球吸水膨胀后的质量;M0为水凝胶微球的初始质量。
1.3.2 KDF释放行为
称取定量KCl,以去离子水为溶剂,配制浓度为0,5.0,10.0,15.0,20.0,25.0,30.0 mg/L的钾离子标准溶液,使用原子吸收分光光度计测定各浓度的吸光度,得到钾离子的标准曲线。线性回归方程式(2)为:
y=0.03116x+0.01507
(2)
式中:y代表吸光度,x代表钾离子浓度,相关系数R2=0.99676。
称取1.74 g NaH2PO4,2.7 g Na2HPO4和1.7 g NaCl,溶解在400 mL去离子水溶液,使用NaOH溶液调节pH为7.4。将0.4 g抗菌微球碾碎置于50 mL温度为37 ℃的磷酸盐缓冲溶液中(pH=7.4,不含钾离子),缓慢搅拌,使KDF充分溶出,离心得到上清液。利用原子吸收分光光度计测定钾离子的吸收值,根据标准曲线方程式(2),计算抗菌微球中KDF的含量。并按式(3)计算包封率(EE),按式(4)计算载药率(LC):
(3)
(4)
式中:m1为抗菌微球中KDF含量,g;m2为KDF投加量,g;m3为抗菌微球的质量,g。
分别称取0.4 g形貌完整的复合抗菌微球,置于100 mL磷酸盐缓冲溶液,于常温缓慢搅拌,每次取1 mL溶液适当稀释,定时段通过原子吸收分光光度计测试,每次取出溶液之后,立刻添加相同体积、相同pH值的磷酸盐缓冲溶液,根据钾离子标准曲线计算KDF的含量,考察抗菌微球中KDF的释放情况。
1.3.3 体外抗菌测试
采用微孔板法进行体外抗菌测试,用抗菌微球和液体培养液(胰蛋白胨1 g,牛肉膏0.5 g,氯化钠0.5 g,100 mL去离子水溶解,调节pH为7.2,高温高压灭菌20 min)配制浓度为48 mg/mL抗菌液,将48 mg/mL母液依次稀释为24,12 mg/mL。向样品测定孔中加入上述浓度的抗菌液和纯液体培养液各200 μL,每个浓度重复3组实验,依次加入大肠杆菌和金黄色葡萄球菌菌悬液10 μL,于37 ℃条件下,在恒温振荡培养箱中振荡培养,每隔4 h用酶标仪在波长为630 nm处测定其吸光度(即OD 630 nm值),每组实验结果取平均值[13]。
2 结果与分析
2.1 Zeolite P特征分析
图2为制备的Zeolite P XRD图谱,与Zeolite P的标准卡片JCPDS card No.01-071-0962表现出较高的匹配,衍射峰位置基本一致[14]。图3为制备的Zeolite P的SEM图,Zeolite P平均粒径大小为0.5 μm。
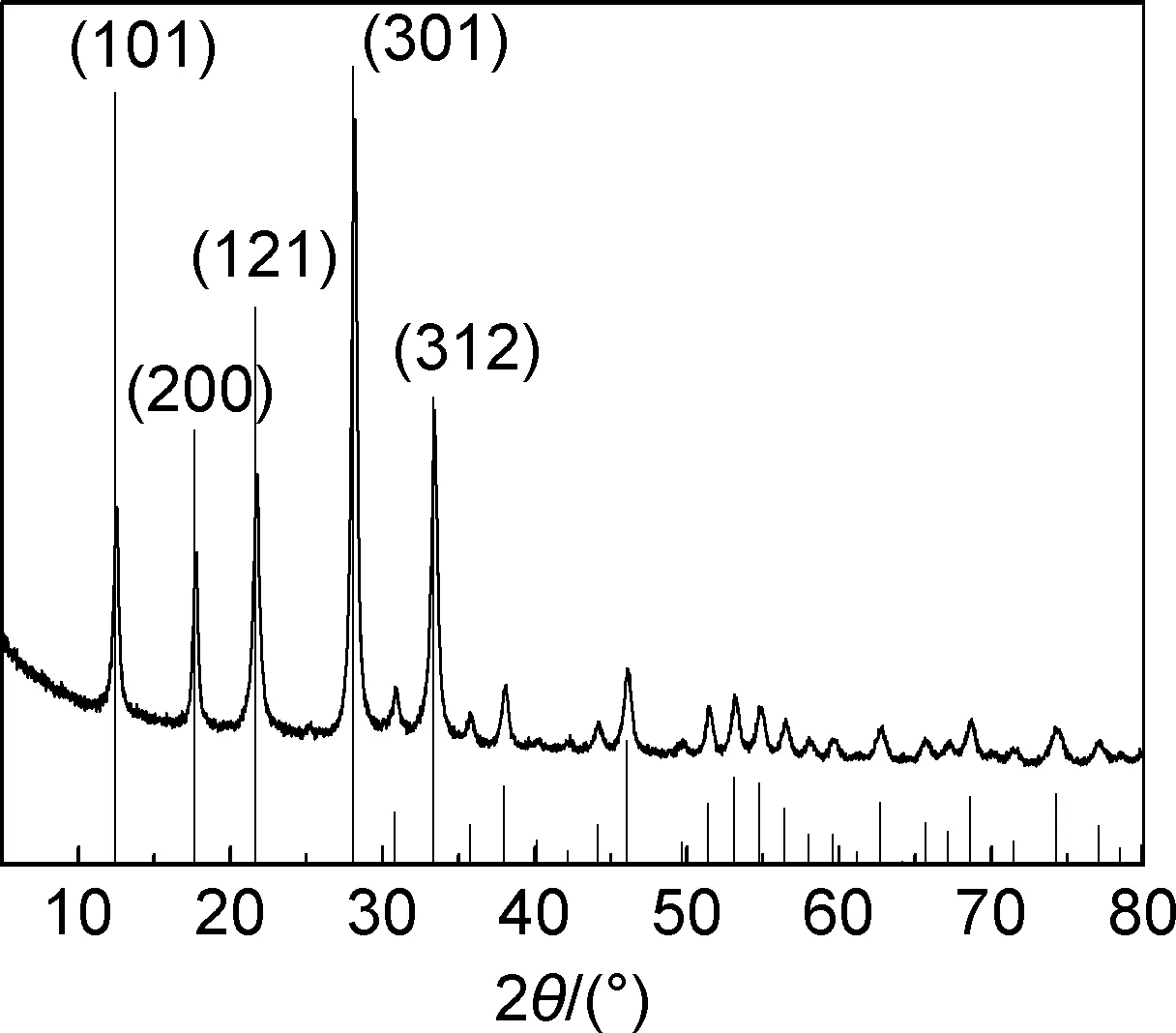
图2 P型分子筛XRD图谱

图3 P型分子筛的扫描图
图4为随pH变化Zeolite P的Zeta电位图,曲线与0电位的交点为5.37,当溶液pH值大于5.37时,Zeolite P表面带负电荷,具有吸附阳离子的能力;当溶液pH值小于5.37时,Zeolite P表面带正电荷,具有吸附溶液中阴离子的能力。当pH值在3.0~5.37之间,Zeolite P表面呈正电位,同时由于其较高的比表面积,为吸附KDF提供了条件。结果表明,在pH值为3.0~5.37条件下,Zeolite P和KDF有较好的结合能力。孟祥俭等[15]利用XPS表征沸石分子筛与KDF的结合关系,结果表明Al2p周围化学环境发生了变化,周围电子云密度降低,应该是KDF与分子筛形成了氢键;同时分子筛中的钠周围的环境也发生变化,可能是KDF中的钾将分子筛中的钠取代。表明Zeolite P对KDF有较好的吸附作用。
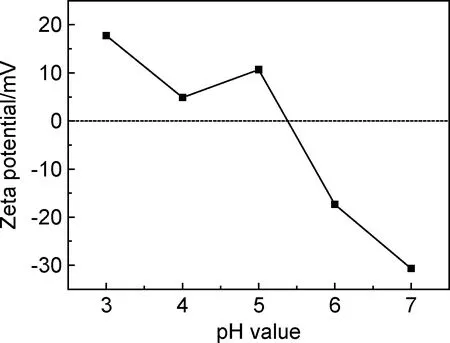
图4 P型分子筛的Zeta电位
2.2 复合水凝胶微球的形貌和结构分析
图5为复合水凝胶微球的内剖图,内部为致密的结构,EDS结果显示含有Zeolite P的特征元素Al和Si,表明Zeolite P镶嵌在CMC三维网状结构中,对复合水凝胶微球骨架具有支撑作用。

图5 CS@CMC@Zeolite P内剖图(a)及其内表面EDS谱图(b)
对原材料Zeolite P,CMC,CS,CS@CMC@Zeolite P进行红外分析,分析结果如图6所示。与CMC和CS中的3458,3431 cm-1处峰值相比,CS@CMC@Zeolite P羟基峰特征峰变得宽且大,红移到3420 cm-1,说明CS,CMC和Zeolite P之间存在氢键用力;同时CS@CMC@Zeolite P中的特征峰衍射峰偏移到1596 cm-1,这是由于CS中—NH2基团(1644 cm-1)与CMC中的—COOH基团(1623,1418 cm-1)相互作用,CS与CMC通过离子键与氢键形成聚电解质复合物。CS@CMC@Zeolite P特征峰中存在600~1000 cm-1Zeolite P骨架震动特征峰,但是强度有所减小,说明Zeolite P被包覆在复合水凝胶微球中。
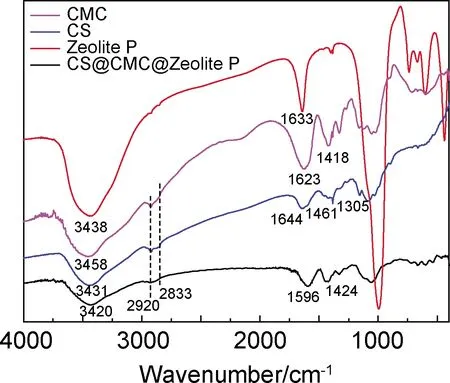
图6 红外对比谱图
2.3 复合水凝胶微球的热稳定性分析
图7为CMC,CS,CS@CMC,CS@CMC@Zeolite P各组的热重分析曲线。可以发现CS@CMC与CS@CMC@Zeolite P在前期主要为结合水的蒸发,随后在200 ℃开始缓慢分解。分解温度小于CS和CMC的裂解温度,这是由于两种高分子材料混合后产生的离子键作用力会削弱两种高分子本身分子内部以及同类分子之间的相互作用力[16-17]。但是离子键的存在会提升整体的热稳定性,对比同时失重50%质量的温度可知:CS@CMC在温度455 ℃才损失一半质量,而CS与CMC分别在325 ℃和365 ℃已经损失一半质量,说明CS@CMC比天然高分子具有更高的热稳定性,这是由于聚合物结构的改变以及CMC与Fe3+的相互作用。然而在加入Zeolite P后,观察到其在损失50%质量时的温度低于CS@CMC体系,这可能是由于Zeolite P的塑化作用,增加了CMC基质中的孔隙度,降低了CMC基质在特定温度范围的稳定性。TGA的分析结果可从侧面反映出两种高分子之间存在着离子键的结合,CS@CMC@Zeolite P体系在常温是热稳定的。
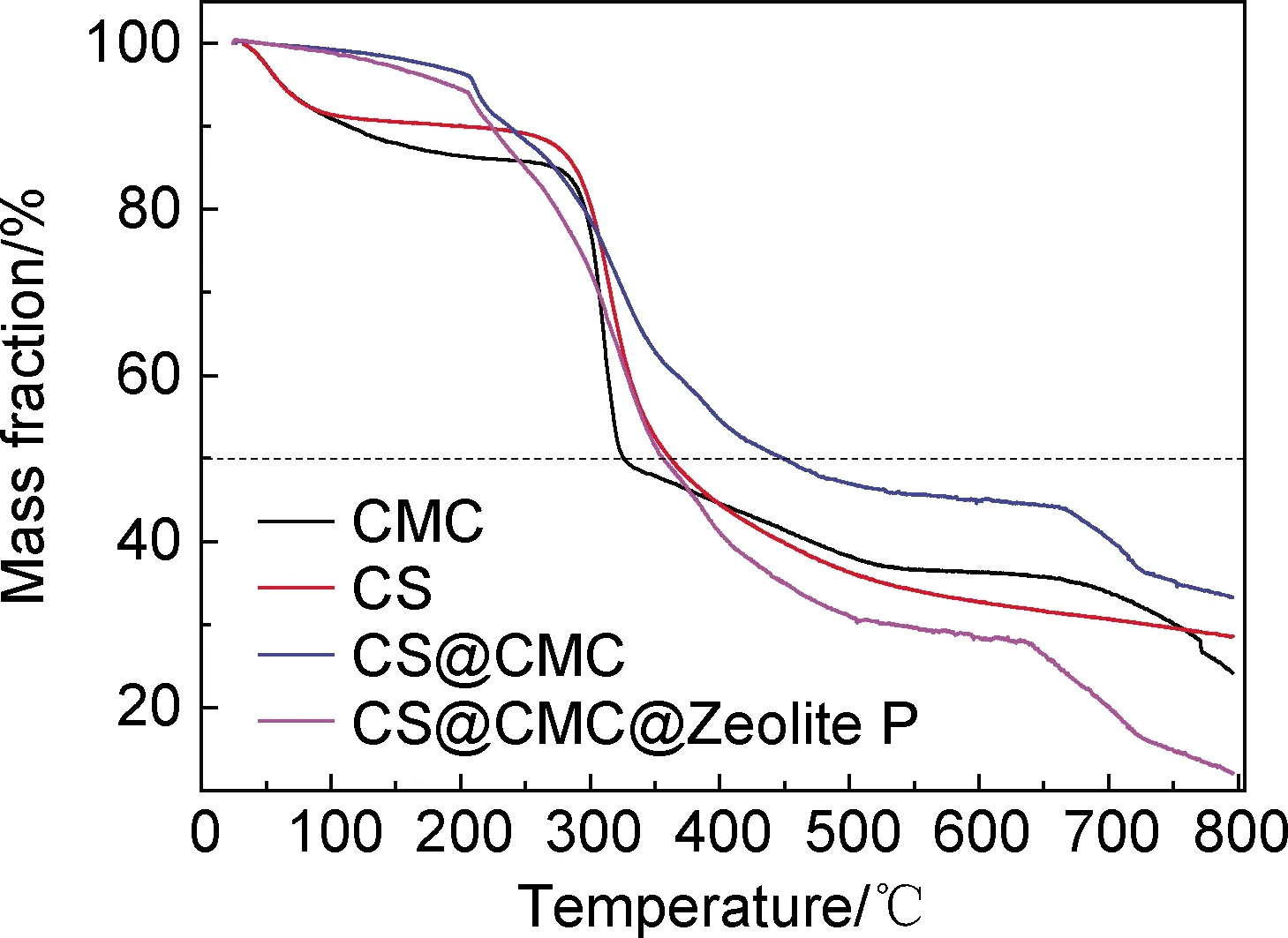
图7 热重分析谱图
2.4 复合水凝胶溶胀行为分析
图8为Zeolite P添加量在不同pH磷酸盐缓冲溶液对CS@CMC@Zeolite P溶胀行为的影响。复合水凝胶微球的溶胀行为可表明液体渗透到CS@CMC@Zeolite P微球中的速度和容易程度,以及对环境pH的敏感性。图8显示了不同pH下复合水凝胶微球的溶胀率之间的显著差异,表明复合水凝胶微球对pH高度敏感。在酸性条件下,CMC链形成紧密的螺旋状,CMC结构压缩,溶胀得到抑制。因此,在pH从1.2增加到7.4的过程中,CS@CMC链上的羧基转化为带负电荷的羧酸根离子,导致更高的静电斥力和水被吸收。同时CS包裹在CMC外部,形成的聚电解质复合物,避免水凝胶微球的瓦解。加入的Zeolite P镶嵌缠绕在CMC三维网格结构中,限制了聚合物链的扩展,导致其溶胀率比CS@CMC偏小。CS@CMC@Zeolite P在酸性条件下具有较小的溶胀率,可以减缓KDF溶出释放。所制备的CS@CMC@Zeolite P水凝胶微球能够应用于不同pH条件下的可持续给药系统。
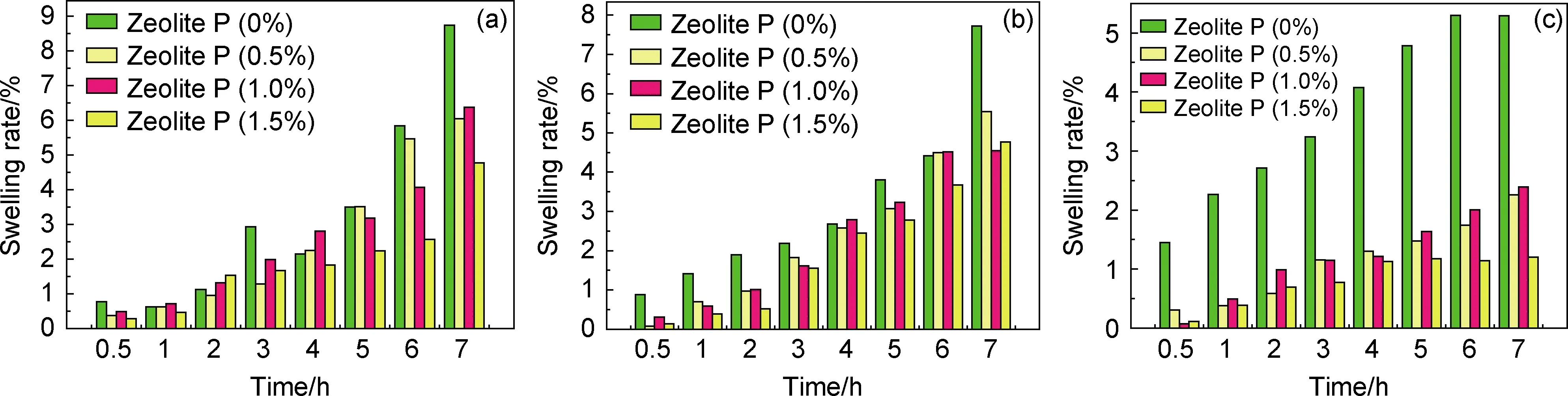
图8 不同pH CS@CMC@Zeolite P微球溶胀行为
2.5 KDF缓释行为分析
图9为Zeolite P添加量对CS@CMC@Zeolite P释放KDF的行为影响,在pH为7.4的环境下,CS@CMC@KDF突释现象明显,后续对KDF的释放也较快;添加Zeolite P之后CS@CMC@Zeolite P可有效减缓突释现象的发生,且对KDF具有有效的控释行为。由于KDF是水溶性的,导致包封率和载药率相对较低,添加1.5%Zeolite P抗菌微球具有最大包封率37.17%和最大载药率12.39%。

图9 Zeolite P添加量在pH=7.4环境下CS@CMC@Zeolite P@KDF微球释放KDF行为分析
KDF的释放模型见图10。在酸性环境中,CS表面的氨基基团缓慢电离,质子化的氨基在微球表面形成了水合层,阻碍水分子渗入微球,同时CMC链段在酸性环境中卷曲收缩,与内部的Zeolite P共同延缓了水分子进入微球内核,使KDF的溶出变得困难。在pH=7.4环境下,CMC表面的羧基去质子化,分子链段舒展,导致更多的水分子穿透聚合物结构,进入到水凝胶微球的内部,使KDF更加容易释放。KDF在中性或偏碱性环境中电离增强,溶解度增加。Zeolite P的含量增加,使KDF从微球内核迁移到表面更加的困难。释放结果表明,制备的CS/CMC/Zeolite P复合水凝胶微球载药体系,可用于胃肠道pH敏感环境中KDF的控释。

图10 CS@CMC@Zeolite P@KDF抗菌微球KDF的释放示意图
对添加1.5% Zeolite P抗菌微球进行释放动力学研究(表1),零级释放模型用来解释一些常见的糖衣药物和胶囊药物的释放过程。一级释放模型一般适用包含水溶性药物的多孔基质。Higuchi方程常拟合药物浓度扩散过程。

表1 释放动力学模型
对添加1.5% Zeolite P抗菌微球进行释放动力学方程拟合(图11)。在pH=7.4环境中CS@CMC@Zeolite P相关系数R2在零级、一级动力学方程以及Higuchi拟合方程中分别为0.48945,0.79629和0.7209。KDF的控释符合一级动力学方程和Higuchi拟合方程。所制备的复合抗菌微球对KDF具有一定的控释作用,KDF的释放为溶出扩散机制,形成了较为稳定的多孔水溶性微球。

图11 CS@CMC@Zeolite P@KDF微球在肠道模拟中动力学方程拟合结果
2.6 抗菌微球抑菌行为分析
KDF被动物食用后,可以降低胃肠道的pH值,控制细菌的生长。同时KDF在通过细菌细胞壁后解离并对细菌蛋白质合成产生破坏作用,未分离的KDF可以通过微生物的半透膜扩散到它们的细胞质中;一旦进入细胞,环境pH值在7附近,KDF就会解离并抑制细胞酶和营养物转运系统,从而杀死细菌并抑制细菌的繁殖。细菌需要营养来维持自身的新陈代谢,并与宿主竞争胃和肠道的营养。胃和肠道中细菌的数量越少,动物可以吸收的营养就越多[18-19]。使用KDF来减少胃肠道中的致病性和非致病性细菌对于动物的膳食能量利用是可行有效的。
图12为不同CS@CMC@Zeolite P@KDF抗菌微球含量对大肠杆菌(E.coli)和金黄色葡萄球菌(S.aureus)生长的影响。CS@CMC@Zeolite P@KDF抗菌微球对大肠杆菌和金黄色葡萄球菌有显著的抑菌效果,随着抗菌微球浓度越高,其抑菌效果更明显。抗菌微球可有效抑制细菌的滞后期,随着浓度的增加,细菌的滞后时间越长,表明抗菌微球抑制了细菌的生长,影响了细菌生长所需的酶、能源和中间代谢产物。同时,细菌的对数生长期也明显缩短。与王秀丽等[20]制备的Zeolite P抗菌剂相比,相同抗菌液浓度,具有更高的抑菌性,所制备的CS@CMC@Zeolite P@KDF抗菌微球能负载有效的KDF,具有更优异的抗菌性。在24 mg/mL和48 mg/mL浓度下,细菌生长受到抑制,较多菌体死亡,几乎不再繁殖,但是在低浓度时(12 mg/mL)具有时效性。可预见的高浓度下的抗菌液具有较低的pH值,可以改变细菌生长的环境,抑制细菌的繁殖。当抗菌液分解完之后,细菌开始快速繁殖。
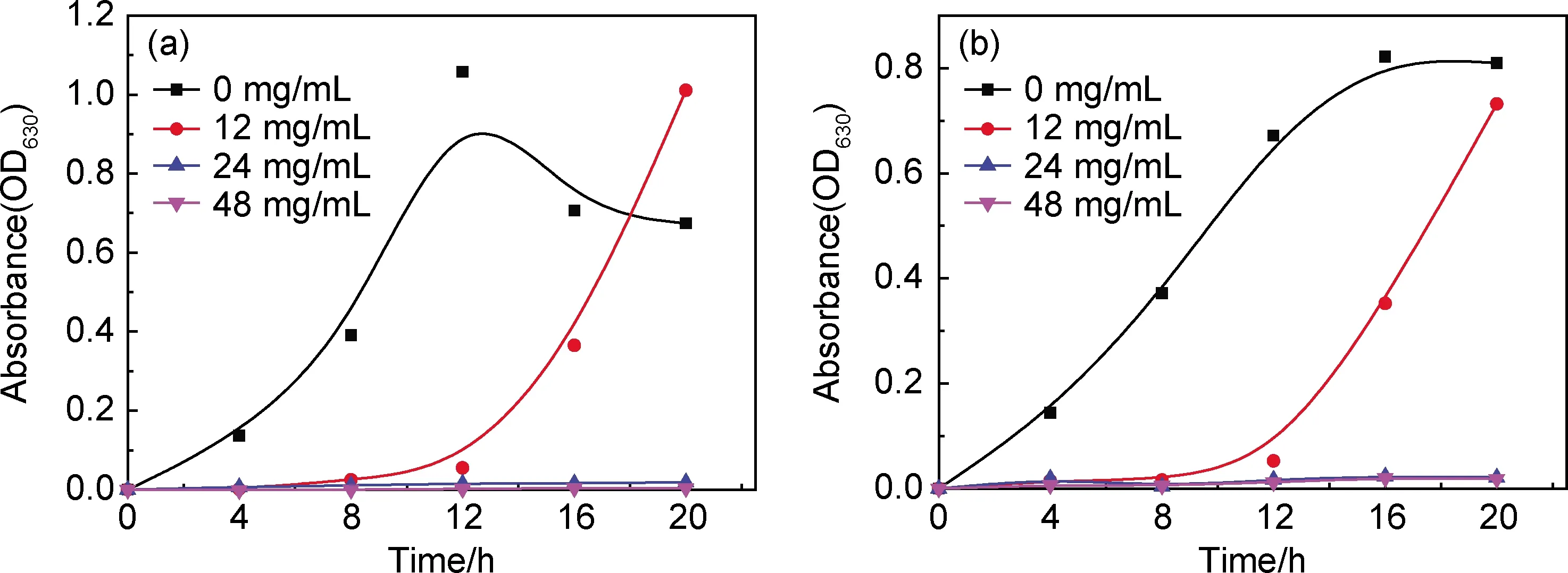
图12 不同抗菌微球含量对大肠杆菌(a)和金黄色葡萄球菌(b)的生长影响
3 结论
(1)通过凝聚法,经Zeolite P吸附KDF分散在CMC基质中,FeCl3作为交联,与CS组装制备出了KDF缓释抗菌微球。CS与CMC通过离子键形成聚电解质复合物,形成的水凝胶微球比天然高分子材料CS和CMC具有更高的热稳定性,Zeolite P镶嵌缠绕在CMC基质中。
(2)CS@CMC@Zeolite P吸水溶胀差异性表明复合水凝胶微球具有高pH敏感性。CS@CMC@Zeolite P@KDF抗菌微球对KDF具有良好的控释效果,添加Zeolite P可有效减小突释现象的发生,且对KDF具有更为优异的控释效果。通过释放动力学线性拟合,释放过程遵循一级动力学模型和Higuchi模型,所制备的抗菌微球对KDF具有一定的缓释作用。
(3)制备的抗菌微球CS@CMC@Zeolite P@KDF对大肠杆菌和金黄色葡萄球菌具有显著抑制生长的效果,在抗菌液浓度为24,48 mg/mL时,细菌生长受到抑制,几乎不再繁殖,低浓度下具有时效性,但前期仍具有抗菌性。所制备的CS@CMC@Zeolite P@KDF体系为KDF的推广和使用提供了参考。
