新疆马铃薯早疫病菌生物学特性研究
2021-04-20杨茹薇刘易徐琳黎孙慧李江涛
杨茹薇 刘易 徐琳黎 孙慧 李江涛


摘 要:通过平板培养分离对新疆马铃薯早疫病菌从培养基、pH、紫外线照射、碳源、氮源等5个方面进行了生物学特性的研究。结果表明:马铃薯早疫病菌丝接种在PDA、PSA培养基,pH为8时生长速率最快;在7种紫外线照射不同时间处理后,50min照射后生长最佳;碳源、氮源分别为可溶性淀粉和硝酸钾的培养基菌丝生长最快。
关键词:早疫病;生物学特性;菌丝
中图分类号 S435文献标识码 A文章编号 1007-7731(2021)06-0116-03
Study on Biological Characteristics of Potato Early Blight in Xinjiang
YANG Ruwei et al.
(Comprehensive Experimental Farm, Xinjiang Academy of Agricultural Sciences, Urumqi 830012, China)
Abstract: The biological characteristics of P. early blight strain of potato in Xinjiang were determined from five aspects including different culture medium, pH, ultraviolet radiation, carbon source and nitrogen source by plate culture. The results showed that the growth rate of potato early blight hypHa inoculated on PDA and PSA medium was the fastest when pH was 8. The best growth rate was 50min after 7 kinds of UV irradiation. The hypHa grew fastest in the medium with soluble starch and potassium nitrate as carbon source and nitrogen source respectively.
Key words: Early blight; Biological property; HypHa
馬铃薯属于茄科茄属一年生草本块茎植物,是重要的粮食、蔬菜兼用作物[1]。而茄链格孢菌侵染后引起的早疫病在世界范围内普遍发生,并且在各地马铃薯种植区域均存在,其发生呈逐年加重趋势[2],给当地马铃薯生产造成了巨大损失,已引起了有关专家及管理部门的高度重视[3]。尤其在发展中国家被认为是仅次于马铃薯晚疫病的第二大马铃薯病害[4]。生产上对马铃薯晚疫病、病毒病的抗病性评价较多[5,6],而对早疫病的研究仍较少[7,8]。
早疫病原菌为茄链格孢,属半知菌亚门、链格孢属真菌。茄链格孢分生孢子梗单生或簇生,直或弯曲,浅黄褐色或青褐色,不分枝或罕生分支[9]。分生孢子常单生,直或稍弯曲,倒棒状,青褐色,具横膈膜5~12个,纵、斜隔膜0~5个[10]。
近年来,随着种植结构的调整,马铃薯种植业发展较快,种植面积逐年增加,因此,对于马铃薯病害研究也日趋重要。早疫病广泛发生的主要原因是由于主栽区连年种植,土壤中的有机质含量下降,导致植株抗病害性降低,马铃薯易受早疫病孢子侵染。随着全球气候的变化,病菌群体结构及菌株致病力也发生了变化。这些原因造成早疫病的发病率、危害程度呈逐年增加态势。为了有效防控早疫病,本试验通过对马铃薯早疫病菌的生物学特性的研究,以期为新疆早疫病的预测预报和综合防治提供科学依据。
1 材料与方法
1.1 标本采集 对新疆马铃薯种植主产区进行早疫病的病样采集,大田采集后置于冰盒密封标记,采用样品4℃冰箱低温保存,保证样品中早疫病菌活性。
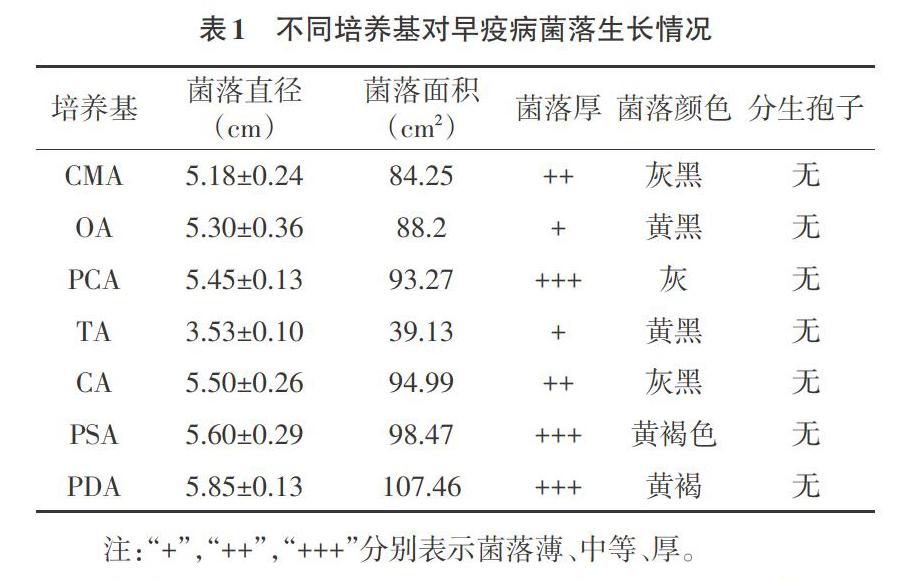
1.2 培养基 试验选用玉米粉培养基(CMA)、燕麦培养基(OA)、马铃薯胡萝卜培养基(PCA)、番茄汁培养基(TA)、胡萝卜培养基(CA)、马铃薯蔗糖培养基(PSA)、马铃薯葡萄糖培养基(PDA),每瓶所含培养基体积均为40mL[11]。
1.3 病原菌的分离、纯化与鉴定 将带有典型病症的叶片使用自来水冲洗,冲去叶片表面污物及菌丝,将其浸泡在75%的酒精中30s,再放入次氯酸钠中浸泡30s,使用灭菌水冲洗3遍[12]。用灭过菌的剪刀剪去严重病症部位,取病部交界的组织背面朝上接种在PDA平板培养基上,每皿3~4块并置于25℃培养箱中暗培养待观察。上述带病组织在25℃恒温暗培养3d,待菌落长到直径为1~2cm时,镜检组织并确认目标菌落。在无菌操作中,从目标菌落的边缘挑取一小块带有菌丝的培养基再移接于PDA培养基进行纯化,直至菌落生长整齐一致无杂菌出现为止[12],得到供试菌株。
1.4 培养基对早疫病菌丝生长的影响 将病原菌接种到PDA平板上,25℃培养5d后,用内径5mm的打孔器取出菌饼,将菌块接种到不同培养基平板中心处[13],培养基分别选用CMA、OA、PCA、TA、CA、PSA、PDA[14],每个接种3次重复,采用25℃暗培养,第7天时使用十字交叉法测量菌落直径。
1.5 pH对菌丝生长的影响 用浓度为1mol/L的盐酸和1mol/L氢氧化钠溶液,分别配置pH为4、5、6、7、8、9、10共7个梯度处理,制作不同pH值PDA培养基后,分别接种菌饼,测量方法同1.4。
1.6 紫外线照射时间对早疫病菌丝生长的影响 将菌饼接种后,分别置于高度为50cm的40W的紫外灯下,分别使用紫外光照射0、5、10、20、30、40、50min,25℃条件暗培养,测量方法同上。
1.7 碳源对早疫病菌丝生长的影响 将菌饼接种到以查氏培养基为基础培养基,分别以等量葡萄糖、麦芽糖、乳糖、甘露糖、果糖、山梨糖、可溶性淀粉替代蔗糖,配置7种不同碳源培养基,分别接种菌饼,25℃条件暗培养,测量方法同上。
1.8 氮源对早疫病菌菌丝生长的影响 将菌饼接种到以查氏培养基为基础培养基,分别以等量硝酸钾、酵母粉、半光氨酸(Cys)、甘氨酸(Gly)、丙氨酸(Ala)、谷氨酸(Met)、NH4Cl替代硝酸钠,配成7种不同氮源培养基,分别接种菌饼,25℃条件暗培养,测量方法同上。
2 结果与分析
2.1 不同培养基对菌丝生长的影响 菌株在7个供试培养基上均能正常生长,不同培养基生长差异情况见表1。由表1可知,各培养基中以PDA、PSA长势最优,菌落厚度较厚,菌落直径分别为5.85cm、5.6cm,表现较好。各培养基菌落为圆形,气生菌丝灰色且生长均匀,菌落颜色略有差异,其他处理生长速度差异不大,均低于PDA培养基,7种培养基上都不产孢。
2.2 不同pH对早疫病菌丝生长的影响 早疫病菌丝在pH值5~10范围内均能生长,较适宜的pH值为7~9,pH值为8时生长最佳,pH值过高或过低均会抑制早疫病菌丝的生长。由表2可知,随着时间的增加,菌丝呈正相关增长,但菌丝生长存在差异,其中pH为8的平均变化值最大,其次是pH为7和9,长势最差为pH4处理,此时的pH浓度基本不能使菌丝生长。
2.3 不同紫外线照射时间对早疫病菌丝生长的影响 不同紫外线照射时间对菌落第2天生长情况影响见表3。由表3可知,照射时间在20~60min时,菌落生长情况基本稳定,其中紫外线照射为50min时菌丝长度为5.7mm,表现最佳,但在5min、10min照射处理后均明显低于对照处理。
2.4 不同碳源对早疫病菌丝生长的影响 马铃薯早疫病菌丝在7种不同碳源环境上均能生长,但生长速率明显存在差异。由图1可知,加入可溶性淀粉作碳源的培养基中菌丝的生长速率较快,第2天菌落直径达7.28mm,其次是加入乳糖做碳源的培养基,而加入山梨糖的培养基菌丝生长缓慢仅为1.21mm,基本无变化。
2.5 不同氮源對早疫病菌丝生长的影响 不同氮源对早疫病菌菌丝生长的影响差异较大,由图2可知,菌丝生长情况由高到低排序依次为:硝酸钾>酵母粉>甘氨酸>氯化铵>丙氨酸>谷氨酸。其中,因加入半胱氨酸后培养基呈液体状态,影响菌落及菌丝生长情况,结果不做对比计入。
3 结论与讨论
由本试验结果表明,选用的菌株使用PSA、PDA培养基、在pH为8时长势最好,这与其他报道pH6~8相似,另外加入可溶性淀粉为碳源,硝酸钾为氮源的培养基上长势最优;紫外线照射时间20~60min时均能正常生长,其中以照射50min处理生长较优。由此可见,马铃薯早疫病病菌在不同条件下生物学特性存在差异,菌株的致病力是否存在分化现象仍有待进一步研究。
参考文献
[1]柳俊.我国马铃薯产业技术研究现状及展望[J].中国农业科技导报,2011,13(5):13-18.
[2]陆家云.植物病原菌真菌学[M].北京:中国农业出版社,2000:397.
[3]张福光,杨志辉,朱杰华.等.河北省马铃薯早疫病菌群体遗传结构的研究[J].菌物学报,2012,31(1):40-49.
[4]刘洋,蒋继志,杨发茂,等.几种化学物质诱导马铃薯对早疫病的抗性及其机理研究[J].华北农学报,2006,21(2):113-117.
[5]王晓明,金黎平,尹江.马铃薯抗病毒病育种研究进展[J].中国马铃薯,2005,19(5):285-289.
[6]全哄友,卫双荣,莫荣富.马铃薯新品种引种试验研究[J].现代农业科技,2009(15):109-113.
[7]台莲梅.马铃薯早疫病菌多样性和侵染过程及品种抗病性机制研究[D].大庆:黑龙江八一农垦大学,2011.
[8]王立春,盛万明,李风云.国外马铃薯品种资源的引进与筛选鉴定[J].中国农学通报,2008,24(2):371-375.
[9]刘丽丽.马铃薯早疫病菌产孢诱导、嘧菌酯敏感性及品种抗病性的研究[D].保定:河北农业大学,2013.
[10]范子耀,王文桥,孟润杰,等.7种杀菌剂对马铃薯早疫病菌室内毒力及田间防效[J].农药,2011,50(7):531-533.
[11]刘霞,陈晴晴,郑煜,等.马铃薯抗晚疫病试管苗评价体系初探.[J].云南农业大学学报,2012,27(6);802-808.
[12]张福光.河北省早疫病菌群体结构研究及马铃薯栽培品种对早疫病的抗性评价[D].保定:河北农业大学,2011:6.
[13]何凯,杨水英,黄振霖,等.马铃薯早疫病菌的分离鉴定和生物学特性研究[J].中国蔬菜,2012(12):72-77.
[14]台莲梅,郑寰宇,左豫虎,等.黑龙江省马铃薯早疫病菌生物学特性研究[J].植物保护,2012,38(1):85-89.
[15]王文慧,骆得功,魏周全.马铃薯黑痣病菌生物学特性测定[J].中国马铃薯,2015(1):33-34.
(责编:张宏民)
