长江上游圆口铜鱼人工繁殖和胚胎发育研究
2021-04-20胡佳祥张植元王雄延陈娇范泽
胡佳祥 张植元 王雄延 陈娇 范泽


摘 要:在不同温度条件下,采用不同剂量的绒毛膜促性腺激素(HCG)、促黄体释放激素类似物A3(LHRH-A3)和鲤鱼脑垂体(PG)对性腺发育良好的圆口铜鱼(Coreius guichenoti)进行人工催产,半干法授精,采用锥形底冲水孵化器和孵化框分别置于江水和循环水中进行孵化,利用体视显微镜观察早期发育过程,详细记录各发育阶段的形态特征及发育时序。结果显示:底冲水孵化效果优于孵化框,循环水孵化效果优于江水;圆口铜鱼成熟卵圆形、青灰色,卵径(1.71±0.23)mm,受精卵吸水后迅速膨胀,卵膜外径平均(6.89±0.43)mm。在19.8~20.1℃水温条件下,胚胎发育历时48h+30min,胚胎发育过程可划分为受精卵、卵裂、囊胚、原肠胚、神经胚、器官形成和出膜7个阶段,共27个时期。初孵仔鱼全长(6.45±0.21)mm,眼色素、胸鳍明显,背鳍、鳃弓、肛门原基出现。出膜第4天鳔充气,肠道贯通,开口摄食。研究结果丰富了圆口铜鱼人工繁殖和早期发育资料,可为其人工增殖提供参考。
关键词:圆口铜鱼;人工催产;胚胎发育;仔鱼发育;形态特征
中图分类号 Q954.4 文献标识码 A 文章编号 1007-7731(2021)06-0075-06
Study on the Artificial Propagation Andembryonic Development of Coreius guichenoti in the Upper Yangtze River
HU Jiaxiang1 et al.
(1SiChuan Water Conservancy Vocational College, Chengdu 611231, China)
Abstract:Different doses of the mature Coreius guichenoti was injected with human chorionic gonadotrophin (HCG), luteinizing hormone releasing hormone A3 (LHRH-A3) and carp pituitary gland (PG) for spawning inducing under various temperatures. The results show that the effect of bottom flush incubator is better than that of incubator, and the effect of circulating water is better than that of river water. The morphological feature and development characteristics of C.guichenoti was described during the embryo and larvae stage. These results showed that the ripe eggs were oval, steel-gray and (1.71±0.23)mm in diameter, reached the diameter of (6.89±0.43)mm while it is expanded by adsorption of water. The hatching time lasted for 48.5h with the average water temperature of 19.8~20.1℃.The embryo development could be divided into 27 identical phrases, and 7 main phases,including fertilized egg, cleavage stage, blastula stage, gastrula stage, neural stage, organogenesis stage and hatching stage. The new hatched larvae were (6.45±0.21)mm in total length, and the eye pigment, pectoral fins, caudal fin, gill arch and anus precordium were formed. The formation of digest tract, inflation of air bladder and start to search for feed were observed in the 4 days post hatching. These results enriched the basic data of the artificial reproduction and early development observation of C. guichenoti which may be useful for the artificial breeding.
Key words: Coreius guichenoti; Artificial inducing; Embryonic development; Larval development; Morphological characteristics
圓口铜鱼(Coreius guichenoti)为鲤科(Cyprinidae)鮈亚科(Gobioninae)铜鱼属的鱼类,也是我国特有鱼类,以地方水密子为人熟知,曾大量分布于嘉陵江、岷江、雅砻江及金沙江中下游等水域,是产区重要的经济鱼类和优势鱼类[1]。圆口铜鱼属于江河流水性鱼类,有短距离洄游习性[2]。近年来,由于受修建水利水电工程、过度捕捞、水体污染等因素影响,许多河流的连通性被破坏,流水生境萎缩甚至消失,以圆口铜鱼为代表的众多鱼类野生资源急剧下降[3]。因此,开展人工增殖放流以保护和恢复野生鱼类资源,已被列为我国鱼类保护工作的基本政策之一[4]。增殖放流的重要前提之一是拥有成熟的人工繁育技术。目前关于圆口铜鱼的研究主要集中在遗传学[4,5]、野外繁殖生物学调查[2,6]、年龄与生长[7-8]、种群资源[9-10]、病害防治[11-12]等方面,也有学者和渔业从业人员对圆口铜鱼人工繁殖进行了探索,但圆口铜鱼人工繁育技术仍未取得实质性突破[13]。为此,本研究采用江水网箱驯养亲鱼、人工注射激素催产的方法获得圆口铜鱼受精卵,观测受精卵孵化过程,并比较几种孵化方式的优劣,以期为完善圆口铜鱼人工繁殖技术提供参考。
1 材料与方法
1.1 亲鱼培育 2017年3月至6月,在长江上游四川泸州黄舣镇小石坝(105°33′59.20″E、28°54′20.91″N)的船体网箱(5m×5m×2m=50m3)中驯养熟化圆口铜鱼亲鱼(126尾)。养殖密度2.08kg/m3,亲鱼规格0.49~0.71kg,并在网箱中套养0.22kg/m3的鲫鱼以带动摄食。投喂饵料为商品饲料海大6602/4.0(成都海大生物科技有限公司,蛋白含量41%),日投饵量为体重的1.5%~2.0%,按早中晚3次平均投喂。培育至2017年6月,亲鱼个体重量为0.59~0.81kg,部分超过1kg,60%个体性腺发育成熟。
1.2 亲鱼挑选 挑选体表无明显伤痕、活力健壮、性腺发育良好的圆口铜鱼亲鱼用于人工催产。亲鱼性腺发育良好的判断标准为:雌鱼腹部明显膨大、松软、有弹性,生殖孔明显突出、红润;雄鱼腹部相对较小,体表和胸鳍上粗糙,有“珠星”,轻轻挤压腹部有乳白色精液流出,并能在水中很快散开。
1.3 人工催产与授精 用于亲鱼人工催产的药品为绒毛膜促性腺激素(human chorionic gonadotrophin,HCG,2000U/支,宁波第二激素厂)、促黄体释放激素类似物A3(luteinizing hormoner eleasing hormone A3,LHRH-A3,10mg/支,宁波第二激素厂)和鲤鱼脑垂体(carp pituitary gland,PG,研磨成细粉后使用),根据亲鱼体重使用生理盐水配制注射混悬液,然后用无菌注射器(注射器预先用胶带将针头基部缠绕,预留1cm针头外露)沿胸鳍基本斜向前入针0.5~1cm,将混悬液注射进亲鱼体腔。本试验圆口铜鱼人工催产、授精与孵化共分4次进行,分别在2017年6月16、18、28日和7月2日进行,总共对28尾亲鱼进行人工催产,雌雄亲本各14尾,♀∶♂=1∶1,催产详情见表1。雌鱼采用2次注射法,雄鱼采用1次注射法,剂量为雌鱼的50%。
采取半干法人工授精:首先在白瓷盆中加入4.5%生理盐水10mL,再将雄鱼精液挤入盆中,随后挤入雌鱼卵;用灭菌羽毛轻轻搅拌30s,使精卵充分混合,然后加入葡萄糖注射液20mL,继续搅拌1min后加清水洗去精液及粘液。静置30min,转移至孵化器中孵化(转移过程中需避免剧烈震荡和阳光直射)。
1.4 人工孵化 试验设置4种方式孵化圆口铜鱼受精卵,分别为圆锥形孵化器,孵化用水为未处理的江水;圆锥形孵化器,孵化用水为经循环水系统净化后的江水;木制孵化框(长50cm×宽50cm×高20cm,周围覆1层40目聚乙烯网),孵化用水为未处理的江水;木制孵化框,孵化用水为经循环水系统净化后的江水。每种孵化方式设置2个平行组。随机选取约8000粒圆口铜鱼受精卵,平均分成8组,每组约1000粒,置于8个孵化装置中进行孵化。孵化过程中记录各组受精率及孵化率。
圆锥形孵化器包括供气装置、供水装置、纱网桶等设施(图1),是一种便携式底部冲水孵化器,可以保持漂流性鱼类在孵化器中持续翻滚,另外还可通过底部冲水阀阀门和气石阀门控制受精卵的翻滚程度。
1.5 胚胎发育观察 在泸州船体网箱内挑选2组驯养成熟的亲鱼,用鱼罐车运输至四川攀枝花观音岩水电站鱼类增殖站(101°26′03.94″E、26°31′16.92″N),在站内进行人工催产孵化(水温(20.11±017)℃,锥形孵化器冲水孵化),并进行胚胎发育观察。每次取受精卵15~20颗,采用XTL-340体视镜(上海绘统光学仪器有限公司)观察胚胎和仔鱼发育过程,并对其各时期典型的形态特征进行照相。以50%以上观察个体出现阶段性特征的时间作為该发育时期的起始时间。各发育阶段的特征主要参考何学福等的报道划分不同阶段。胚胎发育阶段每15min观察1次,仔鱼发育阶段每12h观察1次。使用XTL-340体视显微镜对圆口铜鱼受精卵、胚胎及仔鱼进行拍照,并测量卵径、卵间隙和仔鱼的全长、肛后长、体高等参数,每次测量15~20粒(尾)。
2 结果与分析
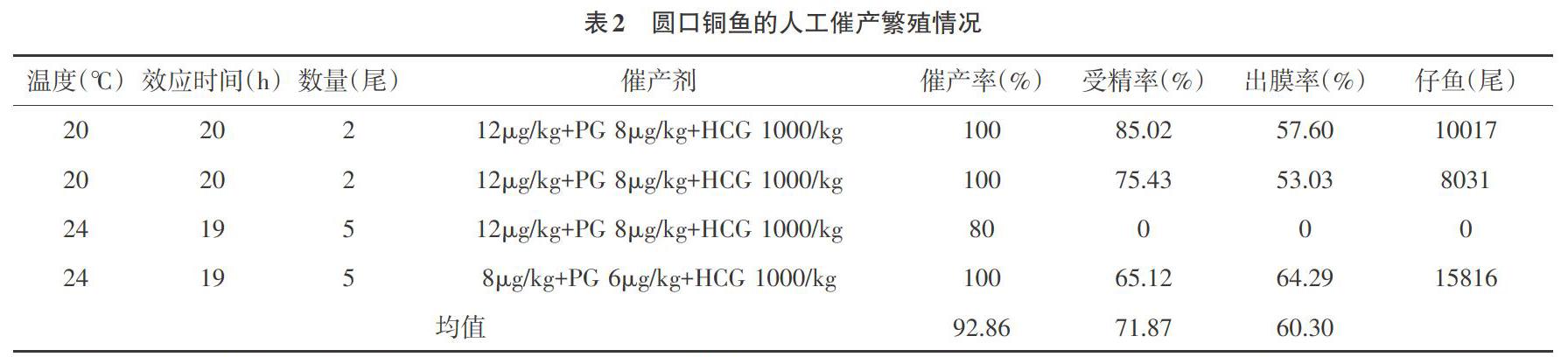
2.1 催产繁殖效果 2017年6月16日至7月2日共进行了4次催产,共催产雌鱼14尾,产卵13尾,平均催产率92.86%,平均受精率71.87%,平均出膜率60.30%,总共获得圆口铜鱼初孵仔鱼33864尾。由表2可知,在12μg/kg+PG 8μg/kg+HCG 1000/kg注射条件下,20℃水温时,圆口铜鱼催产率为100%,孵化率为80.43%,出膜率为55.32%;24℃水温时,催产率为80%,受精率为0。而在24℃水温条件下,注射8μg/kg+PG 6μg/kg+HCG 1000/kg的催产剂,圆口铜鱼亲本的催产率为100%,受精率为65.12%,出膜率为64.29%。圆口铜鱼的人工催产繁殖情况见表1。
2.2 不同孵化方式对孵化率的影响 在水温20℃条件下,以圆锥形底冲水孵化器和孵化框分别在江水和自制循环水中进行孵化,孵化结果见表3。由表3可知,以圆锥形低冲水孵化方式孵化圆口铜鱼受精卵,在循环水和江水的孵化环境下,其孵化率分别为72.03%和64.95%;以孵化框作为孵化器,在循环水和江水的孵化环境下,其孵化率分别为49.67%和34.00%。由此可见,圆锥形低冲水孵化器孵化圆口铜鱼受精卵的孵化效果优于孵化框孵化,在循环水中的孵化效果也优于在江水中的孵化效果。此外,在孵化框孵化过程中发现,大量的受精卵堆积在孵化框的角落和气石下方,部分受精卵缺氧死亡,这可能是导致孵化框孵化率较低的重要原因。
2.3 卵子特征 圆口铜鱼受精卵青灰色,属漂流性卵。未受精卵卵径(1.71±0.23)mm,受精后5min开始吸水,吸水后迅速膨大,受精后30min卵径达到最大,为(6.89±0.43)mm,卵周隙为(2.66±0.14)mm。
2.4 胚胎发育 圆口铜鱼胚胎发育属于典型的盘状分裂,在水温(20.11±017)℃条件下,历时48h+15min出膜,整个过程主要经历胚盘隆起、卵裂、囊胚、原肠胚、神经胚、器官形成和出膜7个阶段,共27个时期。
2.4.1 胚盘隆起及卵裂 受精45min后,原生质向动物极集中,并逐渐形成隆起,胚盘较高,位于动物极中央(图2-1)。受精1h后,胚盘中央出现分裂沟,胚盘裂成2个均等的分裂球,进入2细胞时期(图2-2);受精1h+10min后第1次卵裂,分裂沟与第1次分裂沟垂直,形成大小相近、形态相似的4个细胞,进入4细胞时期(图2-3);20min后,进入8细胞时期,此时细胞大小不均匀,中间细胞略大于两侧(图2-4);受精后1h+48min胚胎发育进入16细胞时期,细胞排列不规整,单层(图2-5);受精后2h+10min,原生质网开始收缩,细胞浅灰色,进入32细胞时期(图2-6);再经过30min,进入64细胞时期(图2-7);之后随着细胞不断分裂,细胞较小,轮廓清晰,动物极似桑葚状,受精卵进入多细胞时期,又称为桑葚胚期(图2-8)。
2.4.2 囊胚阶段 随着细胞不断的分裂和胚盘隆起,囊胚层在卵黄囊上形成1个半球状隆起,受精后4h+30min达到囊胚早期(图2-9);之后细胞下移,囊胚层逐渐下包,囊胚腔出现,受精后5h+30min进入囊胚中期(图2-10);受精后6h+45min,胚盘到达最高点,之后边缘细胞开始向卵黄表面扩展和下包,胚盘越来越薄,下包至1/3处,囊胚腔形成,进入囊胚晚期(图2-11)。
2.4.3 原肠阶段 胚层下包约卵黄囊的1/2处,胚盘边缘增厚,胚环出现,背唇呈新月状,进入原肠早期(图2-12);受精后11h,胚层下包约卵黄囊的2/3处,胚层细胞集中加厚隆起,形成胚盾,进入囊胚中期(图2-13);受精后12h+30min,胚层下包至卵黄囊的3/4处,胚盾继续延伸,卵黄栓形成,发育进入囊胚晚期(图2-14)。
2.4.4 神经胚期 受精后13h+15min,胚层下包至卵黄囊的4/5处,胚盾厚度增加,神经板雏形形成,进入神经胚期(图2-15);再经过2h+15min,胚孔逐渐封闭,胚体前端隆起,后端变薄,胚胎相位大部分为近圆形,进入胚孔封闭期(图2-16)。
2.4.5 器官形成期 受精后16h+40min,解剖镜下能观察3~4对肌节,神经板头部隆起(图2-17);受精卵发育到17h+10min,眼原基出现,肌节6~7对,(图2-18);受精后18h+30min,眼原基扩大如扁豆状,肌节12~14对(图2-19);1h+15min后尾牙出现,脑部分化,肌节17~19对(图2-20);再经过1h+55min,胚体后脑两侧出现椭圆形听囊,中脑隆起,肌节20~22对(图2-21);受精后23h+10min,眼晶体形成,肌节31~33对,眼径0.13mm(图2-22);受精后25h+40min,胚体开始颤动,尾牙脱离卵黄囊,尾部褶皱明细,肌节34~35对(图2-23);胚胎发育到27h+10min,卵黄囊呈葫芦状,在听囊下方出现心脏原基,肌节36~43对(图2-24);在其后的2h+20min,耳石出现,鳍褶稍宽,胚体不断抽动,肌节46~48对(图2-25);再经过4h,胚体不断伸长,尾褶延伸,心脏开始搏动,可见无色血液沿固定路线缓慢流动(图2-26)。
2.4.6 出膜期 血液循环出现之后,血管数量增多,血流量增大,胚体运动加快,卵膜逐渐软化,尾部首先从卵膜中伸出,最后破膜而出,胚胎发育到48h+15min,出膜率达到50%,进入出膜期(图2-27)。该阶段受精卵眼色素开始沉积,胸鳍原基、耳石、鳃弓出现。
2.5 仔鱼发育 圆口铜鱼初孵仔鱼体透明,较轻,能随水流漂动。卵黄囊前端为圆球状,后部呈棒状。头部紧贴卵黄囊,心脏位于卵黄囊前方,心率78~90次/min。眼色素明显,尾、背部鳍褶明显,胸鳍明显,鳃弓原基、肛门原基出現,肌节50对(36+14)。仔鱼全长(6.45±0.21)mm,头长(0.89±0.13)mm,肛后长(2.42±0.15)mm,眼径(0.45±0.16)mm(图3-1)。出膜第1天,仔鱼全长(7.12±0.13)mm,头部略前倾,离开卵黄囊,鳃弓4对;眼晶体出现黑色素;卵黄囊上的血管红色,血细胞分布明显,尾鳍褶皱延伸至背部(图3-2)。出膜第2天,仔鱼全长(7.54±0.27)mm,头部出现斑点状黑色素,眼晶体黑色素明显。胸鳍变大,游泳能力增强(图3-3)。出膜第3天,仔鱼全长(8.04±045)mm,卵黄明显变小,鳔开始充气,背鳍出现,体表黑色素明显,尾部脊索开始上翘,尾鳍条7~8枚。部分仔鱼可上下蹿动(图3-4)。出膜第4天,仔鱼全长(8.56±0.51)mm,鳃弓5对,肌节50(36+14),心率92~113次/min,鳔充气全,平游,肠道贯通,开口摄食(图3-5)。
3 结论与讨论
3.1 繁殖特征 圆口铜鱼繁殖水温为(17.5~22.5)℃,繁殖高峰期为5月下旬至6月上旬,繁殖行为还受水位变幅的影响[2]。研究结果显示,圆口铜鱼在(20~24)℃水温条件下均能完成人工繁殖并保持较高的孵化率。但水温越高,圆口铜鱼亲鱼的效应时间和受精卵的出膜时间有所缩短,这与多数鱼类繁殖特征一致[14]。
3.2 催产剂种类和剂量 研究结果表明,综合考虑催产率、受精卵、孵化率等指标,使用绒毛膜促性腺激素(HCG)+促黄体释放激素类似物A3(LHRH-A3)+鲤鱼脑垂体(PG)组合人工繁殖圆口铜鱼效果较好,在20℃条件下,注射剂量以12μg/kg+PG 8μg/kg+HCG 1000/kg为宜。但是鱼类人工繁殖催产剂受水温及亲鱼成熟度的影响,注射过量则会导致亲鱼过熟[14]。本研究在24℃水温条件下注射20℃相同剂量就导致授精失败,因此随着水温升高,应适当减少注射剂量。
3.3 孵化环境 圆口铜鱼产漂流性卵[15],其受精卵需经长距离漂流才能孵化出膜[2]。因此,圆口铜鱼的人工孵化与其他产沉性卵和粘性卵鱼类不同。本研究采用锥形底冲水孵化器的孵化率明显高于孵化框孵化,表明采用底冲水的孵化方式能够满足圆口铜鱼受精卵在水体中的漂浮过程。另外,圆口铜鱼在循环水中的孵化率也显著高于江水中孵化,这可能与水体的溶氧、氨氮、透明度紧密相关,但具体影响因子还有待进一步的研究。
3.4 受精卵特点 圆口铜鱼的卵径为1.71mm,略小于鮈亚科的银鮈(Squalidus argentatus)(1.88mm)、蛇鮈(Saurogobio dabryi)(1.9~2.3mm)[16]和华鳈(Sarcocheilichthys sinensis)(1.6~2.0mm)[17],与长鳍吻鮈(Rhinogobio ventralis)(1.7~1.9mm)接近(表4)。圆口铜鱼受精卵吸水后的卵周隙(2.66mm)大于产漂流性鱼卵的长鳍吻鮈(2.54mm)[18]、银鮈(1.71mm)、蛇鮈(0.8~0.9mm)[16]、华鳈(1.21mm)[17]、长薄鳅(Leptobotia elongata)(1.24mm)[19]、花斑副沙鳅(Parabotia fasciata)(0.65mm)[20]等鱼类。鱼卵受精吸水膨胀后形成较大的卵周隙,可以有效抗击外来环境冲击,提高受精卵存活率[21,22]。因此,圆口铜鱼受精卵形成较大的卵周隙,一方面可以为胚胎发育提供较为稳定的内部环境,保证其胚胎正常发育;另一方面,圆口铜鱼产卵场主要集中在长江上游和金沙江中下游,其水量、流速较大,受精卵漂流距离较长[23],较大的卵周隙可提高其抗冲击能力,同时能扩张受精卵体积,减少密度,实现漂流发育,提高其孵化率。这一特征是圆口铜鱼为适应生存环境而形成的相应的繁殖策略。
3.5 胚胎及仔鱼发育特点 圆口铜鱼胚胎发育经历胚盘隆起、卵裂期、囊胚期、原肠胚期、神经胚期、器官形成期和出膜期7个阶段,符合硬骨鱼卵胚胎发育一般规律。圆口铜鱼胚胎发育时长较短,共历时48.5h(19.8~20.1℃),长于余志堂等[15]对圆口铜鱼的研究结果(35.55h,18.2~32.8℃),短于同亚科的华鳈73.3h(22.5~25℃)[17]和蛇鮈81h(15.5~17.5℃)[16],与产漂流性卵鱼类的长鳍吻鮈56h(17.6~18.3℃)[18]、长薄鳅48h(22~23℃)[19]、银鮈40h(17.5~27.0℃)[24]较为接近(表4)。
同时,铜鱼初孵仔鱼个体较大,运动、呼吸、血液循环和视觉器官发育相对完善,这可能与其早期仔鱼面临的生存环境相适应。初孵仔鱼个体较大,全长(6.45±0.21)mm,大于同亚科的长鳍吻鮈((6.07±0.32)mm)[18]、银鮈(4.20mm)[24]、蛇鮈(4.50mm)[16]、华鳈(5.4mm)[17](表4)。此外,刚出膜的圆口铜鱼仔鱼已具备胸鳍原基,在尾、背部出现宽大的鳍褶,鳃弓和眼色素明显,仔鱼可随水流飘动,这些特征在长鳍吻鮈[18]、银鮈[24]、长薄鳅[19]等产漂流性卵鱼类中均有出现。正是这些功能器官相对较早并较为完善的分化和发育,使得初孵仔鱼在短时间内具备了摄食、游泳和躲避敌害的能力,能迅速适应复杂的野外环境,提高了仔鱼的生存能力,符合产漂流性卵鱼类的繁殖特征。但余志堂等[15]对圆口铜鱼早期发育的研究发现,圆口铜鱼眼色素和胸鳍原基出现在仔鱼出膜后第2天,这与本研究结果有所差异,具体原因还有待进一步研究验证。
参考文献
[1]丁瑞华.四川鱼类志[M].成都:四川科学技术出版社,1994:276-279.
[2]程鹏.长江上游圆口铜鱼的生物学研究[D].武汉:华中农业大学,2008:30-38.
[3]杨志,唐会元,龚云,等.向家坝和溪洛渡蓄水对圆口铜鱼不同年龄个体下行移动的影响[J].四川动物,2017,36(02):161-167.
[4]王伟,周琼,张沙龙,等.金沙江观音岩段圆口铜鱼的微卫星遗传多样性分析[J].淡水渔业,2015,45(06):22-26.
[5]M Xiong,S Yan,K Shao,et al. Development of twenty-nine polymorphic microsatellite loci from largemouth bronze gudgeon(Coreius guichenoti)[J]. Journal of Genetics,2014,93(3):100-103.
[6]杨志,龚云,朱迪,潘磊,等.金沙江中下游圆口铜鱼的繁殖生物学[J].水生生物学报,2018,42(05):1010-1018.
[7]周灿,祝茜,刘焕章.长江上游圆口铜鱼生长方程的分析[J].四川动物,2010,29(04):510-516.
[8]杨志,万力,陶江平,等.长江干流圆口铜鱼的年龄与生长研究[J].水生态学杂志,2011,32(04):46-52.
[9]唐会元,杨志,高少波,等.金沙江中游圆口铜鱼早期资源现状[J].四川动物,2012,31(03):416-421,425.
[10]熊飞,刘红艳,段辛斌,等.长江上游江津和宜宾江段圆口铜鱼资源量估算[J].动物学杂志,2014,49(6):852-859.
[11]曹恒源,乔晔,陈小娟,等.圆口铜鱼维氏气单孢菌的分离鉴定及药敏试验[J].水生态学杂志,2016,37(04):95-100.
[12]Xuemei Li,Qingyun Yan,Einar Ring?,et al. The influence of weight and gender on intestinal bacterial community of wild largemouth bronze gudgeon (Coreius guichenoti, 1874)[J]. BMC Microbiology, 2016, 16(1)191-199.
[13]董純,陈小娟,万成炎,等.圆口铜鱼人工繁殖及胚胎发育研究[J].水生态学杂志,2019,40(03):115-119.
[14]章海鑫,李彩刚,李艳芳,等.不同催产剂对黄尾鯝人工繁殖效果的影响[J].江西水产科技,2017(04):7-9.
[14]鲁雪报,倪勇,胡美洪,等.圆口铜鱼人工繁殖的最适水温探讨[J].科学养鱼,2016(10):6-7.
[15]余志堂,梁秩燊,易伯鲁.铜鱼和圆口铜鱼的早期发育[J].水生生物学报,1984,8(4):371-388.
[16]何学福,宋昭彬,谢恩义.蛇鮈的产卵习性及胚胎发育[J].西南师范大学学报(自然科学版),1996,21(3):276-281.
[17]宋天祥,马骏.华鳈人工繁殖和早期发育的研究[J].湖泊科学,1996,8(3):260-267.
[18]管敏,肖衎,胡美宏,等.长鳍吻鮈(Rhinogobio ventralis)胚胎发育和仔鱼发育[J].渔业科学进展,2015,36(4):57-64.
[19]梁银铨,谢从新,胡小建,等.长薄鳅胚胎发育的观察[J].水生生物学报,1999,26(6):631-635.
[20]杨明生.花斑副沙鳅的胚胎发育观察[J].淡水渔业,2004,34(6):34-36.
[21]Lake JS. Rearing experiments with five species of Australian freshwater fishes. I. Inducement to spawning[J]. Marine & Freshwater Research, 1967,18 (2):137-154.
[22]Martell DJ, Kieffer JD,Trippel EA. Effects of temperature during early life history on embryonic and larval development and growth in haddock[J]. Journal of Fish Biology, 2005, 66(6):1558-1575.
[23]杨志,乔晔,张轶超,等.长江中上游圆口铜鱼的种群死亡特征及其物种保护[J].水生态学杂志,2009,2(2):50-55.
[24]李修峰,黄道明,谢文星,等.汉江中游银鮈的胚胎发育[J].大连海洋大學学报,2005,20(3):181-185. (责编:徐世红)
