苦参碱对角叉菜胶诱导的关节炎大鼠炎症反应及血小板中精氨酸酶和腺苷核苷酸水解酶活性的影响*
2021-04-20孟京红严力军李敏乐晓丹尹伟平
孟京红,严力军,李敏,乐晓丹,尹伟平
1.襄阳市中心医院,湖北 襄阳441003;2.湖北中医药大学附属医院,湖北 武汉430061
类风湿性关节炎(rheumatoid arthritis,RA)是一种影响关节的慢性系统性自身免疫性疾病,其特征是滑膜炎、滑膜组织增生、软骨和骨质破坏,严重者可导致身体残疾[1]。目前,虽已明确RA是主要由T细胞、滑膜成纤维细胞和树突细胞介导的疾病[2-3],但缺乏有效、可靠且毒性低的RA治疗策略。临床常用糖皮质激素(如地塞米松)、抗风湿药物(如甲氨蝶呤)和非甾体类抗炎药物(如布洛芬)缓解RA的炎症反应[4],然而长期使用这些药物会产生不良反应,如胃肠道溃疡、骨髓抑制、心脏病等。苦参碱(matrine)是传统中药苦参中最重要的生物碱之一,具有抗炎、抗癌和抗氧化等药理功能[5-8]。角叉菜胶诱导的关节炎(carrageenan-induced arthritis,CIA)模型是用于研究急性和慢性炎症状态的模拟人RA最为真实的实验模型[9-10]。嘌呤能信号传导是免疫系统处理炎症和免疫反应的机制之一。因此,嘌呤能信号分子可能有益于治疗类风湿性关节炎[11]。本文主要研究苦参碱对角叉菜胶诱导的关节炎大鼠炎症反应及血小板中精氨酸酶和腺苷核苷酸水解酶活性的影响。
1 材料
1.1 动物120只体质量为180~200 g的雌性Wistar大鼠,购自四川夏派森医药科技有限公司,许可证号:SYXK(川)2017-203。大鼠在25℃,12 h光照/12 h黑暗循环的饲养室,自由获取水和食物。
1.2 药物与试剂苦参碱(HPLC≥95%,上海谷研生物有限公司,货号:G0Y011597);地塞米松(上海联硕生物科技有限公司,货号:D1756);角叉菜胶(北京鼎丰基业生物科技发展有限公司,货号:Sigma-C1013);干扰素-γ(interferon-gamma,IFN-γ)抗体(美国Abcam公司,货号:ab224197);白细胞介素-4(interleukin-4,IL-4)抗体(美国Abcam公司,货号:ab246802);IFN-γ、白细胞介素-8(interleukin-8,IL-8)、IL-4、白细胞介素-1β(interleukin-1β,IL-1β)、白细胞介素-10(interleukin-10,IL-10)、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)试剂盒(上海联硕生物刻科技有限公司,货号分别为:ml002833-1、ml037351-1、ml102825-1、ml037361、ml002813-1、ml002859);RIPA裂解缓冲液(南京海克尔生物科技有限公司,货号:SBJ-0999);BCA试剂盒(上海易色医疗科技有限公司,货号:BC201);p65抗体、p-IKBα抗体、IKBα抗体(美国Abcam公司,货号:ab16502、ab133462、ab32518)。
1.3 仪器BX51型显微镜(日本奥林巴斯光学有限公司);FACSCalibur型流式细胞仪(美国BD公司);Synergy HT型全波长酶标仪(美国Thermofisher Scientific公司);mini protean 3 cell型电泳仪(美国BIO-RAD公司);GDS-800 UVP型凝胶成像系统(美国UVP公司)。
2 方法
2.1 模型构建及给药角叉菜胶诱导的关节炎大鼠模型构建[12]:随机分为正常组(20只)和关节炎组(100只),关节炎组在右侧胫骨-股骨关节内注射20μL的1%角叉菜胶(生理盐水配制),每日1次,持续7 d。正常组同一位置注射等量生理盐水。在第7天,确认关节炎模型建立情况。从第8天起,每天分别灌胃20 mg·kg-1、40 mg·kg-1、80 mg·kg-1的苦参碱[11]或0.2 mg·kg-1地塞米松[11],连续21 d。在给药第0天、7天、14天、21天分别用游标卡尺测量各大鼠爪厚度,并进行关节炎指数评分,然后处死大鼠并收集组织和血液用于分析。
2.2 检测指标
2.2.1 关节炎指数按照Zheng等[13]关节炎指数评分标准评定各组大鼠的关节炎指数:0分:未受影响;1分:影响1种关节类型;2分:影响2种关节类型;3分:影响3种关节类型;4分:影响3种以上关节类型。
2.2.2 HE染色观察软骨损伤将软骨组织用石蜡包埋切片,按照HE染色步骤进行染色:切片脱蜡、水洗、苏木精液染色、水洗;用1% 盐酸酒精分化,水洗;0.6%氨水返蓝,水洗;0.5%伊红液染色,水洗;脱水,二甲苯透明;中性树胶封片;在400倍显微镜下观察软骨组织损伤情况。
2.2.3 流式细胞术测定大鼠外周血T细胞的功能表型分离外周血单核细胞,用磁性微珠通过阴性选择进一步纯化CD4+T细胞,然后进行流式细胞术分析。用PMA和离子霉素刺激细胞4 h,并用IFN-γ或IL-4荧光缀合抗体染色。采用FACS Calibur流式细胞仪分析IFN-γ+或IL-4+T细胞的百分比。
2.2.4 ELISA法测定大鼠血清中IFN-γ、TNF-α、IL-1β、IL-4和IL-10的水平将样品加入各反应孔,37℃反应45 min;用洗涤液洗涤4次,再加入生物素标记的抗体,在37℃孵育30 min;洗涤后加链霉亲和素-HRP 混合均匀,在37℃ 反应30 min;加入显色剂避光显色;加终止液终止反应,检测结果。
2.2.5 评估精氨酸酶活性将pH 9.5的4 mmol·L-1Tris-HCl缓 冲 液250 μL、5 mmol·L-1MnCl2200μL、0.2 mol·L-1精氨酸溶液500μL和50μL血小板混合,终体积为1.0 mL。将混合物在37℃下温育20 min,加入2.5 mL Erhlich试剂(2.0 g对二甲氨基苯甲醛溶于20.0 mL浓盐酸中,并用蒸馏水补足至100 mL)阻止反应。20 min后,在450 nm下读取吸光度,计算精氨酸酶活性并表示为mmol·min-1·mg-1蛋白质。
2.2.6 检测脂质过氧化将300μL血小板加入试管中,加入300μL 8.1%十二烷基硫酸钠,500μL乙酸/HCl缓冲液(pH 3.4),500μL 0.6%硫代巴比妥酸,混匀。将混合物在100℃温育1 h,使用分光光度计在532 nm下测量产生的硫代巴比妥酸反应性物质的吸光度,计算脂质过氧化并表示为mol·g-1蛋白质。
2.2.7 NTPD酶和5′-核苷酸酶活性测定将2 mmol·L-1CaCl250μL、480 mmol·L-1NaCl 50μL、25 mmol·L-1KCl 40μL、240 mmol·L-1葡萄糖50μL、和1 mmol·L-1Tris-HCl缓冲液10μL混合,pH 8.0,最终体积为200μL。将悬浮在盐水溶液中的20μL血小板(2~4μg)加入到混合液中,在37℃下孵育10 min,孵育进一步持续70 min,加入终浓度2.0 mmol·L-1底物(ATP或ADP或AMP)开始反应,并用200μL 10%三氯乙酸(TCA)终止。测定释放的无机磷酸盐(Pi),其中孔雀石绿用作比色计试剂,KH2PO4作标准。添加TCA后添加酶制剂来进行对照以校正非酶促核苷酸水解。活性表示为释放的Pi·min-1·mg-1蛋白质。
2.2.8 腺苷脱氨酶活性测定将25μL血小板加入到21 mmol·L-1腺苷中,并在37℃下孵育1 h。分别加入106 mmol·L-1硝普钠和167.8 mmol·L-1次氯酸钠溶液终止反应。使用硫酸铵作为标准。实验一式三份进行,ADA活性表示为U·mg-1蛋白。1UE-ADA 定义为释放每分钟从腺苷中分离1 mmol氨所需的酶量。
2.2.9 蛋白印迹法检测大鼠T细胞软骨组织p65和p-IKBα/IKBα蛋白相对表达在裂解缓冲液中提取总蛋白质,用BCA测定试剂盒测量蛋白质浓度。将10μg蛋白样品用10% SDS-PAGE分离后转移至PVDF膜上。用5%脱脂奶粉封闭膜,用一抗(p65 1∶500、p-IKBα1∶500、IKBα1∶1 000)在4℃封闭过夜,加入对应辣根过氧化物酶偶联的二抗室温孵育1 h,最后进行曝光。以β-actin为内参,用Quantity One软件进行分析目标蛋白质的相对表达水平。
2.3 统计学方法用统计软件SPSS 21.0分析实验数据,数据以均数±标准差(±s)表示。数据进行正态分布和方差齐性分析。其中,爪厚度和关节炎指数用两因素方差分析,其余均采用单因素方差分析。组间两两比较采用LSD-t方法检验,检验标准为α=0.05(双侧)。
3 结果
3.1 苦参碱降低角叉菜胶诱导的关节炎大鼠爪厚度和关节炎指数与正常组相比,模型组大鼠爪厚度和关节炎指数显著增加(P<0.01),说明关节炎模型构建成功;与模型组相比,苦参碱低剂量组大鼠爪厚度和关节炎指数无明显变化,在给药21天时苦参碱中剂量组大鼠爪厚度和关节炎指数均明显减小(P<0.05),苦参碱高剂量组和阳性药物对照组对关节炎大鼠关节具有更显著的保护作用(P<0.01)。见图1。

图1 各组大鼠的爪厚度和关节炎指数比较
3.2 苦参碱降低角叉菜胶诱导的关节炎大鼠软骨损伤正常组大鼠软骨细胞排列整齐,无炎性细胞浸润;模型组大鼠软骨细胞减少,排列紊乱并见大量炎性细胞浸润;与模型组相比,苦参碱各剂量组大鼠的软骨细胞排列紊乱程度和炎性细胞浸润程度均有不同程度的减轻,苦参碱高剂量组和阳性药物组效果最显著。见图2。

图2 HE染色观察软骨损伤程度(×400)
3.3 苦参碱对角叉菜胶诱导的关节炎大鼠的效应/记忆T细胞应答与正常组相比,模型组中IFN-γ+所占百分比增加(P<0.01),IL-4+所占百分比减少(P<0.01),Th1/Th2比值明显增高(P<0.01);与模型组相比,苦参碱低剂量组大鼠IFN-γ+和IL-4+所占百分比及Th1/Th2比值无明显变化,苦参碱中、高剂量组和阳性药物对照组大鼠IFN-γ+所占百分比减少(P<0.05;P<0.01)(图3A),IL-4+所占百分比增加(P<0.05;P<0.01)(图3B),Th1/Th2比值降低(P<0.05;P<0.01)(图3C)。

图3 流式细胞术测定大鼠外周血T细胞的功能表型
3.4 苦参碱抑制角叉菜胶诱导的关节炎大鼠的炎症反应与正常组相比,模型组大鼠血液中IFN-γ、IL-1β、IL-10、TNF-α含量明显增加(P<0.01)、IL-4和IL-8含量明显减少(P<0.01);与模型组相比,苦参碱低剂量组大鼠血液中IFN-γ、IL-1β、IL-10、TNF-α、IL-4和IL-8含量无明显变化;苦参碱中、高剂量组和阳性药物对照组大鼠血液中IFN-γ、IL-1β、IL-10、TNF-α含量明显减少(P<0.05;P<0.01),IL-4和IL-8含量明显增加(P<0.05;P<0.01)。见图4。

图4 ELISA法测定大鼠血清中IFN-γ、IL-4、IL-1β、IL-8、IL-10和TNF-α的水平
3.5 苦参碱抑制角叉菜胶诱导的关节炎大鼠血小板中精氨酸酶活性和脂质过氧化与正常组相比,模型组大鼠血小板中精氨酸酶活性和TBARS生成量均显著升高(P<0.01);与模型组相比,苦参碱低剂量组大鼠血小板中精氨酸酶活性和TBARS生成量均无明显变化,苦参碱中、高剂量组和阳性药物对照组大鼠血小板中精氨酸酶活性和TBARS生成量均显著降低(P<0.05,P<0.01)。见图5A-B。
3.6 苦参碱对角叉菜胶诱导的关节炎大鼠ATP/ADP/AMP水解及腺苷脱氨酶活性的影响与正常组相比,模型组大鼠血小板中ATP/ADP/AMP水解均明显增加(P<0.01),腺苷脱氨酶活性显著降低(P<0.01);与模型组相比,苦参碱低剂量组大鼠血小板中ATP/ADP/AMP水解及腺苷脱氨酶活性均无明显变化,苦参碱中、高剂量组和阳性药物对照组大鼠血小板中ATP/ADP/AMP水解明显减少(P<0.05;P<0.01),腺苷脱氨酶活性显著升高(P<0.05;P<0.01)。见图5C-F。
3.7 苦参碱对角叉菜胶诱导的关节炎大鼠NF-κB通路激活的影响与正常组相比,模型组p65和p-IKBα/IKBα表达均显著上调(P<0.01);与模型组相比,苦参碱低剂量组大鼠p65和p-IKBα/IKBα表达均无明显变化,苦参碱中、高剂量组和阳性药物对照组大鼠p65和p-IKBα/IKBα表达均显著下调(P<0.05;P<0.01)。见图6。
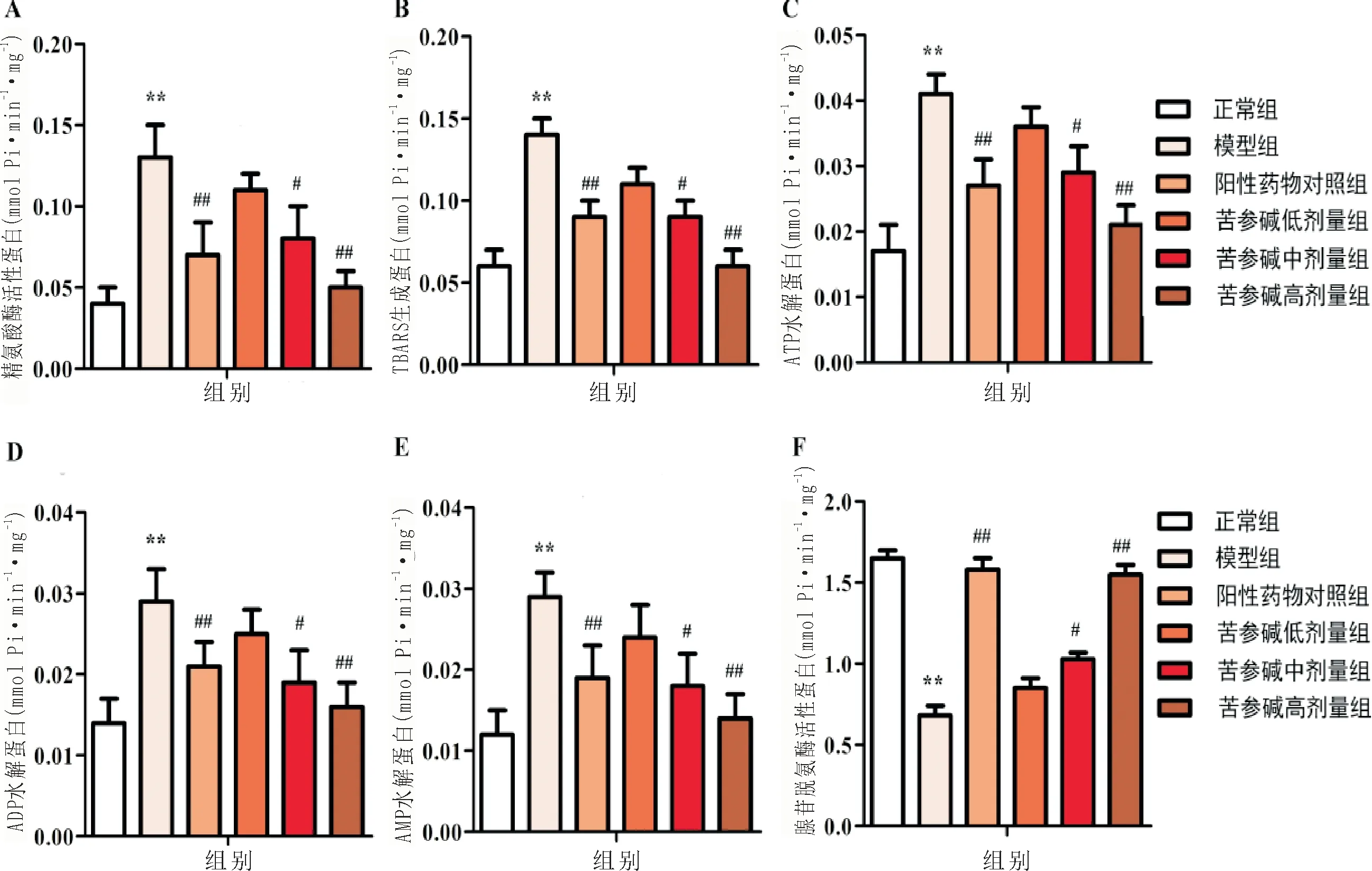
图5 各组大鼠血小板中精氨酸酶活性、脂质过氧化、ATP/ADP/AMP水解及腺苷脱氨酶活性

图6 蛋白印迹法检测大鼠T细胞和软骨组织p65和p-IKBα/IKBα蛋白表达
4 讨论
RA是以关节滑膜变异性炎症反应为主的骨关节系统疾病,现代医学研究发现其为自身免疫系统性疾病,免疫机制复杂。《黄帝内经》将类风湿关节炎归为“痹”病范畴,认为“风寒湿三气杂至,合而为痹也”[14]。本研究中成功建立了CIA大鼠模型并评估苦参碱对关节炎的作用。结果显示,苦参碱可降低CIA大鼠的足厚度和关节炎指数,表明其可能对CIA有潜在的治疗作用。
研究表明,Th1细胞及其标志性细胞因子(IFN-γ、IL-1β、IL-8、TNF-α)参与了关节发炎[15],抑制Th1反应是早期RA患者的有效治疗方法[16]。Th2细胞和其分泌的细胞因子IL-4和IL-10在RA中起保护作用[17]。在RA中经常见到Th1/Th2失衡,Th1/Th2的比例与疾病发生发展呈正相关[18-20]。本研究表明苦参碱显著降低了CIA大鼠中Th1/Th2比值,说明苦参碱通过调节CIA大鼠Th1/Th2免疫失衡抑制炎症反应。
氧化应激及脂质过氧化均参与RA的发病机制。精氨酸酶活性的增加可能导致一氧化氮合酶与NO解偶联,导致氧化应激[21]。本研究发现,关节炎大鼠的血小板精氨酸酶活性增加,与Huang等[22]研究相一致,而苦参碱可显著降低精氨酸酶活性,可能是由于苦参碱改善关节炎状态下的NO向血小板的聚集。脂质过氧化是由发炎组织部位血小板释放的活性氯/活性氮引发的[23],细胞膜脂质降解产生的丙二醛、硫代巴比妥酸活性物质(TBARS)等,作为脂质过氧化的指标[24]。本研究表明,关节炎大鼠产生的TBARS水平增加,苦参碱可显著降低关节炎大鼠中TBARS形成,表明苦参碱具有抑制或延缓关节炎大鼠脂质过氧化的能力。
临床观察发现,活动期RA患者存在血小板计数的增高[25]。血小板是血液中嘌呤信号分子的主要来源,如ATP、ADP和AMP,这些核苷酸和核苷在免疫和炎症细胞调节中充当信使[26]。腺苷脱氨酶(NTPDase)通过将腺苷转化为肌苷来调节腺苷的浓度[27]。炎症期间,ATP分解后可迅速增强炎症性关节炎的血小板机能,NTPDase对ADP的代谢作用可抑制类风湿炎症期间血小板的聚集[28]。本研究发现,苦参碱可抑制关节炎大鼠ATP/ADP/AMP水解,增加腺苷脱氨酶活性,从而抑制关节炎大鼠炎症。
NF-κB信号通路的异常激活通常会促进T细胞、巨噬细胞和其他炎症细胞中促炎细胞因子的产生[29-30]。本研究发现,苦参碱下调关节炎大鼠p65和p-IKBα/IKBα表达,表明苦参碱能够通过抑制NF-κB信号通路激活调节免疫失衡和炎症反应。
综上所述,苦参碱能够减轻关节炎的发展,这可能与苦参碱调节Th1/Th2平衡、降低精氨酸酶和腺苷核苷酸水解酶活性、抑制NF-κB途径的激活有关,该研究可能为RA的治疗提供一种新的治疗药物。
