甲基膦酸二甲庚酯对硝酸介质中Pu(Ⅳ)的萃取
2021-04-20李峰峰刘占元谢书宝唐洪彬蒋德祥陈延鑫吴芳芳
张 烨,李峰峰,刘占元,苏 哲,谢书宝,唐洪彬,何 辉,蒋德祥,陈延鑫,吴芳芳
中国原子能科学研究院 放射化学研究所,北京 102413
其中Pu(Ⅳ)与形成中性分子,再与DMHMP结合成为中性配合物进入有机相。在实验范围内Pu(Ⅳ)分配比与DMHMP浓度的平方、浓度的四次方成正比,萃取过程为放热反应,反应的焓变为-34.46 kJ/mol。
在核燃料后处理、辐照镎提取238Pu等过程中,硝酸溶液中镎和钚的有效分离是一个重要的研究课题。目前从辐照镎的溶解液中分离纯化镎和钚主要采用磷酸三丁酯(TBP)作为萃取剂的溶剂萃取法[1-4]。但是采用TBP萃取法,在低酸条件下TBP对Np(Ⅳ)分配比不高,需在高酸条件进行,而在高酸条件下又会造成TBP较严重的酸解,因此需要寻找更优萃取性能的萃取剂用于镎和钚的分离纯化。

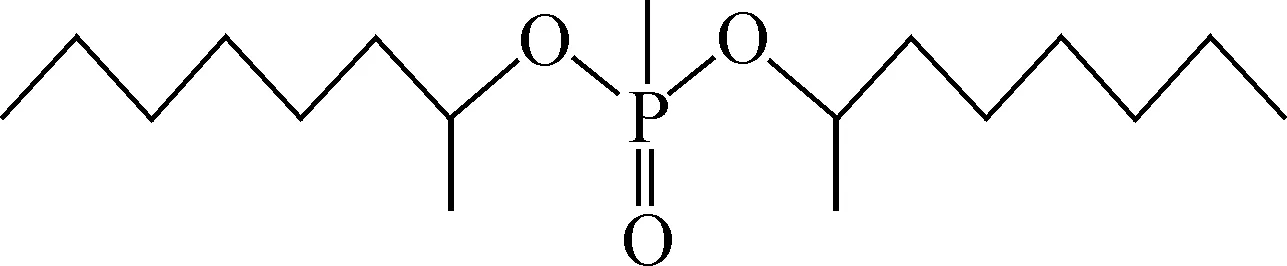
图1 DMHMP化学结构
自从20世纪60年代中国科学院上海有机化学研究所的袁承业等[5]解决DMHMP的合成方法以来,不同研究者利用DMHMP开展了萃淋树脂[6-8]、溶剂萃取[9-11]等方面的研究工作,并将相应的研究成果应用于稀土分离和贵金属提取行业。通过在稀土分离领域多年的研究及使用发现,DMHMP对于三价的稀土金属离子几乎没有萃取能力。中国科学院上海应用物理研究所[12]系统地研究了TBP、DMHMP、磷酸三异戊酯(TiAP)、磷酸三仲丁酯(TsBP)对硝酸、钍、铀及裂片元素的萃取性能,并在以上研究的基础上研发了钍、铀分离流程,研究表明DMHMP的萃取性能明显优于TBP。
但DMHMP用于萃取钚的研究较少,对DMHMP萃取不同价态钚的机理尚不明确,缺乏DMHMP萃取不同价态钚的相关基础数据。因此,本工作拟以DMHMP作为萃取剂,研究硝酸介质中DMHMP对Pu(Ⅳ)的萃取性能。
1 实验部分
1.1 试剂与仪器
含钚料液,中国原子能科学研究院放射化学研究所储存液;甲基膦酸二甲庚酯(DMHMP),自制,产品经过红外光谱(IR)、核磁共振(1H NMR、31P NMR)、质谱(MS)、元素分析及硝酸饱和法滴定分析等表征与分析,测定其纯度为98.0%±2.0%;加氢煤油,锦西煤油化工厂;硝酸、硝酸铝、碳酸钠,均为分析纯,国药集团化学试剂有限公司;不同体积百分数的萃取剂由DMHMP和稀释剂煤油按照相应的体积比混合得到;不同浓度的HNO3由浓度为15.2 mol/L的浓硝酸在容量瓶中稀释到所需浓度。
JA5003N电子天平,精度为0.001 g,德国赛多利斯集团;LPD2500多管漩涡混合仪,来普特科学仪器有限公司;TDL80-2B台式电动离心机,深圳安科高技术股份有限公司;G20s自动电位滴定仪,梅特勒-托利多国际贸易(上海)有限公司;iS50红外光谱仪(FTIR),Nicolet公司;Tricarb2910tr液闪仪,珀金埃尔默公司。
1.2 实验方法
实验前将配制好的已知浓度的有机相按1∶1的相比分别用w=5% Na2CO3、0.1 mol/L HNO3洗涤3次,再用去离子水洗涤至中性备用。对含钚料液进行调酸和调价:用噻吩甲酰三氟丙酮(TTA)-二甲苯溶液萃取含钚料液,再用8.0 mol/L HNO3反萃制备Pu(Ⅳ)溶液。稀释Pu(Ⅳ)溶液酸度为1.0 mol/L,质量浓度为0.1 g/L。除温度影响因素的实验外,其他实验温度均为(20.0±0.5)℃,萃取相比1∶1,在振荡器上振荡5 min,离心分相,分别取一定量水相和有机相,用Tricarb2910tr型液闪仪测量Pu(Ⅳ)计数。平行测定2次取平均值。计算Pu的分配比和萃取率,如式(1)、(2)所示:
(1)
(2)
式中:c1、c2分别为萃取平衡时有机相、水相中Pu(Ⅳ)的浓度,mol/L;V1、V2分别为有机相、水相的体积,L;D为Pu(Ⅳ)的分配比;E为Pu(Ⅳ)的萃取率。
2 结果与讨论
2.1 萃取平衡时间的确定
以0.286 mol/L DMHMP/煤油作为有机相,在3.0 mol/L HNO3介质中,相接触时间分别为20 s、40 s、1 min、90 s、2 min、3 min、5 min的条件下,研究DMHMP对Pu(Ⅳ)的萃取率与相接触时间的关系,结果示于图2。由图2可知:萃取率随着相接触时间的增加而增加,当相接触时间为2 min时,达到了萃取平衡。后面的实验中相接触时间均选用5 min,以保证萃取达到平衡。
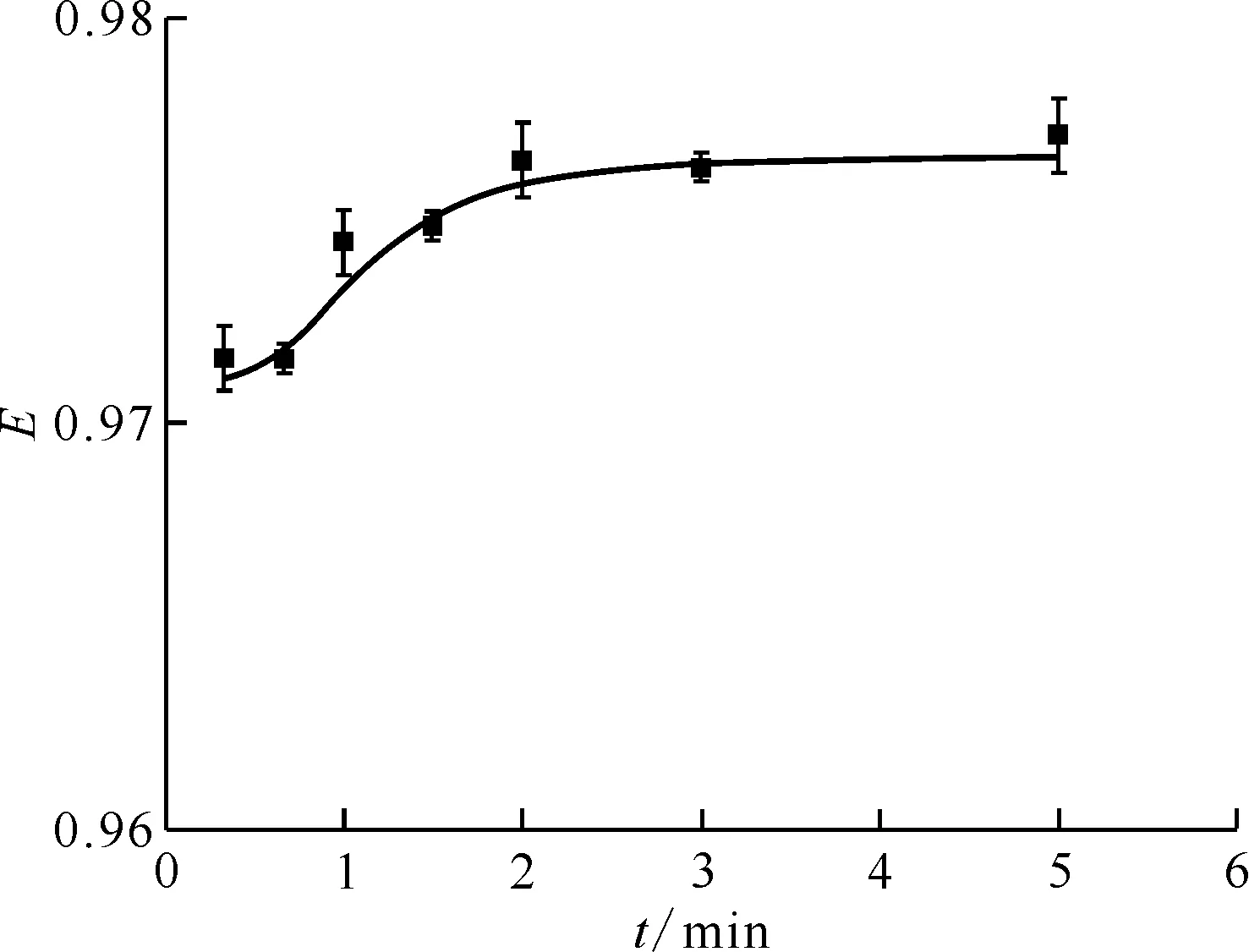
ρ0(Pu4+)=0.1 g/L,c0(DMHMP)=2.86×10-1 mol/L,c0(HNO3)=3.0 mol/L,相比1∶1,(20.0±0.5)℃
2.2 不同浓度DMHMP萃取Pu(Ⅳ)的分配比
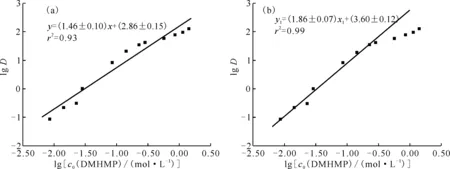
固定水相初始酸度为3.0 mol/L,测定了不同浓度DMHMP萃取Pu(Ⅳ)(初始质量浓度约为0.1 g/L)的分配比。为了保证结果的可靠性,用Pu4+初始质量浓度约为1.0×10-3g/L的硝酸溶液取3个实验点重复了实验。结果示于图3。由图3可知:在一定Pu4+浓度范围内,Pu4+的浓度变化对萃取分配比没有影响;DMHMP初始浓度介于8.57×10-3~1.43 mol/L范围内时,随着DMHMP初始浓度的增加,DMHMP萃取Pu(Ⅳ)的分配比呈现逐渐增加的趋势。
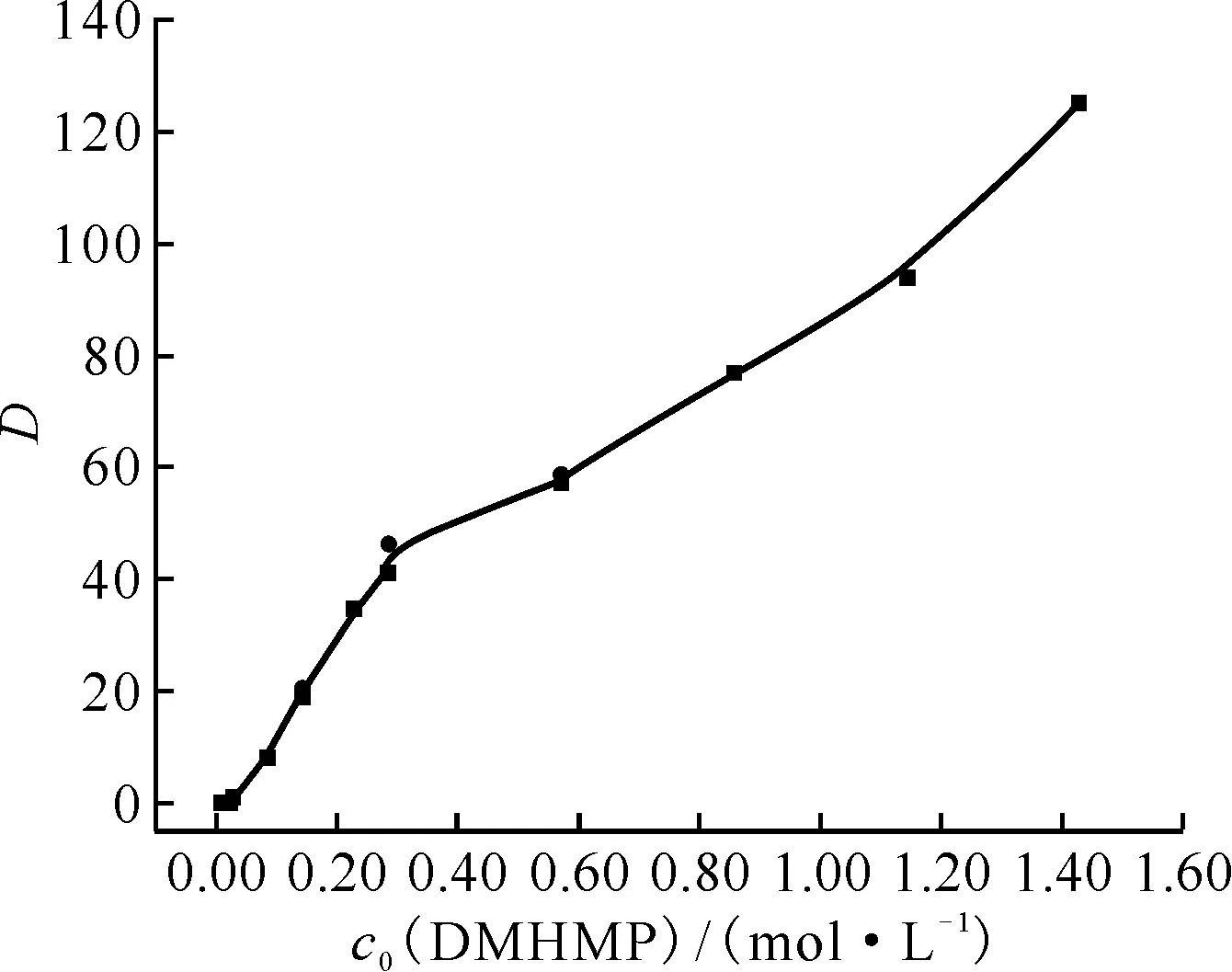
ρ0(Pu4+):■——0.1 g/L,●——1.0×10-3 g/Lc0(HNO3)=3.0 mol/L,相接触时间5 min,相比1∶1,(20.0±0.5)℃
假设DMHMP萃取Pu(Ⅳ)的萃合物组分为:Pu(NO3)s(DMHMP)n,DMHMP是中性磷类萃取剂,DMHMP萃取Pu(Ⅳ)的萃取反应可以写成:
Pu(NO3)s(DMHMP)n(o)
(3)
萃取平衡常数K为:
K=
(4)
Pu(Ⅳ)的萃取分配比D为:
(5)
结合式(4)和式(5),可以得到式(6):
(6)
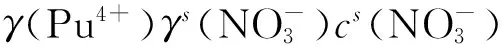
lgD=nlgc0(DMHMP)+lg(Kδ)
(7)
以lgD对lgc0(DMHMP)作图,结果示于图4(a),拟合得到直线r2值为0.93,不能很好符合直线关系。由此推测在不同萃取浓度下,萃取体系萃取剂活度发生了变化。通常情况下,有机相中萃取剂浓度越低,萃取剂活度系数γ(DMHMP)越接近于1。

ρ0(Pu4+)=0.1 g/L,c0(HNO3)=3.0 mol/L,相接触时间5 min,相比1∶1,(20.0±0.5)℃
2.3 不同硝酸根浓度下DMHMP萃取Pu(Ⅳ)的分配比
固定水相酸度为3.0 mol/L,测定了不同硝酸根浓度下2.86×10-1mol/L DMHMP萃取Pu(Ⅳ)的分配比,结果示于图5。由图5可知:分配比随着硝酸根浓度的增大而变大。
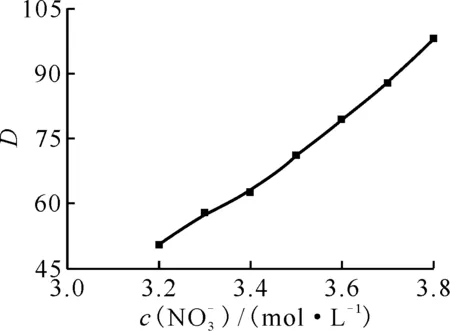
ρ0(Pu4+)=0.1 g/L,c0(DMHMP)=2.86×10-1 mol/L,c0(HNO3)=3.0 mol/L,相接触时间5 min,相比1∶1,(20.0±0.5)℃
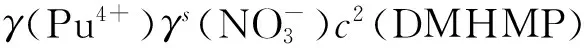
(8)
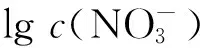
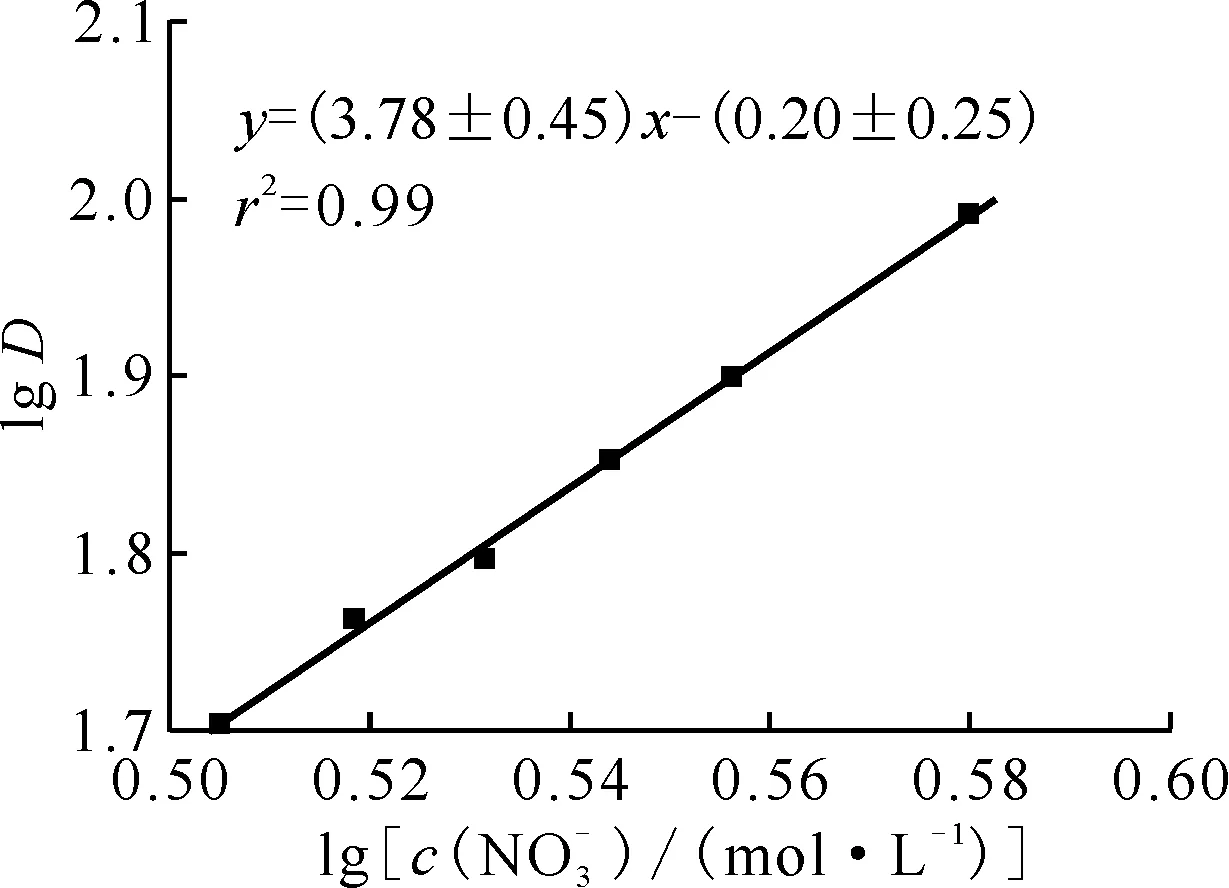
ρ0(Pu4+)=0.1 g/L,c0(DMHMP)=2.86×10-1 mol/L,c0(HNO3)=3.0 mol/L,相接触时间5 min,相比1∶1,(20.0±0.5)℃
Pu(NO3)4·2DMHMP(o)
(9)
2.4 不同水相硝酸浓度下DMHMP萃取Pu(Ⅳ)的分配比
在硝酸浓度变化的过程中,DMHMP萃取Pu(Ⅳ)的硝酸溶液时主要存在两种作用,一种是随着硝酸根离子浓度的增加,根据平衡移动原理,增大硝酸浓度有利于萃取反应向右进行。另一种作用就是硝酸的排挤作用,萃取剂与硝酸分子的结合,使得自由萃取剂浓度减小,从而使分配比降低。因此为了研究这两种作用之间的关系,测定了不同平衡水相HNO3浓度下2.86×10-1mol/L DMHMP萃取Pu(Ⅳ)的分配比,结果示于图7曲线Ⅰ。由图7曲线Ⅰ可知:DMHMP从硝酸溶液中萃取Pu(Ⅳ)时,在酸度较低时Pu(Ⅳ)的分配比随水相硝酸浓度的增大而增大,继续增大硝酸浓度,当c0(HNO3)=5.0 mol/L时,Pu(Ⅳ)的分配比达到最大值68.16,然后随着硝酸浓度的继续增大Pu(Ⅳ)的分配比下降。根据文献[15]得到TBP从不同浓度的硝酸溶液中萃取Pu(Ⅳ)的分配比,结果示于图7曲线Ⅱ。如图7所示,DMHMP萃取Pu(Ⅳ)的分配比远大于TBP萃取Pu(Ⅳ)的分配比,说明DMHMP对Pu(Ⅳ)比TBP具有更强的萃取性能。
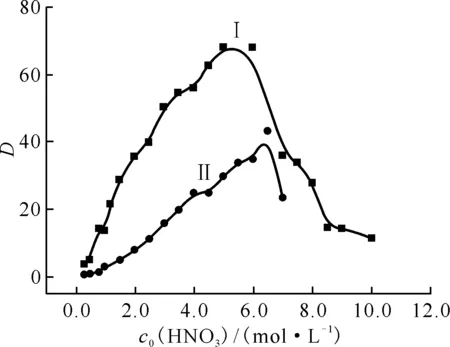
ρ0(Pu4+)=0.1 g/L,c0(DMHMP)=2.86×10-1 mol/L,相接触时间5 min,相比1∶1,(20.0±0.5)℃
为了对萃取分配比随硝酸浓度变化的原因做出解释,需要分析溶液中存在的萃取平衡反应。
1)硝酸溶液中,DMHMP萃取硝酸溶液中的Pu(Ⅳ)的反应如下:
Pu(NO3)4·2DMHMP(o)
(10)
对于式(10)的萃取平衡反应,其分配比可以表示为式(11):
(11)
式中,DMHMPf表示有机相中萃取Pu(Ⅳ)的自由萃取剂(未被硝酸结合的萃取剂称为自由萃取剂)。在硝酸溶液中,萃取进入有机相的硝酸会影响有机相中自由萃取剂浓度。
2)DMHMP萃取硝酸的反应[10]如下:
(12)
HNO3·2DMHMP(o)
(13)
对于式(12)、(13)萃取平衡反应,其萃取平衡常数可以分别表示为:
(14)
(15)
HNO3分配比可以表示为:
D(HNO3)=
(16)
3)硝酸解离的反应如下:
(17)
其中不同浓度硝酸的电离数据采用文献[16]中的数据,结合式(17)可得:
(18)
结合式(14)、(15)和(16)可得硝酸的分配比与自由萃取剂浓度之间的关系如式(19):
D(HNO3)=K1c(DMHMPf)+K1K2c2(DMHMPf)
(19)
则自由萃取剂的浓度为:
c(DMHMPf)=c(DMHMPT)-K1c(DMHMPf)·
c(HNO3)-2K1K2c2(DMHMPf)c(HNO3)
(20)
式中,c(DMHMPT)表示有机相中初始萃取剂浓度。其合理解可通过式(21)求出:
c(DMHMPf)=((K1c(HNO3)+1)±
(-4K1K2c(HNO3))
(21)
根据文献[7]可以得到在硝酸浓度为2.0~10.0 mol/L范围内时K1和K2的值,将其代入式(21)计算得到式(22):
c(DMHMPf)=(-10c(HNO3)-1+
(5.2c(HNO3))
(22)

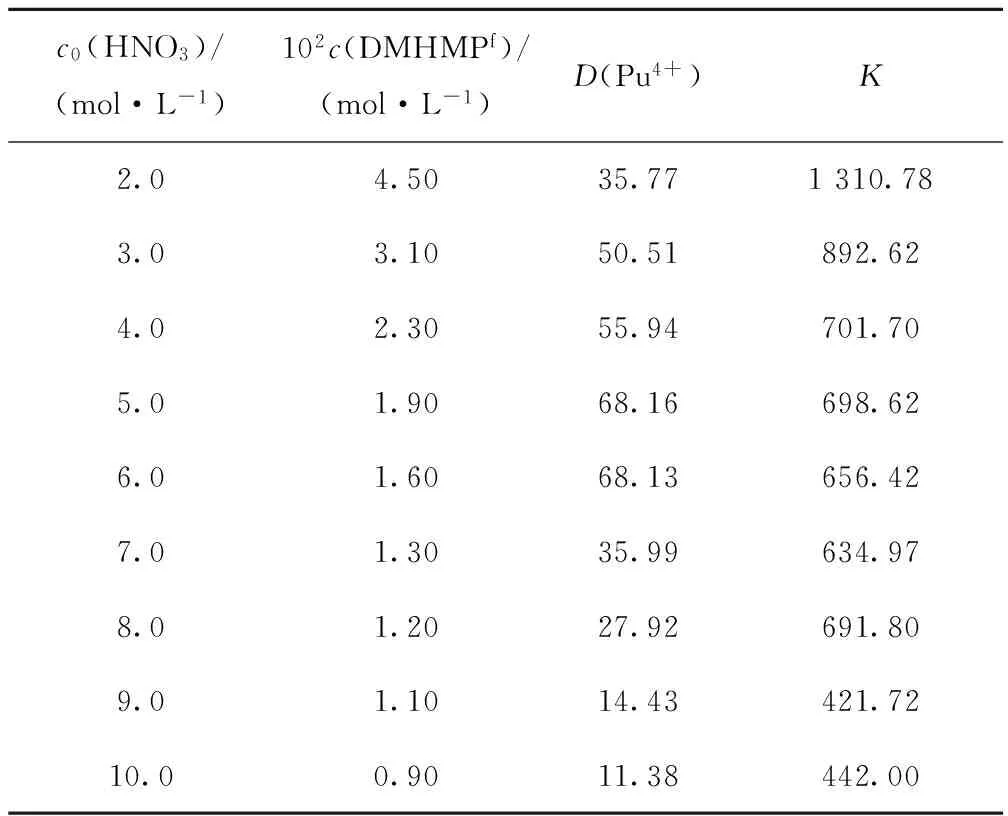
表1 萃取平衡反应的平衡常数
由表1可知,硝酸初始浓度在2.0~10.0 mol/L时,根据实验测的DMHMP萃取Pu(Ⅳ)的分配比数据,计算得到的K值在421.72~1 310.78范围内,在不同K值间采用累差法,当取K值为680时,代入公式(11)得到Pu(Ⅳ)分配比计算值的拟合曲线与实验值拟合曲线吻合最好(图8),因此理论得到DMHMP萃取Pu(Ⅳ)的平衡常数K=680。
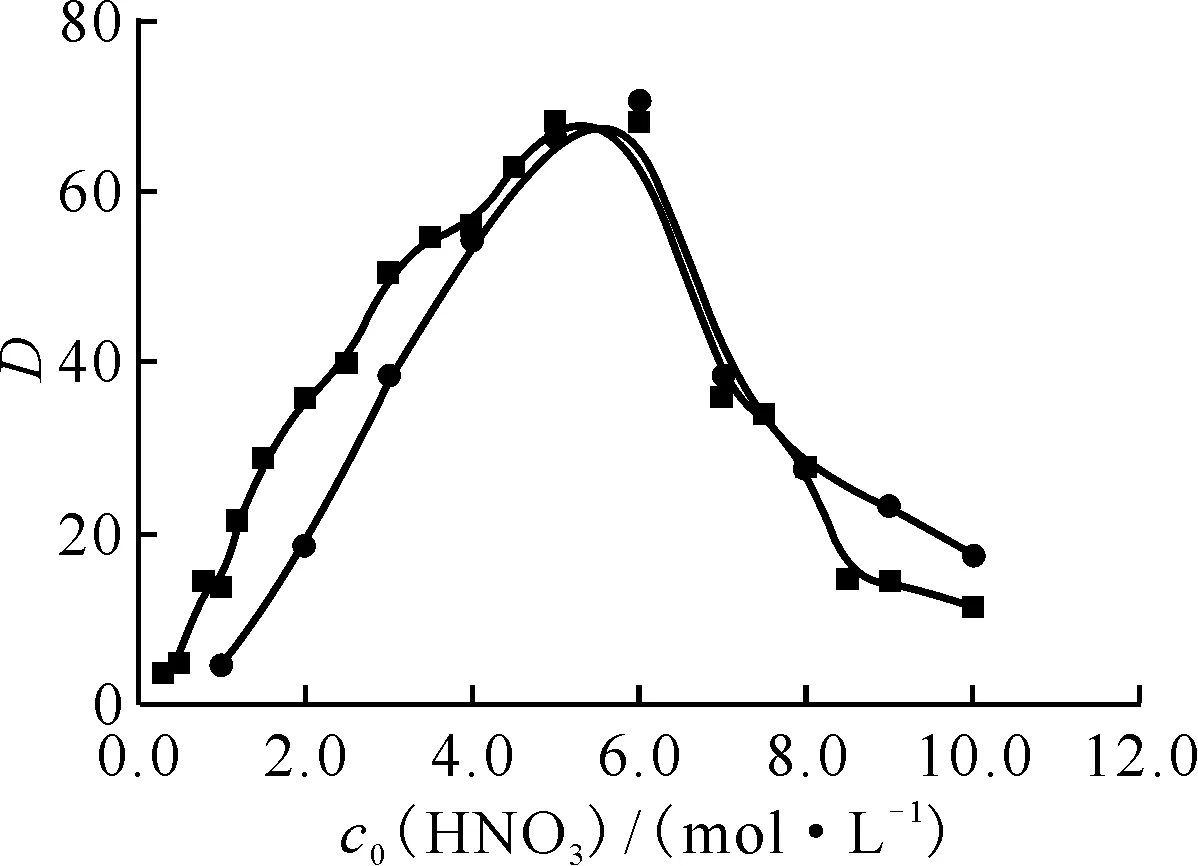
●——计算值,■——实验值
2.5 不同温度条件下DMHMP萃取Pu(Ⅳ)的分配比
在萃取剂浓度(2.86×10-1mol/L DMHMP)与水相硝酸浓度(1.0 mol/L)一定的情况下,在17~35 ℃范围内,研究了温度的变化对萃取分配比的影响,结果示于图9。由图9可知,Pu(Ⅳ)的分配比随温度的升高而减小。
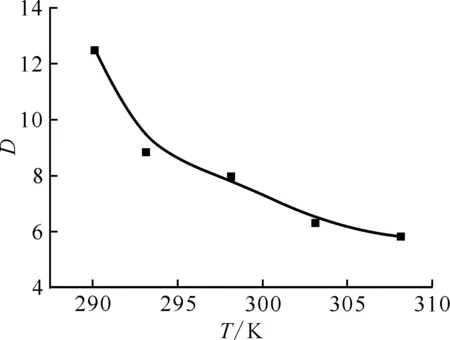
ρ0(Pu4+)=0.1 g/L,c0(DMHMP)=2.86×10-1 mol/L,c0(HNO3)=1.0 mol/L,相接触时间5 min,相比1∶1
在温度变化中有机相中Pu(Ⅳ)的浓度变化很小,可以认为其络合的萃取剂浓度不发生变化,进一步可以认为自由萃取剂浓度不发生变化,同时在处理中,认为在研究范围内温度对活度系数影响很小,基本不变,加上水相硝酸根浓度变化也很微小,认为δ在温度变化过程中保持恒定。该反应钚的转化率大于90%,可认为焓变值近似不变。因此能得到式(23):
(23)
(24)
式中:R为摩尔气体常数,为8.314 J/(mol·K);n为直线的斜率值。
由图10可知:取对数坐标时以lg(1 000/T)为横坐标,lgD为纵坐标作图,得到的图形为一条直线,直线的斜率为1.80,根据直线的斜率值计算得到DMHMP萃取Pu(Ⅳ)的萃取反应的标准焓变为-34.46 kJ/mol,计算出的焓变为负,说明该反应为放热反应,降低温度有利于DMHMP对Pu(Ⅳ)的萃取。且进一步计算可得出萃取反应的标准吉布斯自由能和标准熵变。
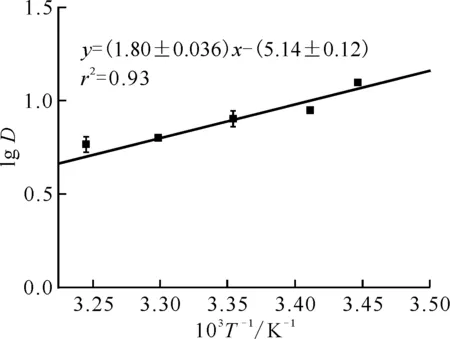
ρ0(Pu4+)=0.1 g/L,c0(DMHMP)=2.86×10-1 mol/L,c0(HNO3)=1.0 mol/L,相接触时间5 min,相比1∶1
标准吉布斯自由能:
标准熵变:
3 结 论
(1)中性磷类萃取剂甲基膦酸二甲庚酯(DMHMP)在硝酸溶液中以中性络合萃取方式萃取Pu(Ⅳ),萃取反应方程式为:
Pu(NO3)4·2DMHMP(o)
(2)DMHMP萃取Pu(Ⅳ)的反应为放热反应,标准焓变为-34.46 kJ/mol,降低温度有利于DMHMP对Pu(Ⅳ)的萃取。
(3)与TBP相比,DMHMP对Pu(Ⅳ)具有更好的萃取性能。
