红景天苷调控FoxO1/β-catenin 通路对2 型糖尿病骨质疏松大鼠的保护作用研究
2021-04-19王泽凤高强朱煜赵建林霍光强
王泽凤高 强朱 煜赵建林霍光强
(1.新乡市中心医院药学部,河南 新乡 453000; 2.新乡医学院第一附属医院药学部,河南新乡 453100;3.新乡市中心医院内分泌科,河南新乡 453000; 4.新乡市市直机关医院内科,河南新乡 453000)
2 型糖尿病性骨质疏松(diabetic osteoporosis,DOP)属全身性骨骼疾病,是糖尿病严重时的骨骼并发症,会导致骨重减少、骨组织微结构改变、骨骼脆性增加[1];发病率、致残率呈逐年上升趋势,大大降低患者生活质量,造成沉重的经济负担。目前DOP 的治疗以控制血糖、抗骨质疏松为主,寻找更为安全有效的DOP 药物仍是目前治疗重点[2]。红景天苷(Salidroside,SDS)具有抗炎、抗疲劳、抗氧化、抗细胞凋亡、抗骨质疏松和降血糖等功效,但药理作用机制尚不明确[3]。叉头框转录因子O 亚族1(Forkhead box transcription factor O1,FoxO1)/β-连环蛋白(β-catenin)通路在维持成骨细胞凋亡和氧化应激中发挥作用,抑制FoxO1/β-catenin 通路可影响氧化应激从而促进凋亡基因介导的细胞凋亡、DNA 修复基因生长停滞、促进 DNA 损伤蛋白表达[4]。推测 SDS 可能通过 FoxO1/β-catenin 通路实现对DOP 的保护。因此,本文构建DOP 大鼠模型,探究SDS 对DOP 大鼠的影响。
1 材料和方法
1.1 实验动物
41 只12 周龄SPF 级健康雌性SD 大鼠,购自北京维通利华实验动物科技有限公司[SCXK(京)2019-0004],动物饲养于新乡医学院实验动物中心[SYXK(豫)2019-0016],体重(200±10)g。所有大鼠在温度(24±1)℃、光照/黑暗(12/12)h、正常饮水饮食IVC 系统下暂养。符合动物伦理学3R 原则。
1.2 主要试剂与仪器
高糖高脂各组分比例:胆酸钠 0.1%、猪油10%、基础饲料61.9%、蔗糖20%、蛋黄粉8%;链脲佐菌素(Streptozocin,STZ)(美国Sigma 公司,批号:S0131);SDS(原料药,大连美仑生物技术有限公司,纯度≥98%,批号:K06437);白藜芦醇(Resveratrol,Res)(格鲁斯生物科技公司,批号:501-36-0);苏木精-伊红(Hematoxylin-eosin,HE)染色试剂盒、EDTA 脱钙液(上海生工生物技术公司,批号:E607318、 E671001); 活 性 氧 ( Reactive oxygen species,ROS)试剂盒、超氧化物歧化酶(Superoxidedismutase,SOD)试剂盒、丙二醛(Malondialdehyde,MDA)试剂盒、谷胱甘肽过氧化物酶(Glutathione peroxidase,GSH-Px)试剂盒(南京建成生物工程研究所,批号分别为:E004-1-1、A020-2-2、A003-1-2、A005-1-2);一抗兔抗 FoxO1、β-catenin、β-actin,二抗羊抗兔IgG(英国Abcam 公司,批号:ab39670、ab32572、ab8227、ab6721)。
血糖仪(上海罗氏制药有限公司,型号:ACCUCHEK);双能X 射线密度仪(上海硕舟电子科技有限公司,型号:CB3351MD);光学显微镜(德国徕卡公司,型号:DM500);蛋白凝胶成像系统(赛默飞世尔科技(中国)有限公司,型号:iBright CL750)。
1.3 实验方法
1.3.1 动物分组及给药处理
33 只大鼠建立DOP 模型,高糖高脂饲养8 周,8 周后禁食12 h 腹腔注射30 mg/kg STZ,第10 周无菌条件下去除卵巢,摘除卵巢72 h 检测空腹血糖含量,≥16.70 mmol/L 即为 DOP 模型建立成功[5]。33 只大鼠模型成功24 只,成功率72.73%。24 只大鼠随机分为模型组、SDS 组、FoxO1 激动剂组,每组8只;正常组8 只大鼠常规饲料饲养相同时间。造模成功后第 2 天 SDS 组灌胃 36 mg/(kg·d) SDS[6],FoxO1 激动剂灌胃40 mg/(kg·d) Res[7],灌胃体积均为10 mL/kg,正常组和模型组灌胃等体积的生理盐水,连续11 周。
1.3.2 样本采集
血液采集:造模结束和给药结束均禁食大鼠12 h,一次性注射器腹腔采血,部分置于抗凝管中检测血糖水平;部分室温4000 r/min 离心15 min,分离血清,置于-20℃冰箱保存待用。
双侧股骨采集:给药结束后剥离股骨双侧肌肉和结缔组织,取下双侧股骨,左侧置于4%多聚甲醛中固定,右侧置于-80℃冰箱。
1.3.3 血糖仪检测空腹血糖水平
血糖仪检测腹腔血中空腹血糖水平。
1.3.4 HE 检测大鼠股骨组织形态
股骨组织于4%多聚甲醛中固定24 h 后,放入20 倍体积EDTA 脱钙液中脱钙处理,脱钙组织用大头针轻刺,大头针可轻易穿过骨组织,则脱钙良好。按照HE 染色试剂盒经苏木精染色、伊红复染,显微镜下观察股骨组织形态。
1.3.5 双能X 射线吸收法测定股骨组织骨密度情况
取出股骨组织,室温放置直至解冻,双能X 射线密度仪检测各组股骨密度。
1.3.6 试剂盒检测血清中ROS、SOD、MDA、GSHPx 水平
分别按照 ROS、SOD、MDA、GSH-Px 试剂盒说明书检测血清中 ROS、SOD、MDA、GSH-Px 水平。
1.3.7 蛋白免疫印迹检测股骨组织中FoxO1、βcatenin 蛋白水平
股骨组织立即浸入液氮中,迅速研磨至细粉。按5 g/L 组织加入RIPA 强效裂解液(含蛋白酶抑制剂和磷酸化酶抑制剂),冰上匀浆30 min,4℃离心机15000 r/min 离心20 min,吸取上清即为股骨组织总蛋白。相同蛋白量上样、凝胶电泳分离,转至PVDF 膜上,5% 脱脂奶粉封闭;分别加入一抗FoxO1、β-catenin、β-actin(稀释比均为 1 ∶2000)后4℃孵育过夜;加入对应二抗(1 ∶5000)室温孵育1 h。凝胶成像系统对条带进行灰度分析。
1.4 统计学方法
SPSS 25.0 软件对所有数据进行统计学分析,计量数据均采用平均数±标准差(±s)表示,多组间比较行单因素方差分析,进一步两两比较行SNK-q检验。P<0.05,差异有统计学意义。
2 结果
2.1 SDS 对大鼠空腹血糖的影响
建模后给药前,与正常组相比,模型组、SDS 组、FoxO1 激动剂组空腹血糖水平升高(P<0.05)。给药后,与正常组相比,模型组空腹血糖水平升高(P<0.05);与模型组相比,SDS 组、FoxO1 激动剂组空腹血糖水平降低(P<0.05)。见表1。
表1 4 组大鼠空腹血糖水平比较( ±s,mmol/L)Table 1 Comparison of fasting blood glucose levels in 4 groups of rats

表1 4 组大鼠空腹血糖水平比较( ±s,mmol/L)Table 1 Comparison of fasting blood glucose levels in 4 groups of rats
注:与正常组相比,#P<0.05;与模型组相比,∗P<0.05。Note.Compared with the normal group, #P<0.05.Compared with the model group, ∗P<0.05.
组别Groups建模后给药前After modeling and before administration给药后After administration正常组Normal group 6.98±0.86 6.96±0.81模型组Model group 19.25±3.21# 20.18±4.15#SDS 组SDS group 19.35±3.18# 14.48±2.18∗FoxO1 激动剂组FoxO1 agonist group 19.27±3.14# 15.44±3.11∗F 39.088 29.645 P<0.001 <0.001
2.2 SDS 对大鼠股骨组织形态学影响
正常组骨小梁数目和形态正常;模型组骨小梁出现明显断裂,破坏严重、数量减少;SDS 组骨小梁明显断裂,但空隙间隔有所缓解,数量有所增加;FoxO1 激动剂组骨小梁明显断裂,间隙稍有所增加,但不明显。见图1。
2.3 SDS 对大鼠股骨组织骨密度影响
与正常组相比,模型组股骨组织骨密度降低(P<0.05);与模型组相比,SDS 组、FoxO1 激动剂组股骨组织骨密度升高(P<0.05)。见表2。
2.4 SDS 对大鼠血清中 ROS、SOD、MDA、GSHPx 水平的影响
与正常组相比,模型组血清中ROS、MDA 水平升高(P<0.05),SOD、GSH-Px 水平降低(P<0.05);与模型组相比,SDS 组、FoxO1 激动剂组血清中ROS、MDA 水平降低(P<0.05),SOD、GSH-Px 水平升高(P<0.05)。见表3。
2.5 SDS 对大鼠股骨组织中 FoxO1、β-catenin 蛋白水平的影响
与正常组相比,模型组股骨组织中 FoxO1、βcatenin 蛋白水平降低(P<0.05);与模型组相比,SDS 组、FoxO1 激动剂组股骨组织中 FoxO1、βcatenin 蛋白水平升高(P<0.05)。见图2、表4。
表2 4 组大鼠股骨组织骨密度比较( ±s)Table 2 Comparison of bone mineral density of femoral tissue in 4 groups of rats
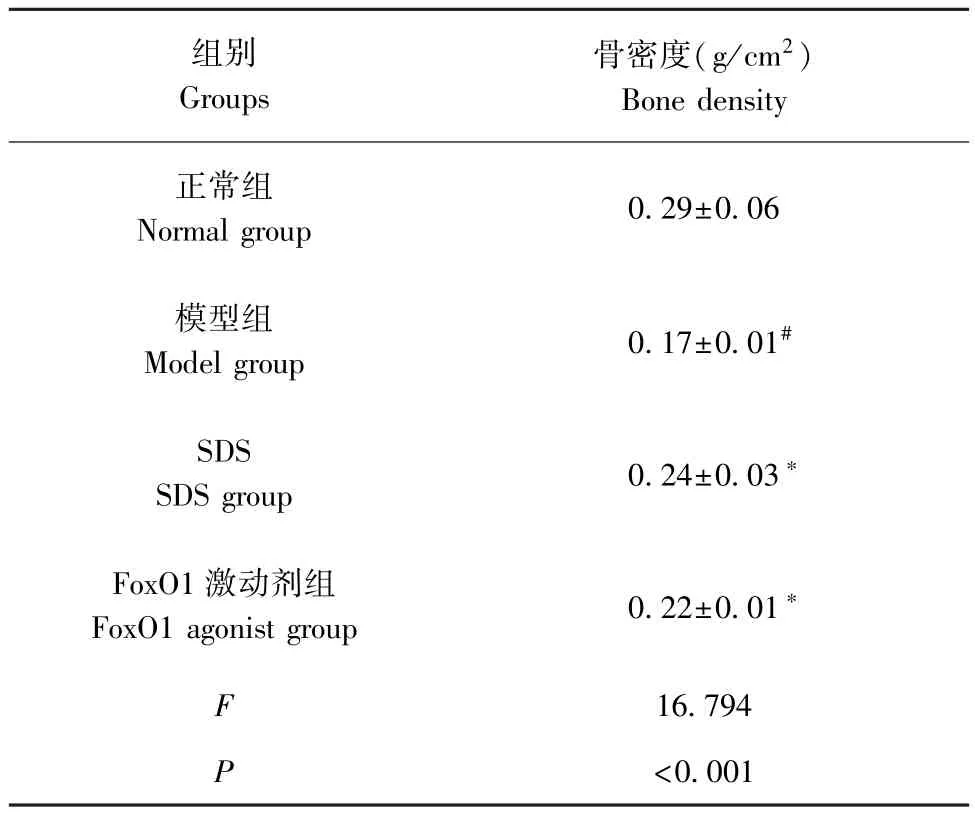
表2 4 组大鼠股骨组织骨密度比较( ±s)Table 2 Comparison of bone mineral density of femoral tissue in 4 groups of rats
注:与正常组相比,#P<0.05;与模型组相比,∗P<0.05。Note.Compared with the normal group, #P<0.05.Compared with the model group, ∗P<0.05.
组别Groups骨密度(g/cm2)Bone density正常组Normal group 0.29±0.06模型组Model group 0.17±0.01#SDS SDS group 0.24±0.03∗FoxO1 激动剂组FoxO1 agonist group 0.22±0.01∗F 16.794 P<0.001

表3 4 组大鼠血清中 ROS、SOD、MDA、GSH-Px 水平比较( _x ± s)Table 3 Comparison of ROS, SOD, MDA, GSH-Px levels in serum of 4 groups of rats

注:A:正常组;B:模型组;C:SDS 组;D:FoxO1 激动剂组。图2 4 组大鼠股骨组织中FoxO1、β-catenin 蛋白表达情况Note.A, normal group.B, model group.C, SDS group.D,FoxO1 agonist group.Figure 2 FoxO1 and β-catenin protein expression in femoral tissues of 4 groups of rats
表4 4 组大鼠股骨组织中FoxO1、β-catenin蛋白水平比较( ±s)Table 4 Comparison of FoxO1 and β-catenin protein levels in femoral tissues of 4 groups of rats
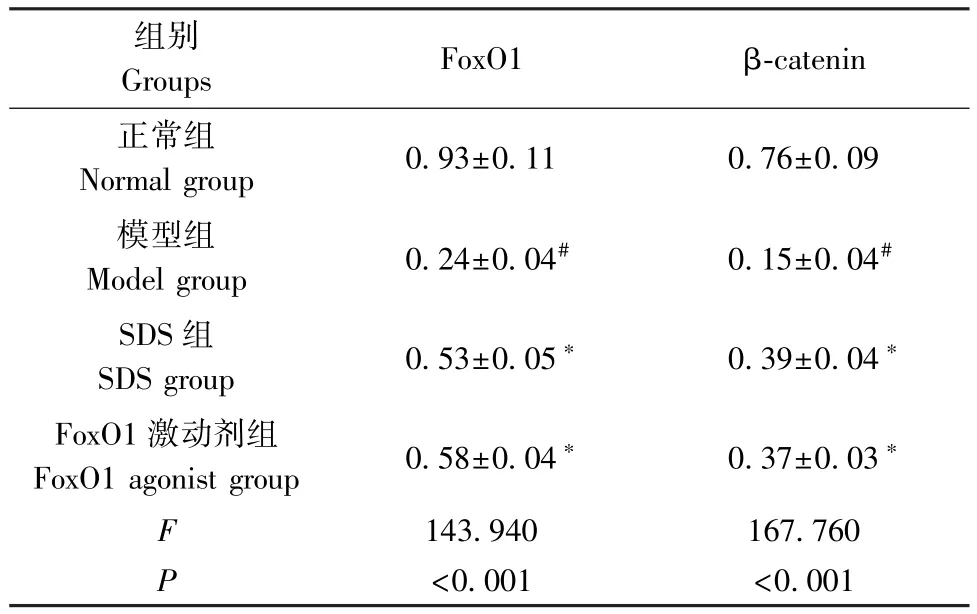
表4 4 组大鼠股骨组织中FoxO1、β-catenin蛋白水平比较( ±s)Table 4 Comparison of FoxO1 and β-catenin protein levels in femoral tissues of 4 groups of rats
注:与正常组相比,#P<0.05;与模型组相比,∗P<0.05。Note.Compared with the normal group, #P<0.05.Compared with the model group, ∗P<0.05.
组别Groups FoxO1 β-catenin正常组Normal group 0.93±0.11 0.76±0.09模型组Model group 0.24±0.04# 0.15±0.04#SDS 组SDS group 0.53±0.05∗ 0.39±0.04∗FoxO1 激动剂组FoxO1 agonist group 0.58±0.04∗ 0.37±0.03∗F 143.940 167.760 P<0.001 <0.001
3 讨论
糖尿病和骨质疏松都为常见代谢类疾病,糖尿病随着发病时间的延长,血糖长时间异常、胰岛素缺乏或不足、降糖药物使用等影响骨重量和骨质量,导致骨质疏松[8]。研究表明糖尿病患者并发骨质疏松达50%以上,造成致残率升高[9]。因此治疗DOP 对于糖尿性患者意义重大。SDS 是从红景天中提取的活性成分,属植物中广泛存在的酚苷类化合物,具有调节免疫系统、抗氧化、抗衰老作用[10];在应激性高血糖中具有抗氧化应激和保护应激高糖心肌细胞作用[11]。本研究发现,建模后给药前,与正常组相比,模型组、SDS 组、FoxO1 激动剂组空腹血糖水平升高,说明DOP 模型建立成功。给药后,与正常组相比,模型组空腹血糖水平升高,股骨组织骨密度降低,骨小梁出现明显断裂,破坏严重、数量减少,提示长时间处于高血糖状态可降低骨密度,表现为骨小梁结构破坏、数量减少,骨骼脆性增加。与模型组相比,SDS 组、FoxO1 激动剂组空腹血糖水平降低,股骨组织骨密度升高,骨小梁结构有所缓解,提示SDS 与FoxO1 激动剂功能类似,均可缓解DOP 空腹血糖水平升高现象,从而增加骨密度,实现对DOP 的保护。
正常情况下机体ROS 的产生与消除处于动态平衡中,但当长时间处于高血糖水平时该平衡被打破,机体内产生过多的ROS,抗氧化能力下降,破骨细胞在细胞水平上产生一系列损伤导致大部分细胞的增殖、分化受阻,促进凋亡[12]。SOD 是机体抗氧化功能核心,可清除机体内氧自由基,减少组织损伤;GSH-Px 可催化过氧化氢酶的分解,降低过氧化氢氧化损伤;MDA 反映机体氧化损伤情况[13-15]。本研究发现,与正常组相比,模型组血清中ROS、MDA 水平升高,SOD、GSH-Px 水平降低,提示 DOP中抗氧化与氧化平衡被打破,机体氧化能力增强、抗氧化能力减弱,导致机体处于氧化应激状态。与模型组相比,SDS 组、FoxO1 激动剂组血清中ROS、MDA 水平降低,SOD、GSH-Px 水平升高,提示 SDS与FoxO1 激动剂功能类似,均可改善 ROS、MDA、SOD、GSH-Px 水平,纠正抗氧化与氧化不平衡状态,从而减少对机体的损伤。
FoxO1 作为叉头框转录因子之一,几乎在所有组织中表达,调控生长发育、细胞老化、氧化应激等过程[16],过表达Foxo1 可减弱糖尿病引起的肾近端肾小管细胞间质纤维化、ROS 产生和凋亡增加现象,从而实现对高糖诱导的糖尿病肾病的保护[17]。在SDS 中,增强SIRT1-FoxO1 途径介导的自噬可预防氧化应激导致的内皮损伤[18]。β-catenin 作为Wnt 信号通路重要蛋白,可维持骨重建,缺失将导致骨病发生[19]。在DOP 中上调FoxO1 转录活性增加β-catenin 水平,增强机体抗氧化作用防止骨丢失,从而影响成骨细胞的增殖和分化,实现对DOP 的保护[20]。本研究发现,与正常组相比,模型组股骨组织中FoxO1、β-catenin 蛋白水平降低,提示 DOP 中机体FoxO1 水平降低对β-catenin 作用减弱,导致机体抗氧化与氧化平衡破坏,从而加速骨密度降低,加重疾病。与模型组相比,SDS 组、FoxO1 激动剂组骨组织中FoxO1、β-catenin 蛋白水平升高,提示上调FoxO1 转录活性增加β-catenin 水平可增加机体抗氧化作用防止骨丢失,实现对DOP 的保护,且SDS与FoxO1 激动剂功能类似,推测SDS 可能通过激活FoxO1 发挥对DOP 的保护。
综上所述,SDS 可激活 FoxO1/β-catenin 通路实现对DOP 大鼠氧化应激的改善,从而实现对疾病的缓解。但FoxO1 下游通路复杂,亦可能通过其他下游通路实现对DOP 的保护,寻找新的下游通路蛋白是下一步研究的重点。
