QuEChERS结合UPLC-MS/MS方法检测叶用甘薯中芦丁等7种黄酮类物质
2021-04-19许亦峰
许亦峰
摘 要:利用QuEChERS結合UPLC-MS/MS建立叶用甘薯中黄酮类物质的提取检测方法。以福菜薯18为材料,选定芦丁等7种黄酮类物质,试验确定流动相、质谱条件、净化剂等条件,从而确定叶用甘薯中黄酮类物质的提取检测方法。结果表明:以0.2 g C18作为净化剂,流动相(A)0.1%甲酸水-(B)乙腈,芦丁、异槲皮苷、二氢槲皮素、斛皮苷、槲皮素、柚皮素、山奈酚等7种黄酮类物质的碰撞能分别为-23/-40、44/27、23/32、27/42、-31/-29、25/24、-33/-31,7种黄酮类物质在5 min内完全分离,在0.05~1 μg·mL-1范围内线性良好(R2>0.99),芦丁、异槲皮苷、二氢槲皮素、斛皮苷、槲皮素、柚皮素、山奈酚等7种黄酮类物质回收率依次为96.52%~97.64%、97.26%~98.74%、92.95%~94.62%、96.23%~97.65%、90.23%~92.56%、99.12%~101.56%、83.65%~84.64%。基质效应分析中芦丁、异槲皮素ME在100%~120%,表现为弱的基质增强效应,可以忽略;槲皮素、山奈酚ME在120%~150%,表现为中等基质增强效应;二氢槲皮素ME大于150%,表现为强基质增强效应;槲皮苷、柚皮素ME均小于50%,表现为强基质抑制效应。对福菜薯18中7种黄酮类物质检测发现,福菜薯18中不含有二氢槲皮素,异槲皮素含量最高、其次为芦丁。该方法专一性强、灵敏度高、重复性好,为叶用甘薯中黄酮类物质的提取检测提供参考依据。
关键词:QuEChERS法;液质联用色谱仪;叶用甘薯;黄酮化合物
中图分类号:S 531 文献标志码:A 文章编号:0253-2301(2021)11-0055-08
DOI: 10.13651/j.cnki.fjnykj.2021.11.009
Determination of Seven Flavonoids in the Leaf-used Sweet Potatoes byMeans of QuEChERS Combined with UPLC-MS/MS
XU Yi-feng
(Ningde Inspection and Testing Center for Agricultural Product Quality andSafety, Ningde, Fujian 352100, China)
Abstract: The extraction and detection method of flavonoids in the leaf-used sweet potatoes was established by using the QuEChERS combined with UPLC MS/MS. By taking Fucaishu 18 as the material, and selecting the seven flavonoids including rutinum, isoquercitrin, taxifolin, quercitrin, quercetin, naringenin and kaempferol, the conditions such as the flow phase, mass spectrometry conditions, and purifying agent were determined in the experiment, so as to determine the extraction and detection method of flavonoids in the leaf-used sweet potatoes. The results showed that with 0.2 g C18 as the purifying agent and 0.1 % formic acid water (A)- acetonitrile (B) as the flow phase, the collision energies of rutinum, isoquercitrin, taxifolin, quercitrin, quercetin, naringenin and kaempferol were -23/-40, 44/27, 23/32, 27/42, -31/-29, 25/24 and -33/-31, respectively. The seven flavonoids were completely separated within 5 min with good linearity in the range of 0.05-1 μg·mL-1 (R2 > 0.99). The recoveries of rutinum, isoquercitrin, taxifolin, quercitrin, quercetin, naringenin and kaempferol were 96.52%-97.64%, 97.26%-98.74%, 92.95%-94.62%, 96.23%-97.65%, 90.23%-92.56%, 99.12%-101.56%, and 83.65%-84.64%, respectively. In the matrix effect analysis, rutinum and isoquercitrin ME ranged from 100% to 120%, which showed the weak matrix enhancing effect and could be ignored. Quercetin and kaempferol ME ranged from 120% to 150%, showing the moderate matrix enhancing effect. Taxifolin ME was more than 150%, showing the strong matrix enhancing effect, while quercitrin and naringenin ME were both lower than 50%, showing the strong matrix inhibition effect. The seven flavonoids in Fucaishu 18 were detected, and it was found that Fucaishu 18 did not contain taxifolin, and the content of isoquercitrin in it was the highest, followed by rutinum. The method had strong specificity, high sensitivity and good reproducibility, which could provide reference for the extraction and detection of flavonoids in the leaf-used sweet potatoes.
Key words: QuEChERS method; Liquid chromatography-mass spectrometry; Leaf-used sweet potatoes; Flavonoids
叶用甘薯,俗称地瓜叶、番薯叶,属旋花科牵牛花属草本匍匐性蔓生植物,是经人工选择性培育出的专门供人们食用幼嫩茎叶的甘薯品种[1]。叶用甘薯营养丰富,与白菜、菠菜、韭菜、芹菜、茄子、胡萝卜、番茄、甘蓝等13种蔬菜相比,其所含的蛋白质、纤维素、胡萝卜素、烟酸、脂肪、碳水化合物、钙、磷、铁等13项营养成分均居首位[2]。除此之外,叶用甘薯中还含有丰富的功能性成分-多酚类化合物,多酚类化合物是一种含有芳香环和一个以上羟基的物质,具有抗氧化、抗衰老、抗癌等生物活性[3]。Karna等[4]研究表明叶用甘薯中的多酚类物质含量丰富,其总酚含量是其他常见蔬菜的2~3倍。随着人们健康意识的提高,叶用甘薯逐渐走进各家各户的餐桌。在美国叶用甘薯被认为是最具有开发前景的保健蔬菜之一,日本将其列入“长寿食品”,法国称其为“蔬菜皇后”[5]。
黄酮类物质是叶用甘薯中一种重要的多酚类化合物,具有强心,降血压,促进细胞增生,减少糖醇堆积,有助于防止白内障等功效,是天然的食品抗氧化剂,很多研究学者[6-8]对叶用甘薯中黄酮类物质的提取和检测进行了大量的研究。叶用甘薯中黄酮类物质的提取方法主要有溶剂提取、微波辅助提取、酶辅助提取、超声波辅助提取等,但这些提取方法在净化环节需要用到蒸馏、回流酸解等步骤,过程十分繁杂[9]。另外叶用甘薯中黄酮类物质的检测方法通常使用高效液相色谱法、分光光度法、薄层色谱法等,这些检测方法都有各自的不足之处,例如分光光度法只能检测总黄酮的含量,无法对各种黄酮类物质进行分别定量;柱层析和薄层色谱法虽然能做到将各种黄酮类物质进行分离,但只能半定量,而且分析时间长、重复性差;高效液相色谱法能够对叶用甘薯中各黄酮类物质进行分别定量,但相较于液质联用色谱仪,其分析时间长,无法精准定性。
QuEChERS(Quick、Easy、Cheap、Effective、Rugged、Safe),是近年来国际上最新发展起来的一种用于农产品检测的快速样品前处理技术[10]。当前主要用于农产品中农药残留的提取,未见QuEChERS方法应用在叶用甘薯中黄酮类物质的提取。本研究采用QuEChERS结合UPLCMS/MS方法,建立叶用甘薯中芦丁等7种黄酮类物质的提取检测方法,并对其回收率、精确度、基质效应等进行评价,以期为叶用甘薯中黄酮类物质的提取、检测提供依据。
1 材料与方法
1.1 试验材料
试验材料选用品种为福菜薯18,由福建省农业科学院作物研究所提供[11]。
1.2 仪器与试剂
1.2.1 仪器 LCMS8050三重四级杆质谱仪(日本岛津制作所),超声波清洗仪KQ500E(昆山市超声仪器有限公司),DirectQ 5超纯水机(德国默克公司),318KS冷冻离心机(德国默克公司)。
1.2.2 试剂 净化剂PSA(40~63 μm)、GCB(120~400目)、C18(40~63 μm)均購自上海安谱科技股份有限公司;黄酮类化合物:芦丁、异槲皮苷、二氢槲皮素、斛皮苷、槲皮素、柚皮素、山奈酚7种黄酮类物质标准品均购自上海安谱科技股份有限公司,纯度均在99.99%以上;甲醇、乙腈、甲酸均为色谱级,购于上海安谱科技股份有限公司。
1.2.3 标液溶液 储备液:精确称取各标准品5 mg,用5 mL甲醇定容,配制成1 mg·mL-1的单标储备液。
7种黄酮类物质混标储备液:从各黄酮类物质的单标储备液中准确吸取100 μL于1 mL容量瓶中,用甲醇定容至1 mL,配制成100 μg·mL-1储备溶液。
溶剂标准工作液:精确吸取各单标储备液10 μL于10 mL容量瓶中,用甲醇定容10 mL,配制成1 μg·mL-1的混标中间储备液,然后逐级稀释成6个浓度梯度(0.005、0.01、0.05、0.1、0.5、1 μg·mL-1),用于标准曲线的测定。
基质标准工作液:精确吸取各单标储备液10 μL于10 mL容量瓶中,用基质液定容10 mL,配制成1 μg·mL-1的基质标中间储备液,然后逐级稀释成6个浓度梯度(0.005、0.01、0.05、0.1、0.5、1 μg·mL-1),用于标准曲线的测定。
1.3 试验方法
1.3.1 样品前处理 将田间获得的样品经干燥、粉碎、过筛(100目筛)制备成甘薯叶粉末。称取0.2 g甘薯叶粉末,置于10 mL离心管中,加入10 mL甲醇+水(80+20),并充分漩涡振荡。于60℃水浴超声1 h后,5000 r·min-1,离心5 min。吸取2 mL上清液于10 mL离心管内,往管内加入0.2 g净化剂,充分振荡后,5000 r·min-1,离心3 min。吸取1 mL上清液过0.45 nm滤膜,待上机测定。
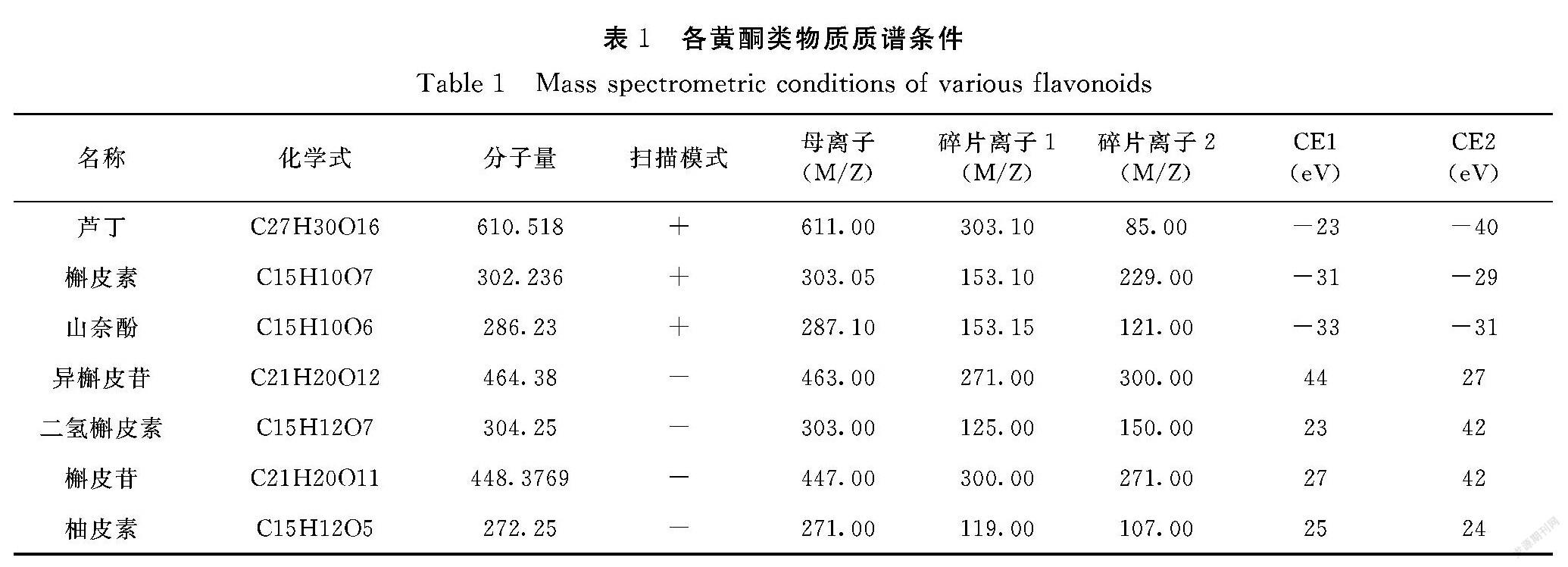
1.3.2 色谱条件 色谱柱:C18(2.1 mm×100 mm);流动相:(A)0.1%甲酸水和(B)乙腈。梯度洗脱程序:0~1 min,20%B;1~3 min,20%B~50%B;3~6 min,50%B~90%B;6~7 min,90%B;7~7.1 min,90%B~20%B;7.1~9 min,20%B。流速:0.3 mL·min-1;柱温:40℃;进样体积:5 μL;雾化气流量:3 L·min-1;接口温度:350℃。
1.3.3 质谱条件优化 用1.2.3的7种单标储备液,各配制成0.1 μg·mL-1待测溶液,用全扫描(SCAN)正负离子模式逐一进样,找到最佳母离子和相对应的离子模式。再对母离子进行不同电压下的产物离子扫描,进而确定定性离子对、定量离子对以及碰撞电压,从而建立最佳的多反应监测(MRM)方法。
1.3.4 流动相选择 用1.2.3的7种混标储备液,配制成0.1 μg·mL-1待测溶液,依次使用(A)水-(B)乙腈、(A)0.1%甲酸水-(B)乙腈、(A)水-(B)甲醇、(A)0.1%甲酸水-(B)甲醇4种不同的流动相,利用1.3.2方法考察4种流动相对芦丁等7种黄酮物质的分离效果及信号响应的影响,选择最佳流动相。
1.3.5 净化剂选择 用1.2.3中100 μg·mL-1的混标储备液配制成1 μg·mL-1混标溶液,各吸取1 mL混标溶液于装有0.2 g PSA、0.2 g C18、0.2 g GCB的10 mL离心管中,充分振荡后,5000 r·min-1,离心3 min。吸取1 mL上清液过0.45 nm滤膜,上机测定,从而考察PSA、C18、GCB这3种净化剂对7种黄酮化合物的吸附作用,从而选择最佳的净化剂。
1.3.6 检测方法评估 精确吸取混合标准溶液,逐级稀释成6个浓度梯度(0.005、0.01、0.05、0.1、0.5、1 μg·mL-1),分別吸取5 μL进行测定。测定结果以峰面积(Y)对其浓度(X)进行线性回归。选取添加水平为0.1 μg·mL-1的标准溶液,连续进样6次,计算每种黄酮物质峰面积相对标准偏差RSD,用来评价方法的重现性。以信噪比S/N=3对应的浓度作为目标物的检出限。
准确称取9份0.2 g叶用甘薯样品,分为3组,分别添加高(2.5 mg·kg-1)、中(0.5 mg·kg-1)、低(0.25 mg·kg-1)3个水平,参照1.3.1方法进行前处理,提取液经UPLC-MS/MS检测,将检测得到的峰面积代入标准曲线,从而得到相应的目标物含量,计算回收率。回收率(%)=A/B×100,其中A表示目标物质的检测值;B表示目标物质的添加量。
1.3.7 基质效应分析 利用基质标准曲线测算出基质中目标物质本底浓度和峰面积,再用溶剂标准曲线测算出对应浓度下溶剂中目标物质的峰面积,利用公式计算基质效应。
基质效应强度ME(matrix effect )(%)=A/B×100。其中A表示样品中黄酮类物质的峰面积;B表示溶剂中同浓度黄酮类物质对应的峰面积。当ME>1时,表示基质增强效应,当ME<1时,表示基质抑制效应。若ME为80%~120%时,表示基质效应不明显,可以忽略该基质效应;若ME在50%~80%或120%~150%时,表现为中等基质效应;若ME<50%或者ME>150%时,则表现为强基质效应[12-13]。
1.3.8 福菜薯18样品检测 称取0.2 g福菜薯18待测样品,按照1.3.1的方法进行前处理,1.3.2条件上机检测,检测福菜薯18中7种黄酮类物质的含量情况。2 结果与分析
2.1 质谱条件优化
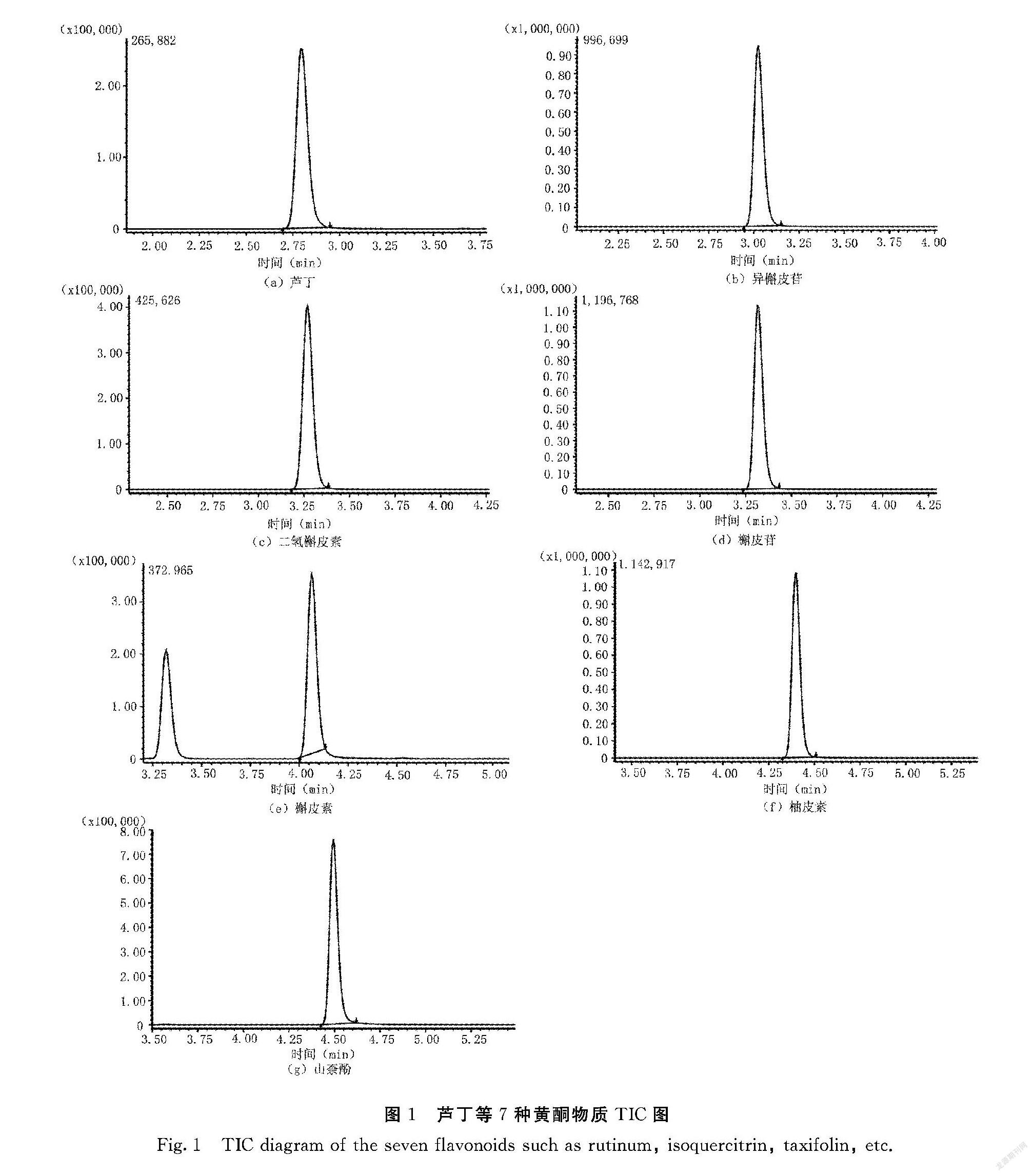
经过试验,优化得到芦丁、异槲皮苷、二氢槲皮素、斛皮苷、槲皮素、柚皮素、山奈酚等7类黄酮类物质的碰撞电压分别为-23/-40、44/27、23/32、27/42、-31/-29、25/24、-33/-31,碎片离子分别为303.10/85.00、271.00/300.00、125.00/150、300.00/271.00、153.10/229.00、119.00/107.00、153.15/229.00,具体检测条件见表1。利用优化后的质谱条件,7种黄酮化合物在5 min内完全分离,且峰型良好(图1)。
2.2 流动相选择
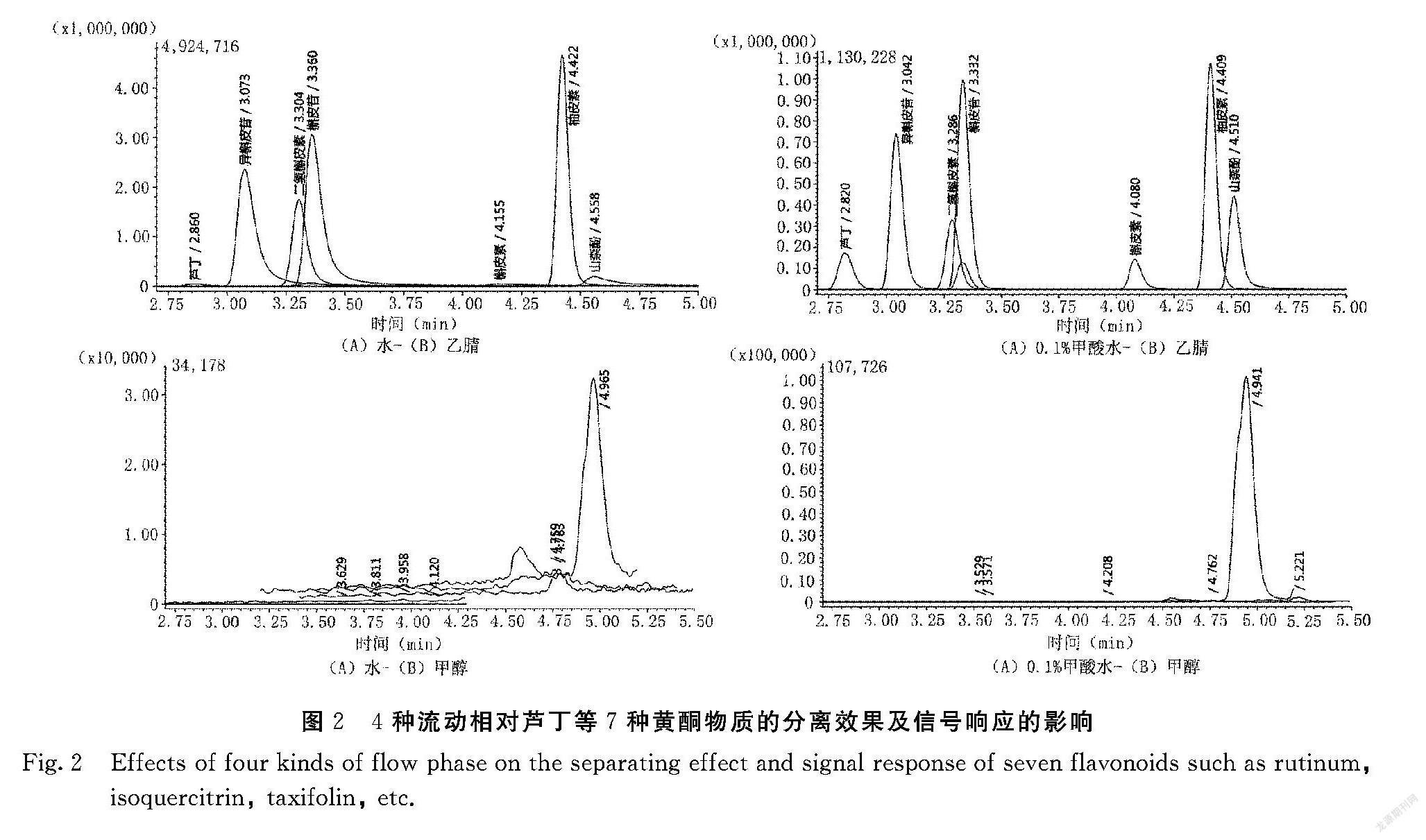
由图2可知,(A)水-(B)甲醇、(A)0.1%甲酸水-(B)甲醇两组流动相与另外两组流动相相比,在相同时间内无法将芦丁等7种黄酮类物质分离。(A)水-(B)乙腈、(A)0.1%甲酸水-(B)乙腈两组流动相均可以将芦丁等7种黄酮类物质分离开,但从图2可知,(A)水-(B)乙腈组成的流动相检测出的芦丁、槲皮素、山奈酚3种黄酮类物质响应值过低,且异槲皮素、槲皮苷、山奈酚3种物质峰型存在拖尾现象,故选择(A)0.1%甲酸水-(B)乙腈作为流动相。
2.3 净化剂选择
由图3可知,PSA对芦丁、异槲皮素、二氢槲皮素、槲皮苷、槲皮素、山奈酚的吸附作用强,回收率在6.7%~33.4%,对柚皮素的吸附作用较弱,回收率为78%;C18对芦丁、异槲皮素等7种黄酮类物质的吸附作用都很弱,回收率在83.2%~100.4%;GCB对芦丁、异槲皮素等7种黄酮类物质的吸附作用强,回收率在6.1%~33.6%。故选择C18作为最佳的净化剂。
确定C18作为净化剂后,继续考察C18的用量对净化效果的影响。由表2可知,随着C18用量的增加,芦丁、异槲皮素等7种黄酮类物质回收率无明显变化,但当C18用量达到0.3 g时,各黄酮类物质的回收率均呈现下降趋势,各黄酮物质降幅在11.3%~16.4%。在回收率变化不大的情况下,尽可能的选择用量大的净化剂,以达到更好的净化效果。故本试验选择C18的用量为0.2 g。
2.4 检测方法评估
2.4.1 方法的分析特征量 试验结果(表3)表明,7种黄酮类物质在0.05~1 μg·mL-1范围内线性良好(R2>0.99),说明该方法的方法灵敏度良好。每种黄酮类物质峰面积的相对标准偏差RSD均小于5%,说明方法有良好的重现性和稳定性,能够用于实际样品中黄酮的分析。
2.4.2 回收率 通过计算(表4)可得芦丁、异槲皮素、二氢槲皮素、槲皮苷、槲皮素、柚皮素、山奈酚回收率分别在96.52%~97.64%、97.26%~98.74%、92.95%~94.62%、96.23%~97.65%、90.23%~92.56%、99.12%~101.56%、83.65%~84.64,RSD均小于5%,具有良好的稳定性。
2.4.3 基质效应 经试验表明芦丁、异槲皮素ME在100%~120%,表现为弱的基质增强效应,可以忽略;槲皮素、山奈酚ME在120%~150%,表现为中等基质增强效应;二氢槲皮素ME大于150%,表现为强基质增强效应;槲皮苷、柚皮素ME均小于50%,表现为强基质抑制效应。
2.5 福菜薯18中7种黄酮类物质的测定
经检测发现,福菜薯18中未检测到二氢槲皮素,表明福菜薯18中不含有该物质,其他6种黄酮物质均有检测到,其中异槲皮素含量最高(26.34 mg·kg-1),芦丁含量次之(5.35 mg·kg-1),槲皮苷、槲皮素、柚皮素、山奈酚含量依次为0.011、0.60、0.032、0.18 mg·kg-1。
3 讨论与结论
本试验建立了QuEChERS结合UPLC-MS/MS提取检测叶用甘薯中芦丁等7种黄酮类物质的方法。QuEChERS在农残检测中较常使用,未见在黄酮类物质提取中使用。本次试验发现净化剂PSA、GCB对黄酮类物质的吸附作用很强,而C18吸附作用较弱,这是因为黄酮类物质多为平面结构,研究表明PSA、GCB对于平面结构的化合物具有强吸附作用[14-15]。此方法利用UPLC-MS/MS對黄酮类物质进行检测,线性检测范围最低达到0.005 μg·mL-1,低于文献中线性检测范围最低点[16-17],而且5 min内7种黄酮类物质可以完全分离,大大提高了检测的准确性和时效性。在后续的试验中,可以尝试在检测方法中加入更多的黄酮类物质,使得叶用甘薯中黄酮类物质的检测更加全面,为叶用甘薯中黄酮类物质的检测提供依据。
参考文献:
[1]曹华,杜会军.叶用甘薯栽培技术[J].北京农业,2016(5):20-23.
[2]邱永祥,吴秋云,蔡南通,等.叶菜型甘薯“福薯7-6”高产无公害栽培主要技术措施[J].上海农业科技,2006(3):75-76.
[3]IGNAT I,VOLF I,POPA V I.A critical review of methods for characterisation of polyphenolic compounds in fruits and vegetables[J].FOOD CHEMISTRY,2011,126:1821-1835.
[4]KARNA P,GUNDALA S R,GUPTA M V,et al.Polyphenol-rich sweet potato greens extract inhibits proliferation and induces apoptosis in prostate cancer cells in vitro and in vivo[J].Carcinogenesis,2011,32(12)1872-1880.
[5]沈梦兰,庞林江,陆国权,等.甘薯叶菜的营养保健及贮藏保鲜技术研究进展[J].食品工业,2019(5):270-274.
[6]刘汉文,陈洪兴,龚晓钰.超声微波协同提取甘薯叶中黄酮类化合物的研究[J].食品工业科技,2014,35(16):298-298.
[7]李志.动态超高压微射流对甘薯叶黄酮提取、结构以及抗氧化性的影响[D]. 南昌:南昌大学,2011.
[8]田欢,李静,王璐璐,等.9个食用型甘薯品种生长期间块根总黄酮含量的变化[J].江苏师范大学学报(自然科学版),2020,38(2):48-51.
[9]王岸娜,向琳,吴立根,等.果蔬中黄酮类物质的研究进展[J].河南工业大学学报(自然科学版),2019,40(3):118-125.
[10]高阳,徐应明,孙扬,等.QuEChERS提取法在农产品农药残留检测中的应用进展[J].农业资源与环境学报,2014,31(2):110-117.
[11]黄浩清.福菜薯18号甘薯[J].蔬菜,2014(12):66-67.
[12]HE Z Y,CHEN S S,WANG L,et al.Multiresidue analysis of 213 pesticides in leek and garlic using QuEChERS-based method and gas chromatography-triple quadrupole mass spectrometry[J].Anal Bioanal Chem,2015,407(9):2637-2643.
[13]孙程鹏,许炳雯,高娜,等.Sin-QuEChERS 结合超高效液相色谱串联质谱法同时检测果蔬中5种双酰胺类杀虫剂[J].食品安全质量检测学报,2020,11(6):1784-1791.
[14]林涛,邵金良,刘兴勇,等.QuEChERS-超高效液相色谱串联质谱法测定蔬菜中41种农药残留[J].色谱,2015,33(3):235-241.
[15]林静,张顺,蔡挺,等.QuEChERS-超高效液相色谱串联质谱技术同时测定大蒜中10种农药残留[J].浙江农业学报,2018,30(1):159-166.
[16]廖海兵,施湘君,刘婷,等.RP-HPLC法同时测定黄秋葵中3个黄酮苷的含量[J].药物分析杂志,2012,32(12):2194-2197.
[17]孙敏,刘嘉铭,张丽萍,等.荷叶中4种黄酮类物质含量的测定[J].贵州农业科学,2015(5):72-74.
(责任编辑:柯文辉)
