蓝莓提取物对小鼠视网膜光损伤的保护作用研究
2021-04-16尹利端刘楚怡仲米存王长伟杜芬李八方
尹利端 刘楚怡 仲米存 王长伟 杜芬 李八方


摘要 [目的]建立视网膜光损伤小鼠动物模型,通过该动物模型评价蓝莓提取物对视网膜光损伤小鼠的保护作用。[方法]综合评價不同剂量蓝莓提取物对视网膜组织结构的影响,以及对视网膜MDA含量,LDH、SOD、CAT和GSH-Px活性的影响。[结果]蓝莓提取物对视网膜光损伤小鼠视网膜组织有显著的改善作用;蓝莓提取物能够显著抑制小鼠视网膜细胞中LDH活性,能够显著抑制视网膜内部的脂质过氧化,还能够显著提高SOD、CAT和GSH-Px等抗氧化酶的活性。[结论]蓝莓提取物对保护小鼠视网膜光损伤具有显著作用。
关键词 视网膜光损伤;蓝莓提取物;保护作用;抗氧化活性
中图分类号 R 285.5文献标识码 A
文章编号 0517-6611(2021)05-0178-03
doi:10.3969/j.issn.0517-6611.2021.05.050
开放科学(资源服务)标识码(OSID):
Study on the Protective Effect of Blueberry Extract on Light-induced Retinal Damage in Mice
YIN Li-duan1,LIU Chu-yi2,3,ZHONG Mi-cun1 et al
(1.Yantai New Era Health Industry Chemical Co.,Ltd.,Yantai,Shandong 264006;2.Marine Biomedical Research Institute of Qingdao,Qingdao,Shandong 266001;3.Ocean University of China,Qingdao,Shandong 266073)
Abstract [Objective] To establish an animal model of retinal light-damaged mice,and evaluate the protective effect of blueberry extract on retinal light-damaged mice through this animal model.[Method] The effects of different doses of blueberry extract on the structure of retinal tissue,as well as on the content of retinal malondialdehyde (MDA),LDH,SOD,CAT and GSH-Px enzyme activity were comprehensively evaluated.[Result]Blueberry extract could significantly improve the retinal tissue of retinal photodamaged mice.Blueberry extract could significantly inhibit the activity of lactate dehydrogenase enzyme in mouse retinal cells,could significantly inhibit lipid peroxidation inside the retina,and could also significantly increase the activity of antioxidant enzymes such as SOD,CAT and GSH-Px.[Conclusion]Blueberry extract has a significant effect on protecting the retina from light damage in mice.
Key words Light-induced retinal damage;Blueberry extract;Protective effect;Antioxidant activity
蓝莓又被称为蓝浆果、越橘,其果实中含有丰富的活性物质,包括多糖、酚类以及以糖苷的形式存在的花青素等。研究发现,蓝莓花青素具有抗过敏、抗肿瘤、免疫调节、抗氧化、保护视力等药理作用,安全无毒,具有较高的营养和药理作用,目前已经广泛应用于药品、保健、食品等领域[1-2]。近年来,随着科技的高速发展,电子光学照明设备、手机电脑等电子产品以及光学诊疗等设备被广泛应用于人们的生活中,也使得视网膜光损伤这一问题逐渐引起了人们的重视[3-4]。视网膜光损伤(light-induced retinal damage ,LIRD),是指当视网膜受到过强光照或者过长时间的光刺激时,使得部分或全层的视网膜组织受损,造成难以恢复的视力损害,甚至永久性失明[5]。视网膜光损伤的致病因素可分为光致热损伤、光致机械损伤和光致化学损伤[6]。其中,光致化学损伤是最主要且最普遍的类型。虽然人的角膜、眼房水、晶状体可以吸收大部分近紫外光,对其进入视网膜产生阻碍,但长时间的短波可见光照射,特别是蓝光波段的照射,仍会导致视网膜损伤。短波可见光能够透过屈光间质到达视网膜,诱发视网膜细胞产生自由基,参与脂质过氧化作用,引起视网膜色素上皮细胞萎缩,致使光感受器细胞凋亡,进而导致视网膜色素变性、老年视网膜黄斑变性等一系列眼部疾病[7-9]。
视网膜光损伤的病理过程主要是视网膜感光细胞的凋亡[10]。大量自由基的产生、脂质过氧化、线粒体损害、钙离子稳态失衡、细胞色素氧化酶抑制、视紫红质作用等都可能参与光损伤视网膜的过程,最终导致视网膜感光细胞凋亡和减少,损伤视网膜组织结构和视功能[11-12]。已有文献报道,外源性抗氧化剂对光损伤后视网膜具有一定的保护作用[13]。因此,笔者利用强蓝光照射的方法[14],建立小鼠的视网膜光损伤动物模型,并在此模型的基础上,评价蓝莓提取物对视网膜光损伤小鼠的视网膜的影响,初步探讨其对小鼠视网膜光损伤保护作用机制。
1 材料与方法
1.1 材料与仪器
蓝莓提取物(blueberry extract,BE),山東烟台新时代健康产业有限公司提供;DPPH检测试剂盒、羟自由基(OH)检测试剂盒、乳酸脱氢酶(LDH)检测试剂盒、超氧化物歧化酶(SOD)检测试剂盒、谷胱甘肽过氧化物酶(GSH-Px)检测试剂盒、过氧化氢酶(CAT)检测试剂盒及丙二醛(MDA)检测试剂盒,南宁建成生物工程有限公司;无水乙醇、氢氧化钠、三氯乙酸、甲醛、甘油等常用试剂均为分析纯。UV-2010PC紫外分光光度计,尤尼克(上海)仪器有限公司;荧光显微镜,奥林巴斯Olympus公司;SPF级Balb/c小鼠,山东朋悦实验动物繁育有限公司。
1.2 蓝莓提取物的制备
取速冻蓝莓果,于室温下避光解冻,准确称取50 g,按照1∶20(m∶V)比例加入提取液,匀浆,于45 ℃水浴浸泡4 h后,超声波辅助提取30 min,超声功率为300 W,提取温度为45 ℃,在3 600 r/min离心15 min,取上清液,旋转蒸发浓缩后,真空冷冻干燥得蓝莓提取物。
1.3 动物试验过程
选择SPF级Balb/c小鼠50只,雌雄各半,平均体重(20±2)g。随机分为5组试验组,分别为正常对照组、视网膜光损伤模型组、BE低剂量组、BE中剂量组和BE高剂量组,每组5只雌性、5只雄性,雌雄分笼饲养。分别按照各组对应样品和计量灌胃,灌服的剂量分别为人体推荐用量的5、10和30倍,正常对照组和模型组灌胃受试物对应溶剂,连续16 d后,开始光损伤试验。光损伤试验:在自制光照箱中安装2个32 W的蓝光灯管[13],使光照箱中心向各方向平均光强度为(5 000±200) lx,温度24~28 ℃。光照前暗适应24 h,接着将除正常组外其他各组给予1%阿托品滴眼散瞳,之后即刻放入光照箱进行12 h持续光照,光照完毕立即进入暗箱12 h,如此重复3次,累计光损伤36 h。光损伤试验过程中仍然持续每日灌胃,累计灌胃21 d。最后一次光损伤周期完成暗环境48 h后,断颈处死,取眼球待用。
1.4 视网膜形态学观察
视网膜组织光损伤会使视网膜组织形态发生变化,该组织形态学观察,可观察到各剂量BE组对视网膜组织微观结构的影响。组织取材后,经PBS清洗,多聚甲醛固定、梯度酒精脱水、二甲苯透明、石蜡包埋连续切片后,进行HE染色,用于光镜检测,观察各组视网膜组织形态,测量视网膜石蜡切片外核层厚度,测量位置为距视神经 240 μm、视网膜损伤最重处。
1.5 光损伤动物视网膜蛋白含量及抗氧化性指标的测定
冰浴条件下摘取眼球,沿赤道部剖开,去除眼前节,剥离视网膜组织,准确称取组织质量,以0.1%TBS冷缓冲液为匀浆介质,用组织匀装机制成10%组织匀浆后,离心取上清,BCA法测定眼球组织中总蛋白含量,并按照南京建成的MDA检测试剂盒、LDH活力检测试剂盒、SOD活力检测试剂盒、GSH-Px活力检测试剂盒和CAT活力检测试剂盒说明书,分别测定视网膜中MDA含量、LDH活力、SOD活力、GSH-Px活力和CAT活力,每个样品重复3次。
1.6 数据统计
采用 Microsoft Office Excel 2003 进行绘图,统计学分析采用 SPSS 19.0软件进行,以t 检验进行显著性分析,P<0.05 差异性显著,P<0.01 差异性极显著。所有数据均以±S表示。
2 结果与分析
2.1 蓝莓提取物对小鼠视网膜组织形态的影响 观察视网膜HE染色切片,比较各组视网膜的组织结构和形态学的差异。如图1所示,正常组的视网膜组织结构完整,细胞层数及数量较多,染色均匀饱满,视网膜各层细胞分布均匀、排列整齐、细胞贴合紧凑,层次分界清楚,神经节细胞层、内核层及外核层细胞的形态圆润饱满。与正常组相比,模型组的视网膜完整性欠缺,视网膜厚度明显变薄,外核层和内核层的细胞层数显著减少,分布不均、细胞排列散乱,且细胞间隙变大,表现出皱缩现象。与模型组相比,各BE剂量组的视网膜结构排列更整齐,外核层厚度明显增加,随着添加剂量的增大,视网膜结构层次、细胞整齐度及各层细胞层数也随之增大。与正常组相比,BE中、高剂量组外核层厚度恢复至正常组水平,但整齐性仍不及正常组。可见中、高剂量蓝莓提取物对视光损伤小鼠视网膜组织有显著的改善作用。
2.2 蓝莓提取物对光损伤小鼠眼球外核层厚度的影响
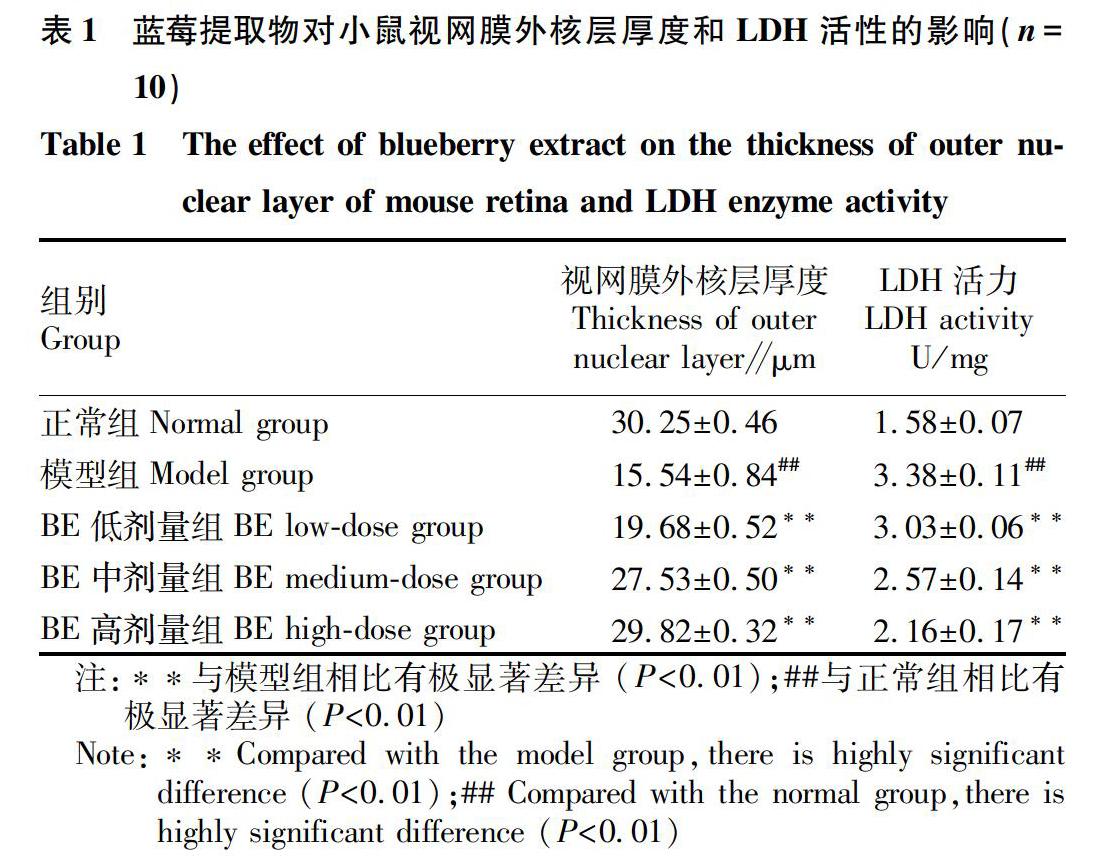
以距视神经 240 μm处外核层厚度为标准,对各组小鼠视网膜外核层厚度进行检测,结果如表1所示。模型组视网膜上外核层厚度仅为正常组的50.1%,差异均具有统计学意义(P<0.01)。与模型组相比,不同剂量组BE的外核层厚度均有不同程度的增加,其中BE高剂量组的小鼠视网膜外核层最高。说明BE具有修复光损伤小鼠视网膜外核层的作用。
2.3 蓝莓提取物对光损伤小鼠视网膜LDH活性的影响 从表1可以看出,与正常组相比,模型组小鼠视网膜LDH活性显著升高;与模型组相比,BE不同剂量组的LDH活性显著降低,且随着BE灌胃剂量的增加,LDH活性逐渐降低。但各BE组的LDH活性与正常组仍存在显著差异。说明BE对光损伤视网膜组织LDH活性有显著的抑制作用。LDH能在氧气不足的情况下经糖酵解催化丙酮酸产生乳酸,而乳酸的过量堆积对机体有一定的毒害作用,引起机体各组织器官病变。因此,BE可以通过降低LDH活性来减缓视网膜组织病变。
2.4 蓝莓提取物对光损伤小鼠视网膜抗氧化酶系的影响
从表2可以看出,与模型组相比,BE各剂量组的SOD活性均极显著增加(P<0.01),说明3种剂量BE均能够显著提高光损伤小鼠视网膜SOD的活性。SOD对机体的氧化与抗氧化平衡起着重要作用,可促进超氧化物阴离子自由基的歧化反应,从而保护细胞免受损伤。有研究报道,可见光照射能透过屈光间质到达视网膜,诱发视网膜细胞产生自由基,并参与脂质过氧化作用[13]。光照可以使细胞内SOD水平下降,而灌胃BE的小鼠视网膜细胞SOD活性较模型组上升,其原因可能是BE能够将超氧阴离子自由基转变为O 2和H 2O,清除其毒性,减轻并防止过氧化,从而达到保护视网膜的作用。
对各组视网膜CAT活性的检测结果表明,与正常组相比,模型组小鼠视网膜CAT活性极显著降低;与模型组相比,BE中、高剂量组CAT活性极显著升高(P<0.01),说明其能够提高光损伤造成的视网膜CAT活性降低,增强抗氧化能力。
GSH-Px是一种在细胞内能清除有害的过氧化物代谢产物的酶,能够阻断脂质过氧化的连锁反应,从而起到保护细胞膜结构和功能完整的作用。与模型组相比,灌胃21 d中、高剂量BE后,光损伤小鼠视网膜中GSH-Px活性极显著升高(P <0.01),当剂量高于20倍时,其GSH-Px的活性与正常组无显著性差异。说明一定剂量BE可促进体内自由基的清除,帮助机体维持GSH-Px的活性,从而对视网膜的结构和功能起到保护作用。
2.5 蓝莓提取物对光损伤小鼠视网膜MDA含量的影响
MDA是脂质过氧化的产物,其含量的高低间接反映了机体细胞受自由基攻击的严重程度。测定各组视网膜光损伤小鼠眼球MDA含量,结果发现(表2),与正常组相比,模型组小鼠视网膜MDA含量极显著升高 (P<0.01);与模型组相比,BE各剂量组的视网膜MDA含量均极显著降低 (P<0.01)。说明BE对小鼠视网膜内部的脂质过氧化具有有效的抑制作用。
3 结论
该研究分析了蓝莓提取物在保护视网膜蓝光损伤中的作用。首先制备蓝莓提取物,并建立视网膜蓝光损伤小鼠动物模型,进而利用该模型发现蓝莓提取物可使视网膜光损伤小鼠的视网膜结构排列更整齐,外核层厚度明显增加,对光损伤视网膜中LDH活性和MDA含量有显著的抑制作用,且可显著提高光损伤小鼠视网膜细胞中SOD、CAT和GSH-Px等抗氧化酶活性。综合以上结果,蓝莓提取物对小鼠视网膜光损伤具有明显的保护作用。
参考文献
[1]
李颖畅,李冰心,孟良玉,等.圣云蓝莓花色苷不同组分的体外抗氧化性和稳定性[J].食品科学,2012,33(9):105-109.
[2]吕芳楠,温靖,徐玉娟,等.蓝莓果实的营养价值和药理作用及其加工利用[J].安徽农业科学,2016,44(18):85-87.
[3] 陈浩,张皓洁,师亮,等.枸杞多糖对帕金森病小鼠的抗氧化作用和神经保护效应[J].中国神经精神疾病杂志,2018,44(10):613-618.
[4] ORGANISCIAK D T,VAUGHAN D K.Retinal light damage:Mechanisms and protection[J].Prog Retin Eye Res,2010,29(2):113-134.
[5] KIM G H,KIM H I,PAIK S S,et al.Functional and morphological evaluation of blue light-emitting diode-induced retinal degeneration in mice [J].Graefes Arch Clin Exp Ophthalmol,2016,254(4):705-716.
[6] 赵玉萍,孙时英,牛建军.视网膜光损伤的防治研究进展[J].国际眼科杂志,2009,9(11):2132-2135.
[7] LI G X,LEE M J,LIU A B,et al.The antioxidant and anti-inflammatory activities of tocopherols are independent of Nrf2 in mice[J].Free Radic Biol Med,2012,52(7):1151-1158.
[8] WENZEL A,GRIMM C,SAMARDZIJA M,et al.Molecular mechanisms of light-induced photoreceptor apoptosis and neuroprotection for retinal degeneration [J].Prog Retin Eye Res,2005,24(2):275-306.
[9] ALGVERE P V,MARSHALL J,SEREGARD S.Age-related maculopathy and the impact of blue light hazard[J].Acta Ophthalmol Scand,2006,84(1):4-15.
[10] SALERO E,BLENKINSOP T A,CORNEO B,et al.Adult human RPE can be activated into a multipotent stem cell that produces mesenchymal derivatives[J].Cell Stem Cell,2012,10(1):88-95.
[11] ZHAO Z,SUN T,JIANG Y,et al.Photooxidative damage in retinal pigment epithelial cells via GRP78 and the protective role of grape skin polyphenols[J].Food Chem Toxicol,2014,74:216-224.
[12] ROEHLECKE C,SCHALLER A,KNELS L,et al.The influence of sublethal blue light exposure on human RPE cells[J].Mol Vis,2009,15:1929-1938.
[13] TOMITA H,KOTAKE Y,ANDERSON R E.Mechanism of protection from light-induced retinal degeneration by the synthetic antioxidant phenyl-N-tert-butylnitrone[J].Invest Ophthalmol Vis Sci,2005,46(2):427-434.
[14] 傅敏,欒洁,冯丽丽.蓝光损伤模型中光源的选择及光照强度的研究[J].眼科研究,2010,28(5):399-400.
