骨性关节炎基于补体系统发病机制的研究进展
2021-04-15汪亚娅李妍王福文
汪亚娅,李妍,王福文
山东第一医科大学(山东省医学科学院),济南250062
骨性关节炎(OA)又称退行性关节病,是一种以关节软骨退行性病变和继发性骨质增生为主要病理改变的慢性关节疾病,临床主要表现为关节疼痛、僵硬、肿胀、活动不便等,严重者会出现关节畸形,影响行走能力甚至丧失行走能力[1]。随着我国人口老龄化加剧,OA 患者越来越多,已成为影响居民生活质量的常见疾病之一。研究表明,衰老、创伤、代谢障碍等多种因素参与OA 的发生、发展[2]。早期OA 患者滑膜液中即可出现T 细胞浸润,而晚期某些细胞因子亦参与局部组织损伤。因此,炎症反应可能在OA 的发生、发展过程中发挥重要作用。有研究认为,OA是由先天性免疫系统介导的低水平慢性炎症性疾病,关节损伤后先天性免疫系统的固有识别病原体模式开启,补体系统被激活形成膜攻击复合物(MAC),促使软骨细胞裂解,同时产生的C3a 和C5a等过敏毒素诱导免疫细胞产生炎症因子,从而引起关节炎症反应[3]。本文结合文献就OA 基于补体系统发病机制的研究进展作一综述。
1 补体系统概述
1.1 补体系统 补体是存在于正常人和动物血清与组织液中的一组经活化后具有酶活性的蛋白质,包括30 余种可溶性蛋白、膜结合性蛋白和补体受体,这些蛋白共同组成的多分子系统被称为补体系统。补体系统是先天性免疫系统的重要组分之一,是机体防御病原体的第一道防线[4]。补体系统是由30 余种蛋白组成的不耐热蛋白水解级联反应攻击性系统,其成分复杂,包括直接参与补体激活的各种补体固有成分、调控补体激活的各种因子以及分布于细胞膜上的补体受体等[5]。补体系统一般具有宿主防御,清除细胞碎片和免疫复合物,以及通过过敏素和B、T淋巴细胞刺激来指导适应性免疫调节等作用。当宿主细胞识别到外源性细胞或修饰的自体细胞上存在有害结构模式时,补体系统即会被激活,从而导致炎症反应,最终引起靶细胞裂解[6]。补体系统的激活可由经典途径、替代途径以及凝集素途径任意一条途径完成,再经一系列丝氨酸蛋白酶的级联反应,形成MAC 以及趋化因子、促炎症因子等介质[7],从而参与细胞增殖和凋亡的调控。
1.2 补体系统激活 补体系统主要包括补体固有成分、补体调控成分和补体受体三部分组成。参与补体激活的主要是补体固有成分,包括C1、C2、C3、C4、C5、C6、C7、C8、C9、B 因子、D 因子、P 因子、凝集素、丝氨酸蛋白酶。根据激活物和激活条件的不同,可将补体激活途径分为经典途径、替代途径和凝集素途径三种,这三种途径产生共同的激活产物C3a、C5a 和C5b-9,见图1。经典途径是由特定的配体结合至由识别蛋白C1q 组成的C1 复合物和蛋白水解亚基C1s、C1r 触发的[8]。补体经典途径激活涉及的补体成分包括C1q、C1s、C4 和C2,其中C1q 是经典补体激活途径中的起始环节,C1s 可提供蛋白酶活性,二者共同作用将C2、C4 裂解为C3 转化酶,最终与C5转化酶共同形成MAC[9]。与经典途径相比,凝集素途径则是发生在细菌上的,与经典途径类似的一系列反应,是甘露糖结合凝集素与富含碳水化合物的结构结合时引起的,其生成的补体成分亦为C3 转化酶[10]。有研究报道,C4d 是凝集素途径和经典途径激活后的共同产物[11]。替代途径是由不稳定的补体成分C3 自身激活及其随后在活化病原体表面沉积而启动的,一直处于低水平持续激活状态[12]。替代途径由B 因子、D 因子和P 因子组成,其活化过程中主要沉积的补体复合物为C1q、C4b、C9 和C3b,这几种因子能够维持替代途径的持续活化。补体系统在机体清除外来抗原和免疫复合物中具有至关重要的作用,但其过度激活可导致自身组织损伤。
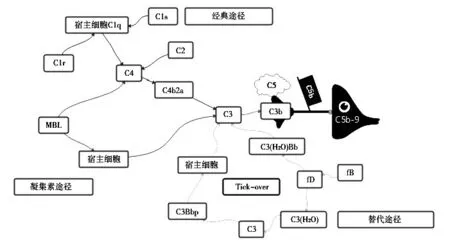
图1 补体系统激活途径概览
2 补体系统与炎症反应的关系
补体系统无论哪种途径激活,最终都汇集于C3、C5 转化酶形成,这两种转化酶会导致过敏毒素C3a、C5a 产生,这些过敏毒素会诱导免疫细胞产生炎症因子,从而促进炎症反应。而补体系统激活产生的MAC 会直接在细胞表面形成跨膜孔,导致细胞裂解,加速炎症反应。MAC 与细胞表面结合时,还会激活促炎症信号转导通路,如MAPK、NF-κB 信号转导通路,这些信号转导通路激活亦能促进炎症反应发生。有研究表明,补体系统的过度激活可能是炎症反应发生的首要事件,也可能继发于低度炎症反应之后[13]。
3 补体系统在OA发生、发展中的作用机制
目前,关于OA 发生、发展的分子机制尚不完全清楚。近年研究认为,先天性免疫系统引起的低度炎症反应可能在其发病过程中具有重要作用。
3.1 OA中由先天性免疫系统介导的炎症信号转导通路 有研究认为,OA不只是单纯的关节退行性疾病,在OA 的发病机制中不仅涉及软骨的破坏,还涉及软骨异位骨形成、关节囊肿大、滑膜炎症等。在排除外部机械性关节损伤后,结合OA 炎症反应发生的时间、炎症反应机制的合理性以及遗传学上缺乏特定的炎症分子动物模型等表明,OA的发生与先天性慢性炎症反应密切相关[14]。OA 通常是在其他风险因素(如肥胖、高龄、代谢紊乱等)情况下触发局部组织损伤,关节的慢性损伤或过度使用最终将转化为炎症反应过程[15]。WANG 等[13]通过蛋白质组学和转录组学分析OA 患者关节滑液发现,先天性免疫系统的主要细胞和因子,包括补体激活片段及其炎症介质(如IL-1β、TNF-α),均在关节滑液中明显升高。有研究还发现,OA患者血清中补体蛋白水平明显升高,这是关节中存在炎症反应的直接标志[16]。这些炎症介质在一定程度上是由于组织损伤和关节破裂而合成的,它们会改变软骨细胞的分化和功能,并诱导基质金属蛋白酶和聚集蛋白聚糖酶的表达和活化,从而促进软骨降解,加剧关节退化[17]。这些证据表明,炎症反应在OA 的发生、发展过程中具有重要作用,靶向治疗炎症可能延缓OA的病情进展。
研究发现,OA 发病过程中的炎症反应是慢性的、低度的,主要是由先天性免疫系统中补体激活所致,而且适应性较低,在OA 早期即开始发挥作用。另外,由于免疫系统、局部组织损伤和代谢功能失调等病理生理过程在体内相互作用,使得这种炎症反应存在于各种原因引起的OA 中,并长期且慢性作用于关节组织,从而加速对关节软骨的损伤[18]。最关键的是,这种炎症反应可作用于整个关节,包括关节软骨、滑膜、软骨下骨、关节囊等。OA的炎症病理状态主要由先天性免疫系统介导,生成MAC 直接造成软骨损伤,相应地软骨受损又会引起新的炎症反应,最终导致关节不可逆性损伤,长期如此将导致整个关节坏死。因此,进一步阐明炎症反应在OA 发生、发展过程中的病理生理机制,有助于实现通过靶向控制炎症反应来预防或控制疾病进展。
3.2 骨组织代谢与补体系统的关系 通常分解代谢和合成代谢不平衡而导致的体内平衡失调是由细胞因子级联与炎症介质共同驱动的。在骨骼重塑过程中,成骨细胞与破骨细胞存在动态平衡,这对于维持骨骼质量至关重要[19-20]。有研究表明,补体系统激活能够调控关节中骨组织代谢,如C5a 通过其下游信号通路串扰调控骨组织代谢。MODINGER等[21]研究发现,成骨细胞在分化过程中C5a 受体1(C5aR1)过表达,而C5aR1能够与成骨细胞中的Toll样受体2 相互作用,从而激活p38 MAPK 信号通路,继而诱导破骨细胞产生C-X-C基序趋化因子10。过敏毒素C5a与C-X-C基序趋化因子10相互作用可加重骨组织损伤[13]。该研究还发现,干扰素γ 信号传导在C5a 调控的最主要途径中发挥免疫调节作用,并能够影响骨组织代谢[13],表明C5a 在干扰素信号传导途径中作为骨组织代谢和免疫系统的调节剂而发挥作用。总之,补体系统激活失调在OA 的发病机制中具有至关重要的作用,或可通过减少补体系统激活产物的生成来防止细胞裂解,从而减轻关节炎症反应。
3.3 基于补体系统的OA 发病机制 OA 是由先天性免疫系统引起的,而补体系统是先天性免疫系统的核心组成部分。免疫系统通过特定的模式识别细胞表面或内部的受体和病原体,不仅可识别与病原体相关的分子模式,还可识别与损伤相关的分子模式(DAMPs)。有研究发现,至少有4 种DAMPs 与OA 有关,如炎症部位的细胞外基质破坏产物、炎症诱发或损伤诱发的血管渗漏、受损或坏死细胞释放的细胞内警报蛋白以及由于损伤或磨损从软骨释放至关节腔的微观晶体。产生的这些内源性损伤相关分子可以向先天性免疫系统发出信号,从而激活模式识别受体和补体[14]。补体激活后产生MAC,并诱导免疫细胞产生一系列炎症介质,这些炎症介质通常会逆向再次激活补体系统,再次激活对组织损伤具有一定修复作用[22]。这种炎症—修复循环长期存在,可能对关节具有破坏性,导致关节内部产生低度慢性炎症反应,这种炎症反应又会加剧关节损伤,再次引起免疫激活反应,加重炎症反应,最终导致OA的发生。在诱导炎症反应过程中,与DAMPs结合的主要受体之一是Toll样受体1~7和Toll样受体9,这表明Toll样受体的活化可能与OA病程中的滑膜炎、软骨变性和疾病易感性有关[23]。在这一过程中,先天性免疫系统激活是OA 发生的关键,而补体系统是先天性免疫系统的核心组成部分,故补体系统激活的机制有可能是探索OA 发病机制的突破点。以往有研究报道,在OA 患者的软骨和滑膜组织中检测到补体成分和免疫球蛋白沉积,并且后续的研究证实补体成分是由软骨细胞产生的[24],表明补体系统在OA 的发病机制中具有重要作用。因此,通过分析补体系统激活途径中的相关因子,或许能够阻止或减缓OA病情进展。
补体系统激活后,其产物受炎症因子调控后生成C3、C5 转化酶,C3、C5 转化酶可诱导产生C3a、C5a 两种过敏毒素,这两种过敏毒素能够诱导免疫细胞产生趋化因子,并通过激活MAPK 信号通路,最终导致OA 发生。补体系统激活后生成的产物MAC可插入软骨细胞的表面,从而使软骨细胞裂解,MAC 还可诱导NF-κB 信号转导通路,最终导致OA发生[4,25]。见图2。
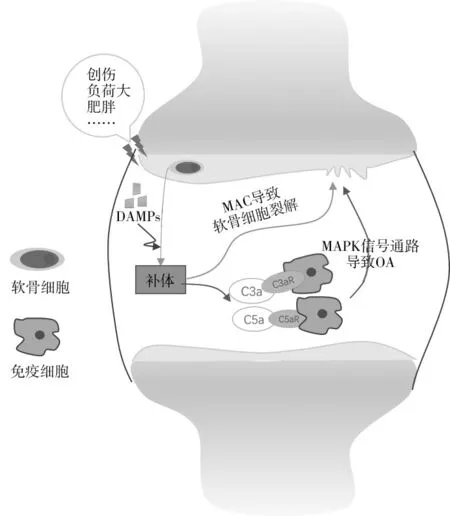
图2 OA的发病机制示意图
另外,补体系统还具有自反应性,可由机体自发激活,如细胞外基质中的纤维调节蛋白和骨黏附素可通过结合C1q 由经典途径激活补体系统,从而诱发一些炎症性疾病和自身免疫性疾病[4]。这种自反应性引起的炎症反应也可能是OA 发病机制的重要组成部分[4]。
综上所述,OA是由先天性免疫系统介导的低水平慢性炎症性疾病,而补体系统是先天性免疫系统的核心组成部分,故补体系统激活介导的免疫应答反应可能是OA 发病的重要机制。因此,深入研究OA 发生、发展中的炎症反应机制和补体激活途径,将为我们提供更多的信息,从而为OA 的治疗提供新的方法。但目前临床尚无抑制补体激活的特异性药物,还需要进一步研究。
