响应面优化滇黄精多糖提取及其结构与活性分析
2021-04-15梁朋光孙健岳健苏娟唐雅园栾会燕邱福荣杨兆杏向昱何雪梅
梁朋光 孙健 岳健 苏娟 唐雅园 栾会燕 邱福荣 杨兆杏 向昱 何雪梅

摘要:【目的】通過优化动态超高压微射流法对滇黄精多糖提取的相关工艺条件,分析其结构与活性,为滇黄精多糖的多元化利用提供技术支持。【方法】以滇黄精多糖得率为考察指标,在单因素试验的基础上设计响应面法分析试验,确定动态超高压微射流法提取滇黄精多糖的最佳条件;并对滇黄精多糖的功能活性(酪氨酸酶抑制活性、α-糖苷酶抑制活性及DPPH自由基清除能力等)与结构特性(红外光谱、相对分子量及单糖组成等)进行研究。【结果】经响应面分析构建滇黄精多糖得率的二次回归方程:Y=19.55+0.7A+0.78B+0.89C+0.28AB+1.26AC+0.84BC-1.84A2-4.72B2-2.3C2(R2=0.9860)(Y表示滇黄精多糖得率,A、B、C分别表示微射流压力、料液比和提取时间),提取时间、料液比及微射流压力与提取时间的交互作用对滇黄精多糖得率有极显著影响(P<0.01),微射流压力及提取时间与料液比的交互作用对滇黄精多糖得率有显著影响(P<0.05),3个因素对多糖得率影响的排序为:提取时间>料液比>微射流压力;滇黄精多糖的最佳提取工艺条件为:微射流压力146 MPa、料液比1∶41、于100 ℃下提取70 min,在此条件下,滇黄精多糖得率为19.57%,达理论预测值的98.69%。滇黄精多糖是一种由11种单糖组成的吡喃型酸性多糖,相对分子量为35.95 kD,具有较强的DPPH自由基清除能力、α-葡萄糖苷酶抑制活性和酪氨酸酶抑制活性,半抑制质量浓度(IC50)分别为0.43、4.07和2.87 mg/mL。【结论】采用响应面法优化动态超高压微射流法提取滇黄精多糖的得率高,预测性良好,滇黄精多糖具有良好的功能活性,有广泛的开发前景。
关键词: 滇黄精多糖;响应面分析;动态超高压微射流;提取工艺;结构;活性
中图分类号: S567.219 文献标志码: A 文章编号:2095-1191(2021)12-3434-12
Response surface optimization of extraction and structure and activity analysis of polysaccharides from Polygonatum kingianum Coll. et Hemsl.
LIANG Peng-guang1, SUN Jian2, YUE Jian3, SU Juan3, TANG Ya-yuan2, LUAN Hui-yan1,Khoo Hock Eng3, YANG Zhao-xing2,XIANG Yu2, HE Xue-mei2*
(1Yantai Gold Vocational College,Yantai,Shandong 264000, China; 2Agro-food Science and Technology Research Institute,Guangxi Academy of Agricultural Sciences/Guangxi Key Laboratory of Fruits and Vegetables Storage-processing Technology, Nanning 530007, China; 3Yunnan Shanlihong Biotechnology Co., Ltd.,Kunming 650200, China)
Abstract:【Objective】The extraction of polysaccharides from Polygonatum kingianum Coll. et Hemsl.(PKP) by dynamic high-pressure microfluidization(DHPM) were optimized and its structure and activity were analyzed, which provide technical support for the diversified utilization of PKP. 【Method】Response surface methodology (RSM) was designed on the basis of single factor experiment to determine the optimal extraction conditions of PKP to determine the optimal extraction conditions by DHPM,with PKP yield as the indicators. The activities (tyrosinase inhibitory activity, α-glycosidase inhibitory activity, DPPH radical scavenging activity) and structural characteristics (infra-red spectrum, relative molecular weight, monosaccharide composition) of PKP were studied. 【Result】The quadratic regression equation established by RSM and the model had good fitting degree,as follow:Y=19.55+0.7A+0.78B+0.89C+0.28AB+1.26AC+0.84BC-1.84A2-4.72B2-2.3C2(R2=0.9860)(Y was extraction yield,A was microfluidization pressure,B was material-liquid ratio and C was extraction time). Influence of extraction time,material-liquid ratio and interaction of microfluidization pressure and extraction time to PKP yield were extremely significant(P<0.01). Influence of microfluidization pressure and interaction of material-liquid ratio and extraction time to polysaccharides yield were and significant(P<0.05). Parameters influencing PKP yield were in the order as follows:extraction time>material-liquid ratio>microfluidization pressure. The optimal parameters were microfluidization pressure of 146 MPa, material-liquid ratio of 1∶41, extracting time of 70 min at 100 ℃. Then the polysaccharides yield was 19.57%, and 98.69% of the theoretical prediction was obtained. PKP was an acidic polysaccharide composed of 11 monosaccharides with a relative molecular weight of 35.95 kD. PKP showed strong DPPH radical scavenging ability, α-glycosidase inhibitory activity and tyrosinase inhibitory activity. The semi-suppressed mass concentration(IC50) were 0.43, 4.07 and 2.87 mg/mL respectively. 【Conclusion】 RSM is suitable for optimize the extraction parameters of PKP by DHPM. The yield of PKP obtained by this method is high and has good predictive performance. PKP has good functional activities and wide development prospect.
Key words: Polygonatum kingianum Coll. et Hemsl. polysaccharides; response surface methodology; dynamic high-pressure microfluidization; extraction technique; structure; activity
Foundation item:Yunnan Scientific Research Talents and Platform Project(2019IC054);Guangxi Scientific Base and Talents Project(Guike AD19110141); Basic Research Project of Guangxi Academy of Agricultural Sciences(Guinongke 2021 YT112, Guinongke 2021YTI16)
0 引言
【研究意义】作为我国药典收录的三大黄精品种之一,滇黄精(Polygonatum kingianum Coll. et Hemsl.)是一种传统的药食两用药材,其功效包括益气补脾与润肺滋肾(国家药典委员会,2015;肖韵铮等,2020)。多糖是滇黄精的主要功效成分之一,现代药理学证明其具有抗肿瘤、抗衰老、抗氧化、增强免疫力、降血脂以及降血糖等活性,目前已在食品、保健品、药品及化妆品领域中得到了较多的应用(Debnath et al.,2013;衡银雪等,2017;吴其国等,2018;Li et al.,2018;Tang et al.,2019)。多糖生物活性与化学结构紧密相关,而多糖的化学结构很大程度上受提取方式影响(陈灿辉等,2019;叶兴乾等,2019),提取方法的差异导致细胞壁中释放出不同成分,因此其多糖化学结构会有所不同(Broxterman and Schols,2018)。多糖的提取是滇黄精多糖应用的基础,适宜的提取技术对滇黄精开发利用起到至关重要的作用,研究特定提取方式下多糖的化学结构和主要生物活性对其应用也具有重要意义。【前人研究进展】在提取黄精多糖方面,常用的技术包括酶解提取法、酸碱提取法及热水浸提法等。赵瑞萌等(2010)研究发现采用碱提法可提高黄精多糖提取率,获得提取率为11.89%;宫江宁等(2019)采用水提醇沉法提取黄精多糖并优化其提取参数,黄精多糖得率可达(7.96±0.12)%;张梓原等(2020)比较水提醇沉法和复合酶解法对黄精多糖的提取效果,结果发现复合酶解法得到的多糖得率(22%)远高于水提醇沉法得到的多糖得率(8.84%),且提取温度较低;唐兰芳等(2021)改进提取溶剂,采用低共熔溶剂提取黄精多糖,所得多糖提取率是热水提取的3.40倍,多糖分子质量显著大于热水提取所得的多糖,单糖组成更复杂,多糖的抗氧化与抗糖基化能力显著强于热水提取法。近年的研究结果显示,若在提取前进行适当的破壁处理,将会有助于多糖得率的进一步提升,因此研究者们基于常规的提取方法,发展了一些更高效的提取技术,包括高压辅助提取技术、闪式提取技术、微波辅助提取技术和超声波辅助提取技术等,同时还有结合多种方法的复合提取技术,这些方法各具优势。粟敏等(2016)将离子液体—微波辅助用于提取多花黄精多糖,提取125 s下获得提取率为12.79%;魏炜等(2019)采用响应面法优化超高压提取滇黄精多糖的工艺条件,在压力255 MPa下提取9.5 min,多糖提取率为25.01%,远高于热水浸提的提取率;于伟凯等(2020)采用微波辅助提取泰山黄精多糖,提取时间缩短至2 min;刘日斌等(2021)利用超声辅助酶法提取黄精多糖,提取率达25.63%。可见破壁前处理辅助新型提取技术在提取效率和得率方面表现出巨大优势。【本研究切入点】动态超高压微射流(DHPM)已应用于多糖的提取和改性领域,其主要原理是利用瞬间的压力释放、强烈剪切及高速碰撞等相关作用,使细胞壁发生破裂,提升传质速度,利于多糖提取率的进一步提升;此外,可将多糖分子链条剪断,使分子聚集状态、微粒粒度及单糖组成等有所改变,从而改变多糖的空间结构及分子内与分子间作用力(姜颖等,2010;李亚楠等,2015)。秦令祥等(2019)通过动态超高压微射流技术提取黑木耳多糖,结果发现其比热水浸提、超声波辅助和微波辅助提取法的提取效率高,同时所提取多糖的抗氧化活性有明显提高。可见,动态超高压微射流技术可实现多糖的高效率提取,但目前采用其进行滇黄精多糖提取,并研究多糖活性与结构的文献报道较少。【拟解决的关键问题】通过响应面法对动态超高压微射流辅助提取滇黄精多糖工艺进行优化,并探讨其对滇黄精多糖生物活性、理化性质及结构的影响规律与内在机理,为滇黄精多糖的开发与应用提供技术支持。
1 材料与方法
1. 1 试验材料
滇黄精原料采自云南普洱(2020年1月),将其清洗干净后切片,在50 ℃下烘干,粉碎过筛(60目)备用。主要试剂:阿卡波糖(拜耳医药保健有限公司);单糖标准品、葡聚糖标准品、1,1-二苯基-2-三硝基苯肼(DPPH)、α-葡萄糖苷酶、酪氨酸酶(美国Sigma公司);熊果苷[珠峰贸易(广州)有限公司];1-苯基-3-甲基-5-吡唑啉酮(PMP)、对硝基苯基-β-D-吡喃半乳糖苷(PNPG)(北京索莱宝科技有限公司)。主要仪器设备:Agilent 1260高效液相色谱仪(美国安捷伦公司)、 M-110EH型微射流均质机(美国Microfluidics公司)、傅里叶变换红外光谱仪FT-IR650(天津港东科技发展股份有限公司)、GYB40-10S小型均质机(上海东华高压均质机厂)、HAAKE Mars-III旋转流变仪(德国赛默飞世尔公司)、752N紫外可见分光光度计(上海精密科学仪器有限公司)、RE-52AA旋转蒸发仪(上海亚荣生化仪器厂)、SHZ-82水浴恒温振荡器(江苏省金坛市恒丰仪器厂)、101-3電热鼓风恒温干燥箱(上海浦东荣丰科学仪器有限公司)。
1. 2 试验方法
1. 2. 1 动态超高压微射流法提取滇黄精多糖 在秦令祥等(2019)的方法上进行部分改进。称量滇黄精粉末(含水量9.83%)5 g,按试验设定比例分散于蒸馏水中,通过均质机进行5 min均质处理(压力设定为30 MPa),按试验设计的压力参数进行微射流均质后热水浸提,所得多糖提取液在5000 r/min条件下离心10 min,取上清液在60 ℃下减压浓缩后醇沉,醇沉后的样品进行离心处理(5000 r/min、10 min),冷冻干燥得到滇黄精多糖(Polysaccharides from Polygonatum kingianum Coll. et Hemsl.,简称PKP)。
1. 2. 2 多糖含量测定 采用苯酚—硫酸法测定,按照公式(1)计算多糖得率:
多糖得率(%)=提取所得多糖质量/原料质量×
100 (1)
1. 2. 3 单因素试验设计
1. 2. 3. 1 微射流压力对滇黄精多糖得率的影响
固定其他提取参数为微射流处理次数1次、提取时间1.0 h、提取温度100 ℃、料液比1∶40(g/mL,下同),在此条件下考察不同微射流压力(80、100、120、140、160和180 MPa)对滇黄精多糖得率的影响。
1. 2. 3. 2 微射流处理次数对滇黄精多糖得率的影响 固定其他提取参数为微射流压力140 MPa、提取时间1.0 h、提取温度100 ℃、料液比1∶40,在此条件下考察不同微射流处理次数(1、2、3、4和5次)对滇黄精多糖得率的影响。
1. 2. 3. 3 提取时间对滇黄精多糖得率的影响 固定其他提取参数为微射流压力140 MPa、微射流处理次数1次、提取温度100 ℃、料液比1∶40,在此条件下考察不同提取时间(0.5、1.0、1.5、2.0、2.5和3.0 h)对滇黄精多糖得率的影响。
1. 2. 3. 4 提取温度对滇黄精多糖得率的影响 固定其他提取参数为微射流压力140 MPa、微射流处理次数1次、提取时间1.0 h、料液比1∶40,在此条件下考察不同温度(60、70、80、90和100 ℃)对滇黄精多糖得率的影响。采用回流提取法进行多糖提取,避免溶剂蒸发造成的试验误差。
1. 2. 3. 5 料液比对滇黄精多糖得率的影响 固定其他提取参数为微射流压力140 MPa、微射流处理次数1次、提取时间1.0 h、提取温度100 ℃,在此条件下考察不同料液比(1∶10、1∶20、1∶30、1∶40、1∶50和1∶60)对滇黄精多糖得率的影响。
1. 2. 4 响应面法试验设计 在Box-Behnken原理的基础上,全面考虑单因素试验所得的相关结果,选取料液比、提取时间及微射流压力等指标开展响应面分析研究(3因素3水平),优化该提取工艺。以多糖得率作响应值,响应面试验因素与水平见表1。
1. 2. 5 多糖相对分子质量测定 采用高效凝胶色谱法(HPGPC)测定多糖相对分子质量。多糖样品配制成所需溶液(2.0 mg/mL),无菌滤膜(0.22 μm)以备用。HPGPC测定分析的主要条件如下:色谱柱Agilent PL aquagel-OH Mixed(300 mm×7.5 mm,8 μm);柱温35 ℃;所用示差折光检测器型号为Waters2414,以超纯水作流动相,进样量和流动速度分别为50 μL和0.6 mL/min。配制系列不同分子量的葡聚糖溶液为标准品作标准曲线,多糖的分子量根据标准曲线计算。
1. 2. 6 單糖组成测定 单糖组成参考范斌等(2021)的方法,采用PMP柱前衍生—高效液相色谱(HPLC)法测定。
1. 2. 7 多糖红外光谱分析 以溴化钾压片作空白对照,采用FT-IR650型傅里叶变换红外光谱仪进行分析,波数范围为500~4000 cm-1。
1. 2. 8 DPPH自由基清除能力测定 参考何雪梅等(2014)的方法测定滇黄精多糖抗氧化能力。以维生素C(Vc)作阳性对照。
DPPH自由基清除率(%)=[1-(A样品-A样品空白)/
A空白]×100 (2)
式中:A样品为2 mL样品+2 mL DPPH自由基溶液;A样品空白为2 mL样品+2 mL无水乙醇;A空白为2 mL DPPH自由基溶液+2 mL无水乙醇。
1. 2. 9 多糖降血糖活性能力测定 参考施吉祥等(2019)的方法测定分析滇黄精多糖的α-葡萄糖苷酶抑制能力,采用阿卡波糖作阳性对照,酶活性抑制率按照公式(3)进行计算:
α-葡萄糖苷酶活性抑制率(%)=[1-(A样品-A样品空白)/
A空白]×100 (3)
式中:A空白为不加待测样品反应后的吸光值;A样品为加入待测样品反应后的吸光值;A样品空白为只加入待测样品反应后的吸光值。
1. 2. 10 酪氨酸酶活性测定 参考Muhammad等(2019)的方法测定滇黄精多糖的酪氨酸酶活性,以熊果苷作阳性对照,根据公式(4)计算酪氨酸酶活性抑制率:
酪氨酸酶活性抑制率(%)=[1-(A1–A2)/(A3-
A4)]×100 (4)
式中:A1为样品吸光值;A2为样品背景组(PBS溶液代替酪氨酸酶)吸光值;A3为空白组(蒸馏水代替样品)吸光值;A4为空白背景组(蒸馏水代替样品、PBS溶液代替酪氨酸酶)吸光值。
1. 3 统计分析
采用Design Expert 8.0.6.1对响应面试验结果进行分析,以Origin 8.0制图。
2 结果与分析
2. 1 单因素试验结果
2. 1. 1 不同微射流压力对滇黄精多糖得率的影响
由图1可知,滇黄精多糖得率随着微射流压力的增大呈先显著升高(P<0.05,下同)后逐渐降低的变化趋势。在80~140 MPa范围内滇黄精多糖得率迅速升高,多糖得率由10.15%增至18.21%,提高79.41%;微射流压力在140~180 MPa时,滇黄精多糖得率缓慢下降。微射流压力的增大有利于多糖得率的提升,但当压力值高于140 MPa时,多糖溶出无明显增加。因此,微射流压力选择140 MPa为宜。
2. 1. 2 不同微射流次数对滇黄精多糖得率的影响
如图2所示,随着微射流处理次数的增加,滇黄精多糖得率并无明显增大趋势,不同处理次数间的多糖得率无显著差异(P>0.05,下同),说明微射流处理次数对滇黄精多糖得率影响较小,处理1次即达到细胞壁破碎的效果,后续响应面试验无需考察微射流处理次数对滇黄精多糖得率的影响。
2. 1. 3 不同提取时间对滇黄精多糖得率的影响
如图3所示,在提取时间0.5~1.0 h,滇黄精多糖得率迅速增大,从12.18%显著提高到17.29%,增加41.95%;而从1.5 h开始,滇黄精多糖得率呈缓慢下降趋势,到3.0 h时多糖得率显著降低。表明提取时间达到1.0 h时滇黄精多糖已基本溶出,延长提取时间不能提高得率,反而因溶剂挥发等原因使多糖得率降低,因此后续试验中提取时间以60 min为宜。
2. 1. 4 不同提取温度对滇黄精多糖得率的影响
如图4所示,滇黄精多糖得率随提取温度的升高而不断增大,100 ℃时多糖得率达最大值。对比不同提取温度之间多糖得率发现,除90和100 ℃外,其余温度之间多糖得率存在显著差异,说明提取温度对滇黄精多糖得率具有显著影响,提高温度可促进多糖快速溶出。鉴于试验结果明确100 ℃时多糖得率最高,且试验中无法十分精准地控制温度,故后续提取中直接选取100 ℃为最适提取温度,在响应面试验中不再考察提取温度的影响。
2. 1. 5 不同料液比对滇黄精多糖得率的影响 从图5可看出,在料液比1∶10~1∶40范围内,随着提取溶剂用量的增加,滇黄精多糖得率显著升高,当料液比低于1∶40时,滇黄精多糖得率反而小幅度下降,但各料液比(1∶40~1∶60)间无显著差异。因此,滇黄精多糖提取的料液比以1∶40较合适。
2. 2 响应面优化试验结果
2. 2. 1 回归模型的建立与分析 采用Design Expert 8.0.6.1进行试验数据分析,结果见表2。通过对数据回归拟合分析后,得到各试验影响因子对多糖得率的二次多项式回归模型:Y=19.55+0.7A+0.78B+0.89C+0.28AB+1.26AC+0.84BC-1.84A2-4.72B2-2.3C2(R2=0.9860)。
进一步对试验结果进行显著性分析,响应面数据的方差分析结果如表3所示,所建立的回归模型对试验具有良好的拟合度,因模型达极显著水平(P<0.01,下同)、失拟项不显著,说明试验误差小。模型的R2为0.9860,说明试验精确度高,可准确解释试验中滇黄精多糖得率的变化,因此,可用该方程对不同提取条件下的滇黄精多糖得率进行预测。根据回归方程各影响因子的F值可看出,提取时间和料液比对滇黄精多糖得率的影响均达极显著水平,微射流压力的影响达显著水平,由回归方程式中各项系数可知,提取时间对滇黄精多糖得率影响最大,料液比次之,微射流压力的影响最小。
2. 2. 2 因素间交互作用分析 由滇黄精多糖得率的回归分析結果(表3)可知,微射流压力与提取时间的交互作用对滇黄精多糖得率有极显著影响,提取时间与料液比的交互作用对滇黄精多糖得率有显著影响。为更直观地反映各因素对滇黄精多糖的影响,对回归模型进行响应面交互作用分析。图6所示为当提取时间为1.0 h时微射流压力与料液比间的交互作用。随着料液比降低与微射流压力提高,多糖得率呈先增后减的变化趋势,在微射流压力为145 MPa和料液比为1∶40左右时达最大值。从等高线和响应面整体来看,料液比的等高线较密,响应面较陡峭,料液比对多糖得率的影响大于微射流压力的影响。
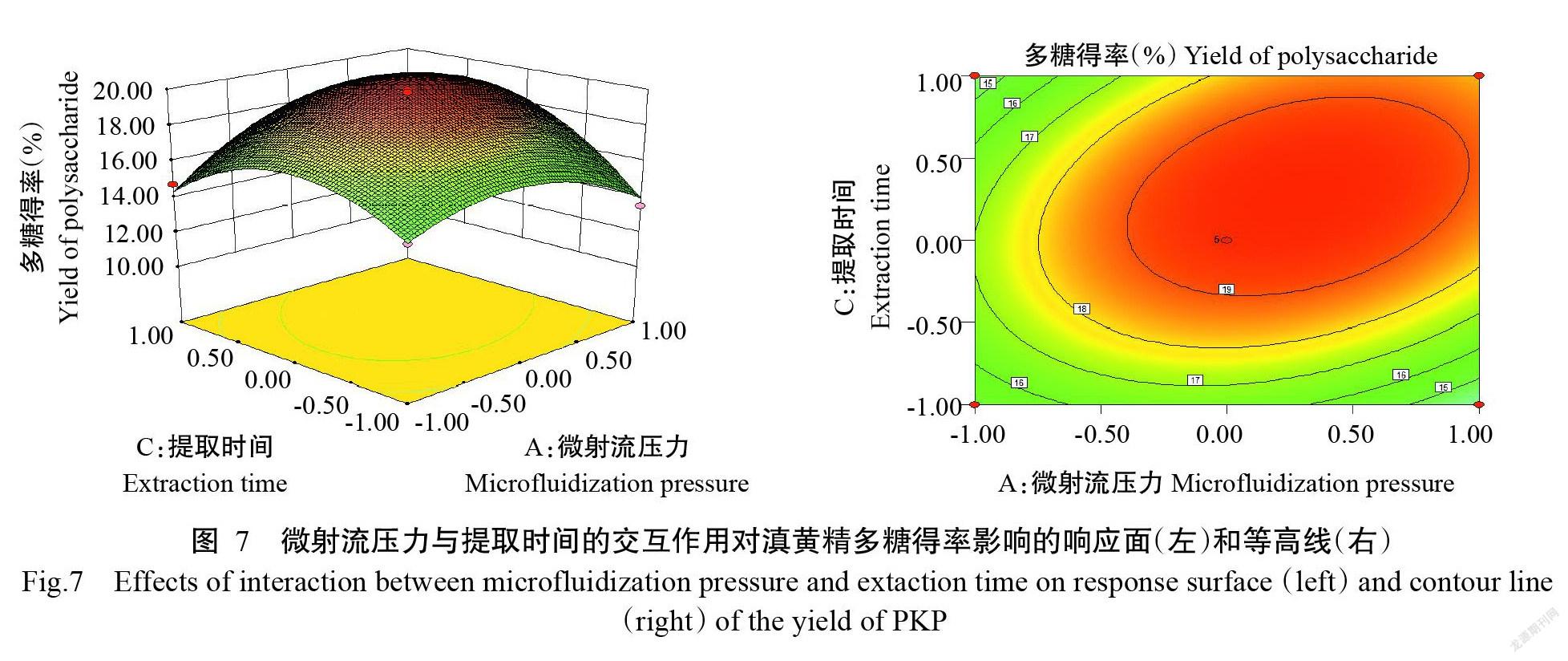
从图7和图8可看出,与微射流压力与料液比间的交互作用相似,微射流压力与提取时间、提取时间与料液比之间的交互作用也呈先上升后下降的变化趋势。微射流压力与提取时间之间的交互作用对滇黄精多糖得率有极显著影响,当料液比为1∶40、微射流压力为147 MPa、提取时间为1.23 h时,多糖得率达最大值,提取时间的等高线较密,响应面较陡峭,对滇黄精多糖得率影响较大。提取时间与料液比之间的交互作用对滇黄精多糖得率有显著影响,当提取时间为1.1 h、料液比为1∶42时,多糖得率达最大值,等高线呈圆形,二者对多糖得率的影响相差较小。
2. 3 验证试验结果
通过Design-Expert 8.0.6.1优化出滇黄精多糖的最佳提取工艺条件为:微射流压力146 MPa、料液比1∶41.20、于100 ℃下提取1.15 h,预测滇黄精多糖得率为19.83%。为进一步检验该试验方法的可靠性,结合实际操作情况,调整参数为:微射流压力146 MPa、料液比1∶41、于100 ℃下提取70 min,进行验证试验,实际测得滇黄精多糖得率为19.57%,达理论预测值的98.69%,由此可知,通过响应面法优化的提取工艺具有良好的精度与可靠性。
2. 4 滇黄精多糖的相对分子质量
滇黄精多糖经纯化洗脱可获得主峰1个(图9)。通过HPGPC法测定其相对分子质量,以系列葡聚糖标准品相对分子质量的对数对保留时间作回归处理,得到重均分子量(Mw)和数均分子量(Mn)的校正回归方程。根据标准品曲线,得出计算公式进而计算出样品的分子量大小。
lgMw=-0.208x+12.968(R2=0.993)
lgMn=-0.181x+11.734(R2=0.997)
滇黄精多糖的HPGPC谱图如图10所示,经回归方程计算,滇黄精多糖Mw为35.95 kD,Mn为25.53 kD。首先需进行PDI值(即Mw/Mn)的试验测定,若该指标较大,说明分子量有较大的分布范围,反之亦然。滇黄精多糖的PDI值为1.41,该值较小,说明动态超高压微射流提取的滇黄精多糖较均一。
2. 5 滇黄精多糖的单糖组成
图11为PMP-HPLC法检测滇黄精多糖的单糖出峰谱,可知滇黄精多糖由11种单糖组成,单糖中含有葡萄糖醛酸和半乳糖醛酸,说明多糖为酸性多糖。11种单糖的摩尔比分别为:甘露糖(43.32%)、半乳糖(20.04%)、葡萄糖(19.87%)、阿拉伯糖(8.67%)、木糖(2.21%)、氨基半乳糖(2.12%)、岩藻糖(1.11%)、氨基葡萄糖(0.95%)、鼠李糖(0.91%)、葡萄糖醛酸(0.52%)和半乳糖醛酸(0.29%)。滇黄精多糖以甘露糖、半乳糖和葡萄糖为主,摩尔比占83.23%,氨基半乳糖、岩藻糖、葡萄糖醛酸和半乳糖醛酸的含量较低。
2. 6 滇黄精多糖的红外光谱分析结果
图12为滇黄精多糖红外光谱图,其中存在着糖类化合物的典型特征吸收峰。3600~3200 cm-1所对应宽峰为-OH伸缩振动吸收峰,是典型的糖类特征峰。具体结果为:在3376.75 cm-1的宽吸收峰是一种典型的糖类特征峰,为糖分子当中O-H伸缩振动吸收峰;在2927.41 cm-1处的吸收峰归属于C-H伸缩振动(CH、CH2和CH3);在1644.98 cm-1处的较强吸收峰可能归属于多糖中-OH的弯曲振动;在1421.28和1132.01 cm-1的吸收峰归属于C-O伸缩振动;在1328.71和1261.22 cm-1的吸收峰归属于O-H变角振动,929.25 cm-1处的吸收峰对应于吡喃环非对称环伸缩振动,由此可知滇黄精多糖属于含吡喃环的多糖。
2. 7 滇黄精多糖的DPPH自由基清除能力
从图13可看出,滇黄精多糖具有一定的清除DPPH自由基能力,其质量浓度与DPPH自由基清除率呈正向量效关系。经计算,滇黄精多糖对DPPH自由基的半抑制质量浓度(IC50)为0.43 mg/mL,高于Vc的IC50(0.056 mg/mL),说明虽然滇黄精多糖有较强的DPPH自由基清除能力,但清除能力远弱于Vc。
2. 8 滇黄精多糖的α-葡萄糖苷酶抑制活性
滇黄精多糖具有较强的降血糖活性(刘娜,2017),其α-葡萄糖苷酶抑制活性如图14所示,经计算,滇黄精多糖对α-葡萄糖苷酶的IC50为4.07 mg/mL,高于阿卡波糖对α-葡萄糖苷酶的IC50(0.83 mg/mL),说明滇黄精多糖虽具有较强的α-葡萄糖苷酶抑制活性,但其活性远低于阿卡波糖。
2. 9 滇黄精多糖的酪氨酸酶抑制活性
酪氨酸酶(EC1.14.18.1,TYR)是一种活性中心含有Cu2+的多功能氧化酶(Muhammad et al.,2019),被广泛用于评价美白功能。图15显示滇黄精多糖的酪氨酸酶抑制活性,进行计算分析后,可得滇黄精多糖对酪氨酸酶的IC50为2.87 mg/mL,高于熊果苷的IC50(0.13 mg/mL),说明滇黄精多糖虽具有较强的酪氨酸酶抑制活性,但其抑制活性低于熊果苷。
3 讨论
植物多糖是由10个以上单糖通过糖苷键聚合而成的生物大分子,因其多样的功能活性备受关注。植物多糖的提取主要有破碎细胞壁和多糖提取2个关键步骤。植物细胞壁主要由果胶、纤维素和半纤维素组成,起到维持细胞内稳定环境的作用。破壁处理是从胞浆中释放多糖的关键点,不同的破壁方法决定不同的提取方法,如高温、酸碱、酶解、物理辅助破壁(超声、微波、高压等)(王如涛等,2013)。热水浸提多糖具有安全环保、操作简单的优点,但得率低、耗时耗能,热水浸提黄精多糖得率在7%~12%(陈钢等,2007;郭未艳等,2013;宫江宁等,2019;张梓原等,2020)。酸碱提取法相较于传统的热水浸提法虽然得率有所提高,但提取时间并未缩短且易降低活性(王艺涵等,2019)。酶解提取法具有高效、温和的优点,但存在过滤困难等问题(Lee et al.,2016)。目前物理破碎法提取黄精多糖以超声波法和微波法为主,具有提取时间短、得率高等优点。微波或离子液体—微波辅助提取黄精多糖,在微波功率280~320W的条件下提取2~3 min,得率即达4.83%~12.79%(粟敏等,2016;于伟凯等,2020)。超声辅助酶法提取黄精多糖,在65 ℃下提取55 min,得率高达25.63%(刘日斌等,2021)。可见破壁处理辅助提取技术可极大提高提取效率。
动态超高压微射流又称微射流均质、瞬时高压作用、高压均质,是一种从高压均质工业应用中开发出来的新型技術,其充分结合了一系列的单元操作,包括膨化、加温、加压、粉碎、混合以及输送等,在食品和制药领域用于生产体系稳定的乳液,近年来逐渐应用于活性成分提取和改性。本研究利用动态超高压微射流预处理滇黄精混悬液,该技术通过强烈剪切和高速撞击等作用,确保滇黄精颗粒能充分地分散于水中,同时有利于细胞壁发生有效破碎,提高细胞通透性,使得溶剂能顺利地进入细胞中,促进多糖得率的提升;此外,瞬时压力作用有利于传质过程的发生,使得溶剂能迅速地渗透细胞壁,有利于多糖快速地溶出,显著地缩短提取时间(涂宗财等,2010;李亚楠等,2015;Huang et al.,2018)。在微射流压力146 MPa、料液比1∶41、100 ℃的条件下提取70 min,滇黄精多糖得率可达19.57%。与传统的热水浸提、酸碱法提取、酶解提取法相比,采用动态超高压微射流获得的多糖得率提升约一倍,浸提时间从3~8 h缩短至70 min,在提取效率和得率方面表现出巨大优势。与超声波辅助和微波辅助提取方法相比,本研究经动态超高压微射流提取的得率高于微波辅助提取得率(4.83%~12.79%)(粟敏等,2016;于伟凯等,2020),低于超声波辅助提取得率(25.63%)(刘日斌等,2021),可能与滇黄精的品种和产地不同有关,也可能与操作和计算方法有关。
多糖的生理功能与其组成结构密不可分,有学者对滇黄精多糖的结构和功能进行了研究。吴群绒等(2005)采用热水提取、柱层析分离纯化得到滇黄精多糖,证明其结构为主要由葡萄糖组成、相对分子质量约为8.1 kD的中性多糖;王艺(2019)研究结果显示滇黄精多糖的分子质量为160 kD,是含有吡喃糖苷键的酸性多糖,具有降低餐后血糖、调节体内血糖代谢的作用,但无抗氧化活性;施扬等(2020)制备的滇黄精提取物有着良好的酪氨酸酶抑制活性及较强的抗氧化能力,且无细胞毒性,在日化产品中具有重要的应用价值。本研究采用动态超高压微射流辅助提取滇黄精多糖,经分析,该多糖是由11种单糖组成的吡喃型酸性多糖,相对分子质量为35.95 kD,与吴群绒等(2005)、王艺(2019)经热水提取的多糖相比,分子质量较大,单糖组成丰富,且具有较强的生理活性。采用该技术进行提取后,既可促进提取得率的提高,同时对于结构改性方面也有积极作用,该技术能打断多糖长的分子链、改变分子聚集状态以及降低微粒粒度,导致多糖结构出现一定的变化,最终影响其生物活性与物理化学性质,如提高多糖的抗氧化活性(Chen et al.,2012;Huang et al.,2018;刘梦培等,2021)。下一步将全面地分析动态超高压微射流技术对于滇黄精多糖功能活性与结构特点的影响机理。
4 结论
采用响应面优化动态超高压微射流法提取滇黄精多糖的工艺参数,得到最佳工艺参数为:微射流压力146 MPa、料液比1∶41、于100 ℃下提取时间70 min。利用响应面法建立的回归模型对滇黄精多糖提取具有良好的预测作用。提取获得的滇黄精多糖是由11种单糖组成的吡喃型酸性多糖,具有DPPH自由基清除能力、α-糖苷酶抑制活性和酪氨酸酶抑制活性,在健康产品和日化产品开发方面具有广阔的应用前景。
参考文献:
陈灿辉,江文韬,林彤,庄玮婧,郑宝东,李舒婷,郑亚凤. 2019. 竹笋多糖的提取、结构鉴定与生理功效研究进展[J]. 江苏农业学报,35(6):1513-1520. [Chen C H,Jiang W T,Lin T,Zhuang W J,Zheng B D,Li S T,Zheng Y F. 2019. Progress in extraction,structural characterization and biological activities of bamboo shoot polysaccharide[J]. Jiangsu Journal of Agricultural Sciences,35(6):1513-1520.] doi:10.3969/j.issn.1000-4440.2019.06.034.
陳钢,陈红兰,苏伟,张桂芝. 2007. 响应面分析法优化黄精多糖提取工艺参数[J]. 食品科学,28(7):198-201. [Chen G,Chen H L,Su W,Zhang G Z. 2007. Optimization of extraction technique of Polyonatic sibiricum by response surface analysis[J]. Food Science,28(7):198-201.] doi:10.3321/j.issn:1002-6630.2007.07.044.
范斌,罗娟梅,张鸿伟,张晓梅,王莉,安子哲,卢海燕,赵雪. 2021. 钝顶螺旋藻多糖的分离纯化及组成分析[J/OL]. 食品科学. https://kns.cnki.net/kcms/detail/11.2206.TS. 20210205.1511.016.html. [Fan B,Luo J M,Zhang H W,Zhang X M,Wang L,An Z Z,Lu H Y,Zhao X. 2021. Isolation,purification and composition analysis of polysaccharide from Spirulina platensis[J/OL]. Food Science. https://kns.cnki.net/kcms/detail/11.2206.TS.20210205. 1511.
016.html.]
宫江宁,云成悦,吴婕,顾曼琦,廖莉玲. 2019. 黄精多糖的提取优化及抗氧化活性研究[J]. 贵州师范大学学报(自然科学版),37(3):18-23. [Gong J N,Yun C Y,Wu J,Gu M Q,Liao L L. 2019. Extraction optimization and antioxidant activity of polysaccharides from Polyonatic sibiricum[J]. Journal of Guizhou Normal University(Natural Scien-ces),37(3):18-23.] doi:10.16614/j.gznuj.zrb.2019.03.004.
郭未艳,孙秋燕,徐晓红,何国瑞,赵志敏,杨得坡. 2013. 滇黄精多糖提取的工艺组合及其优化[J]. 时珍国医国药,24(6):1391-1393. [Guo W Y,Sun Q Y,Xu X H,He G R,Zhao Z M,Yang D P. 2013. The extraction technology of polysaccharide from Polygonatum kingiamum Coll.et Hemsl and its optimization[J]. Lishizhen Medicine and Materia Medica Research,24(6):1391-1393.] doi:10. 3969/j.issn.1008-0805.2013.06.044.
国家药典委员会. 2015. 中华人民共和国药典[M]. 北京:化学工业出版社:215. [National Pharmacopoeia Commission. 2015. Pharmacopoeia of Peoples Republic of China[M]. Beijing:Chemical Industry Press:215.]
何雪梅,孙健,李丽,李昌宝,叶文才,董怡. 2014. 響应面法优化蔗梢多糖超声波提取工艺[J]. 南方农业学报,45(3):458-462. [He X M,Sun J,Li L,Li C B,Ye W C,Dong Y. 2014. Optimization on ultrasonic extraction of polysacchrides from sugarcane(Saccharum officinarum L.) tops by response surface analysis[J]. Journal of Southern Agriculture,45(3):458-462.] doi:10.3969/j.issn.2095-1191. 2014.3.458.
衡银雪,刘丹丹,边凤霞,殷钟意,郑旭煦. 2017. 黄精多糖抗衰老作用及其食品应用研究进展[J]. 重庆工商大学学报(自然科学版),34(6):119-125. [Heng Y M,Liu D D,Bian F X,Yin Z Y,Zheng X X. 2017. The progress on mechanism of anti-aging effect of polygonatum polysaccharide and its application in food[J]. Journal of Chong-qing Technology Business University(Natural Sciences Edition),34(6):119-125.] doi:10.160555j.issn.1672-1058X.2017.0005.015.
姜颖,涂宗财,陈媛,王强,李志,尹月斌. 2010. 动态超高压微射流预处理对香菇多糖得率的影响[J]. 食品科学,31(24):62-65. [Jiang Y,Tu Z C,Chen Y,Wang Q,Li Z,Yin Y B. 2010. Effect of dynamic high-pressure microfluidization pretreatment on the yield of Lentinan[J]. Food Scien-ce,31(24):62-65.]
李亚楠,刘红芝,刘丽,石爱民,王强. 2015. 动态高压微射流处理过程对多糖结构与理化性质的影响研究进展[J]. 食品科学,36(7):211-215. [Li Y N,Liu H Z,Liu L,Shi A M,Wang Q. 2015. A review on the effect of dynamic high-pressure microfluidization treatment on physico-che-mical properties and structures of polysaccharides[J]. Food Science,36(7):211-215.] doi:10.7506/spkx1002-6630-201507039.
刘梦培,李佳,纵伟,杜红岩,秦芳,王璐. 2021. 动态高压微射流对杜仲雄花多糖抗氧化能力的影响[J]. 食品科技,46(2):169-174. [Liu M P,Li J,Zong W,Du H Y,Qin F,Wang L. 2021. Effects of dynamic high pressure microfluidization on antioxidant capacity of polysaccharide of Eucommia ulmoides male flower[J]. Food Science and Technology,46(2):169-174.] doi: 10.13684/j.cnki.spkj. 2021.02.027.
刘娜. 2017. 黄精多糖的分离、鉴定及免疫调节功效研究[D]. 济南:山东大学. [Liu N. 2017. Isolation,identification and study on the immunomodulatory effect of polysaccharides from Polyonatic sibiricum[D]. Jinan:Shandong University.]
刘日斌,张宇鹏,马崇坚,陈晓远,叶俊. 2021. 超声波辅助酶法优化黄精多糖提取工艺的研究[J]. 食品研究与开发,42(7):141-146. [Liu R B,Zhang Y P,Ma C J,Chen X Y,Ye J. 2021. Ultrasonic-assisted enzymatic optimization of extraction process of polysaccharides from Polygonatum sibiricum[J]. Food Research and Development,42(7):141-146.] doi:10.12161/j.issn.1005-6521.2021.07. 022.
秦令祥,周婧琦,崔胜文,罗双群,高愿军. 2019. 动态超高压微射流法提取黑木耳多糖工艺研究[J]. 食品研究与开发,40(19):155-159. [Qin L X,Zhou J Q,Cui S W,Luo S Q,Gao Y J. 2019. Study on extraction of polysauharides from Auricularia auricular by dynamic high-pressure microfluidization technology[J]. Food Research and Deve-lopment,40(19):155-159.] doi:10.12161/j.issn.1005-6521.2019.19.028.
施吉祥,徐希明,余江南. 2019. 黄精多糖提取工艺、结构及药理活性研究进展[J]. 中国野生植物资源,38(2):36-42. [Shi J X,Xu X M,Yu J N. 2019. Review:Extraction method,structural identification and pharmacological activity of Polygonatum sibiricum polysaccharide[J]. Chinese Wild Plant Resources,38(2):36-42.] doi:10.3969/j.issn.1006-9690.2019.02.008.
施扬,王力川,马占林,周戟,陈军文,赵明. 2020. 滇黄精提取物成分与活性测定及细胞毒性评价[J]. 日用化学工业,50(11):788-792. [Shi Y,Wang L C,Ma Z L,Zhou J,Chen J W,Zhao M. 2020. Determination of components and activity of extractions of Polygonatum kingianum and evaluation of its cytotoxicity[J]. China Surfactant Detergent & Cosmetics,50(11):788-792.] doi:10.3969/j.issn. 1001-1803.2020.11.009.
粟敏,陳琳,龙昱,黄春霞. 2016. 离子液体—微波辅助提取多花黄精多糖工艺研究[J]. 中药材,39(9):2075-2077. [Su M,Chen L,Long Y,Huang C X. 2016. Study on the extraction of polysaccharide from Polygonum polyflorum by ionic liquid-microwave assisted extraction[J]. Journal of Chinese Medicinal Materials,39(9):2075-2077.] doi:10.13863/j.issn1001-4454.2016.09.036.
唐兰芳,王锋,苏小军,李清明,郭红英,孙毅中,孙翟翎. 2021. 低共熔溶剂提取对黄精多糖性质及抗氧化活性的影响[J]. 食品与发酵工业,47(11):151-157. [Tang L F,Wang F,Su X J,Li Q M,Guo H Y,Sun Y Z,Sun Z L. 2021. Effects of deep eutectic solvents on the properties and antioxidant activity of polysaccharides from Polygonatum cyrtonema Hua[J]. Food and Fermentation Industries,47(11):151-157.] doi:10.13995/j.cnki.11-1802/ts. 026440.
涂宗财,王艳敏,刘成梅,张雪春,刘玮. 2010. 动态超高压微射流技术在玉米花粉多糖提取中的应用[J]. 食品工业科技,31(6):212-214. [Tu Z C,Wang Y M,Liu C M,Zhang X C,Liu W. 2010. Applications of dynamic high pressure micro- fluidization technology in maize pollen polysaccharides extraction[J]. Science and Technology of Food Industry,31(6):212-214.] doi:10.13386/j.issn1002-0306.2010.06.012.
王如涛,吴绵斌,林建平,杨立荣. 2013. 植物多糖分离提取技术的研究进展[J]. 中国生物工程杂志,33(7):118-123. [Wang R T,Wu M B,Lin J P,Yang L R. 2013. Recent advances in extraction and isolation of plant polysaccharides[J]. China Biotechnology,33(7):118-123.] doi:10. 13523/j.cb.20130718.
王艺. 2019. 黄精、滇黄精多糖的结构表征与降血糖活性分析[D]. 西安:陕西师范大学. [Wang Y. 2019. Structure characterization and hypoglycemic activity analysis of polysaccharides from Polygonatum sibiricum and Polygonatum kingianum Coll. et Hemsl.[D]. Xian: Shaanxi Normal University.]
王艺涵,吴琴,迟原龙,姚开,贾冬英. 2019. 酸碱法和酶法辅助提取银耳粗多糖的特性研究[J]. 食品科技,44(4):200-204. [Wang Y H,Wu Q,Chi Y L,Yao K,Jia D Y. 2019. Properties of crude polysaccharides extracted from Tremella fuciformis by acid,alkali and enzyme-assisted methods[J]. Food Science and Technology,44(4):200-204.] doi:10.13684/j.cnki.spkj.2019.04.037.
魏煒,李彦伟,刘凤霞,许晓飞,刘志军. 2019. 响应面法优化超高压提取黄精多糖工艺[J]. 精细化工,36(5):875-881. [Wei W,Li Y W,Liu F X,Xu X F,Liu Z J. 2019. Optimization of ultrahigh pressure extraction of polysaccharides from Polygonatum cyrtonema Hua by response surface methodology[J]. Fine Chemicals,36(5):875-881.] doi:10.13550/j.jxhg.20180756.
吴其国,胡叶青,范珍,陈慧芳,毛小明. 2018. 炮制对黄精化学成分的影响研究进展[J]. 包头医学院学报,34(1):128-129. [Wu Q G,Hu Y Q,Fan Z,Chen H F,Mao X M. 2018. Research progress on the effect of processing on chemical constituents of Polygonatum kingianum Coll.et Hemsl.[J]. Journal of Baotou Medical College,34(1):128-129.] doi:10.16833/j.cnki.jbmc.2018.01.059.
吴群绒,胡盛,杨光忠,梅之南. 2005. 滇黄精多糖I的分离纯化及结构研究[J]. 林产化学与工业,25(2):80-82. [Wu Q R,Hu S,Yang G Z,Mei Z N. 2005. Separation,purification and structure study of polysaccharide I form Polygonatum kingianum[J]. Chemistry and Industry of Forest Products,25(2):80-82.]
肖韵铮,韩世明,秦昭,李春奇. 2020. 滇黄精转录组测序及类黄酮合成相关基因的分析[J]. 河南农业大学学报,54(6):931-940. [Xiao Y Z,Han S M,Qin Z,Li C Q. 2020. Analysis of transcriptome sequencing and related genes of flavonoids biosynthesis from Polygonatum kingianum[J]. Journal of Henan Agricultural University,54(6):931-940.] doi:10.16445/j.cnki.1000-2340.2020.06.004.
叶兴乾,周声怡,姚舒婷,吴文艳,陈士国. 2020. 枸杞多糖的提取方式、结构及生物活性研究进展[J]. 食品与发酵工业,46(6):292-300. [Ye X Q,Zhou S Y,Yao S T,Wu W Y,Chen S G. 2020. Research progress on extraction methods,structures and bioactivities of Goji(Lycium barbarum) polysaccharides[J]. Food and Fermentation Industries,46(6):292-300.] doi:10.13995/j.cnki.11-1802/ts.022778.
于伟凯,孔维楷,郝斯璐,刘晓阳,刘冰,刘宇飞,孟超. 2020. 泰山黄精多糖提取工艺改进及抑菌作用[J]. 泰山医学院学报,41(11):830-833. [Yu W K,Kong W K,Hao S L,Liu X Y,Liu B,Liu Y F,Meng C. 2020. Improvement of extraction technology and antimicrobial effect of polysaccharide from Polygonatum sibiricum[J]. Journal of Taishan Medical College,41(11):830-833.] doi:10.3969/j.issn.1004-7115.2020.11.007.
张梓原,徐伟,王鑫,贾旭. 2020. 黄精多糖的提取工艺对比研究[J]. 包装工程,41(9):51-58. [Zhang Z Y,Xu W,Wang X,Jia X. 2020. Comparative study on extraction techno-logies of polysaccharides from Rhizoma plygonatum[J]. Packaging Engineering,41(9):51-58.] doi:10.19554/j.cnki.1001-3563.2020.09.008.
赵瑞萌,孙庭阁,张玲. 2010. 碱法提取黄精多糖及提取工艺流程的优化[J]. 泰山医学院学报,31(1):45-47. [Zhao R M,Sun T G,Zhang L. 2010. Extracting polysaccharides from polygonatum with alkaline and optimizing of the extracting flow-sheet[J]. Journal of Taishan Medical College,31(1):45-47.] doi:10.3969/j.issn.1004-7115.2010. 01.014.
Broxterman S E,Schols H A. 2018. Interactions between pectin and cellulose in primary plant cell walls[J]. Carbohydrate Polymers,192:263-272. doi:10.1016/j.carbpol.2018. 03.070.
Chen J,Liang R H,Wei L,Liu C M,Li T,Tu Z C,Wan J. 2012. Degradation of high-methoxyl pectin by dynamic high pressure micro?uidization and its mechanism[J]. Food Hydrocolloids,28(1):121-129. doi:10.1016/j.foodhyd.2011.12.018.
Debnath T,Park S R,Kim D H,Jo J E,Lim B O. 2013. Antioxidant and anti-inflammatory activity of Polygonatum sibiricum rhizome extracts[J]. Asian Pacific Journal of Tropical Disease,3(4):308-313. doi:10.1016/S2222-1808(13)60074-2.
Huang L X,Shen M Y,Zhang X W,Jiang L,Song Q Q,Xie J H. 2018. Effect of high-pressure microfluidization treatment on the physicochemical properties and antioxidant activities of polysaccharide from Mesona chinensis Benth[J]. Carbohydrate polymers,200:191-199. doi:10.1016/j.carbpol.2018.07.087.
Lee K H,Park H S,Yoon I J,Shin Y B,Baik Y C,Kooh D H,Kim S K,Jung H K,Sim M O,Woo C H,Jung W S,Kim M S. 2016. Whitening and anti-wrinkle effects of Tremella fuciformis Eextracts[J]. Korean Journal of Medicinal Crop Science,24(1):38-46. doi:10.7783/KJMCS. 2016.24.1.38.
Li L,Thakur K,Liao B Y,Zhang J G,Wei Z J. 2018. Antioxidant and antimicrobial potential of polysaccharides sequentially extracted from Polygonatum cyrtonema Hua[J]. International Journal of Biological Macromolecules,114:317-323. doi:10.1016/j.ijbiomac.2018.03.121.
Muhammad R,Yasir N,Zaman A,Hummera R,Samina A,Amara M,Mubashir H,Anse A,Khurram A,Muhammad R Y,Muhammad S,Katarzyna K M,Mariusz M. 2019. Synthesis,computational studies,tyrosinase inhibitory kinetics and antimelanogenic activity of hydroxy substitu-ted 2-[(4-acetylphenyl) amino]-2-oxoethyl derivatives[J]. Journal of Enzyme Inhibition and Medicinal Chemistry,34(1):1-11. doi:10.1080/14756366.2019.1654468.
Tang C,Yu Y M,Guo P,Huo J Y,Tang S G. 2019. Chemical constituents of Polygonatum sibiricum[J]. Chemistry of Natural Compounds,55(2):331-333. doi:10.1007/s10600- 019-02681-z.
(責任编辑 罗 丽)
