三元体系Li+,NH4+∥SO42--H2O 298 K相平衡研究
2021-04-14程籽毅魏卓何智妍肖淑云王彦旭周堃
程籽毅, 魏卓, 何智妍, 肖淑云, 王彦旭, 周堃
成都理工大学 材料与化学化工学院,四川 成都 610059
0 前言
锂是重要的战略资源,广泛应用于化工、纺织、医药、制冷设备、核能发电等领域。近年来,电子材料和新能源等高新技术产业兴起,“能源金属”[1]锂的关注度也不断提升。根据美国地质调查局(USGS)数据显示,2012年我国锂资源的消费量为5.5万t,而在2018年我国锂资源消费量达到了16.9万t,年均增长率达到20.6%[2],预计2025年增长率维持在15%~25%之间。锂资源消费和需求量呈现大幅持续增长主要体现在新能源电池和医药行业[3]。中国目前锂资源主要来源为盐湖卤水(68%)、锂辉石(30%)、锂云母(2%),其中液态锂资源主要分布于青海和西藏盐湖,硬质锂资源主要分布于四川和新疆地区[4]。
四川省锂资源主要是以锂辉石矿形式存在,且占全国锂矿石资源的57%,主要分布在马尔康市(14.8万t)、金川县(13.3万t)、道孚县(1.8万t)、雅江县(0.1万t)、康定市(106.2万t),共136.2万t(以Li2O计)[5]。2011年1月,针对四川省如此丰富的矿石锂资源,四川省委经济工作会议提出,应当站在战略资源产业发展的高度,尽快规划发展四川省锂产业。矿石锂资源的综合利用便显得尤为重要。
目前锂矿石提锂的主流工艺为硫酸法,锂矿石经转型焙烧和硫酸化焙烧后浸出,再加入石灰调整pH至中性,便可除去其中大量的杂质金属离子,再加入碳酸钠进一步除Ca2+和Mg2+,既可得到较为纯净的锂溶液,而后蒸发浓缩,得到的浓缩液再加入Na2CO3,将Li2SO4转化为Li2CO3。碳酸锂以细小但是易于沉淀的白色晶体沉淀出来,经过反复洗涤、真空干燥即可得到碳酸锂成品[6,7]。
为了提高四川锂矿综合利用效率,在传统锂辉石制碳酸锂工艺的基础上进行优化,如主流硫酸法采用氢氧化钠中和法除去铁、铝等杂质,但是副产硫酸钠附加值较低,导致生产成本较高,本论文研究以氨气替代强氧化钠中和法除杂制碳酸锂工艺,此工艺中部分氨气可以循环使用,节约了生产成本。但此种工艺在浓缩和精制锂溶液沉淀结晶过程中存在LiNH4SO4复盐产生,使溶液中锂浓度降低或使产品碳酸锂中夹带硫酸铵锂复盐导致纯度不高,影响了锂的收率和碳酸锂产品品质。基于以此种工艺体系中所存在的问题,亟需对Li+,NH4+与SO42-三元体系在常温(25 ℃)下的相平衡进行研究,探究其硫酸铵锂的复盐结晶区,并通过相平衡的研究探寻一种最适宜的工艺流程从而避免在浓缩沉锂的过程中产生硫酸铵锂复盐对整个碳酸锂产品的收率以及纯度造成影响,为四川锂矿石资源的综合利用提供科学依据。
1 实验部分
1.1 实验试剂
实验所用去离子水为成都超越科技有限公司(CD-UPT-II-20L型)超纯水机,电导率<4.5 μS/cm,实验过程中均用此水,其余药品见表1。
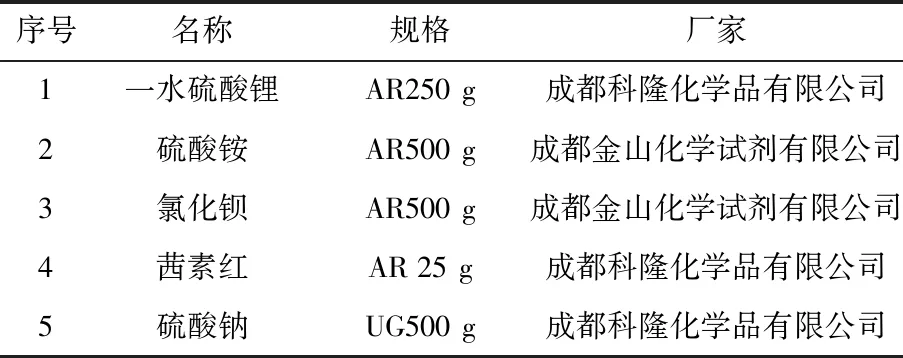
表1 实验试剂Table 1 Experimental reagents
1.2 实验仪器
实验主要使用仪器见表2。

表2 实验仪器Table 2 laboratory apparatus
1.3 实验方法
采用等温溶解平衡法[8,9]开展相平衡研究。具体做法是向二元体系的饱和盐溶液中梯度加入另一种盐配制溶液( 如向Li2SO4饱和液[10]中梯度加入(NH4)2SO4或向(NH4)2SO4饱和液[11]中梯度加入Li2SO4·H2O)于100 mL 蓝口瓶中。所配溶液置于恒温振荡器中振荡(温度控制在298±0.5 K)。定期取上层清夜进行密度、折光率和组成分析(取样时应使体系静置至悬浮固体颗粒完全沉淀) ,以其密度、折光率和组成不变时作为平衡标志。确认体系达到平衡后,取上层清液进行化学成分分析,同时测定液相密度、折光率等物化性质,并取相应固相采用XRD和湿渣法进行固相分析。平衡液相密度采用称量瓶法测定,折光率用阿贝折射仪测定。
1.4 分析方法
Li+采用原子吸收光谱仪测定[10];SO42-采用茜素红—硫酸钡滴定法测定[12];NH4+采用差减法测量;平衡固相分析方法:X-ray射线衍射法和Schreinemakers湿渣法[13]。
2 结果与讨论
2.1 三元体系Li+, NH4+∥SO42--H2O 298 K稳定相平衡实验研究
三元体系Li+, NH4+∥SO42--H2O在298 K下等温溶解平衡时,其饱和溶液的液相组成、湿渣组成及其密度的相关相平衡数据如表3,该三元体系在298 K下的等温相图如图1。三元体系Li+, NH4+∥SO42--H2O在298 K下稳定相图有3个结晶区,3条单变量曲线和2个共饱点(C、D)。为确定图3中各结晶区的固相组成采用湿渣法,如在实验过程中对4C和11D两点湿渣进行取样,用乙醇洗涤多次、滤纸擦干后送检XRD分析两共饱点的固相组成,其XRD分析结果如图2、图3所示。为确定图1中各点的液相组成,采用分析液相中离子浓度来确定液相中两种盐的质量分数,如在实验过程中对4C和11D两点液相进行取样,取5mL液相清液定容于100 mL容量瓶中,将定容后液体稀释一定倍数后送检原子吸收测定Li+的摩尔浓度c1,再采用茜素红—硫酸钡滴定法测定SO42-的摩尔浓度c2,由于液相中只存在Li+、SO42-和NH4+,则NH4+的摩尔浓度c3可由液相中电荷守恒关系(c1+c3=2c2)计算得到,得到各离子浓度后则可计算在液相或固相中各组分的质量分数,如表3中所示。
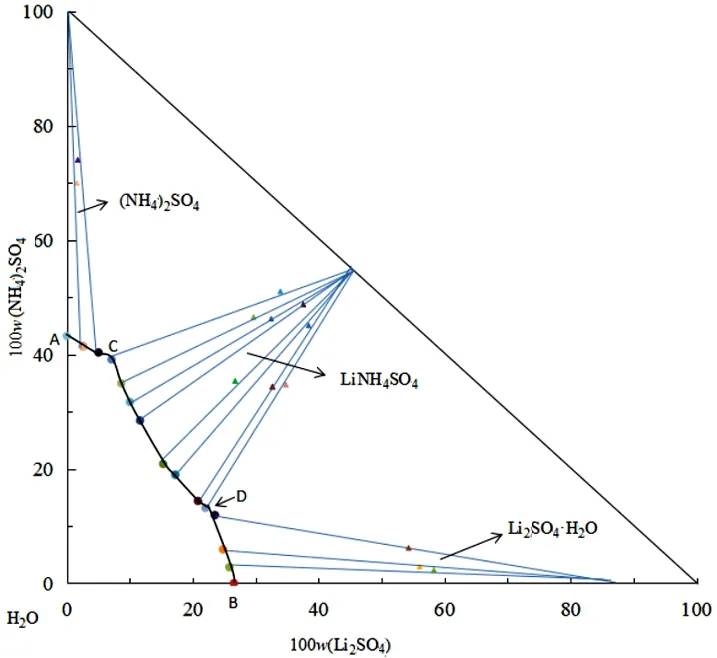
图1 三元体系Li+,NH4+∥SO42--H2O在298 K下相图Fig. 1 Phase diagram of ternary system Li+, NH4+∥SO42--H2O at 298 K
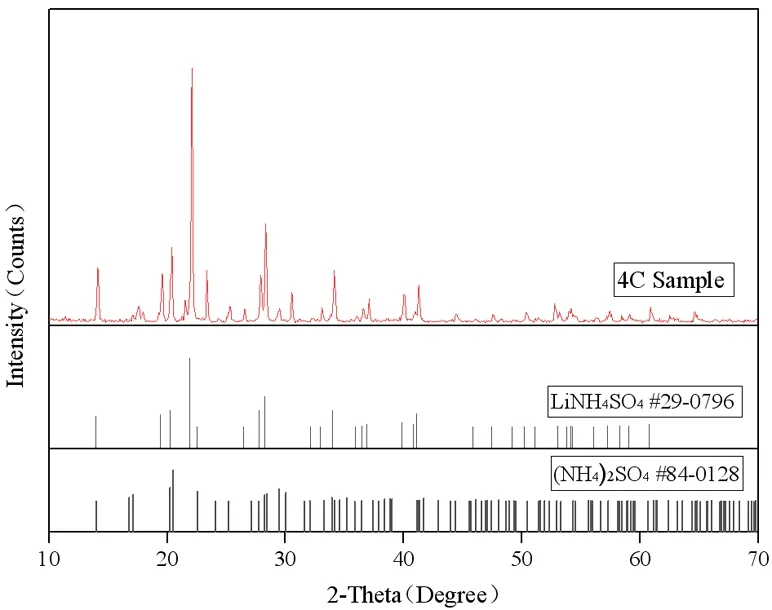
图2 共饱点C处平衡固相XRD谱图Fig. 2 XRD pattern of the invariant point C

图3 共饱点D处平衡固相XRD谱图Fig. 3 XRD pattern of the invariant point D

表3 三元体系Li+, NH4+∥SO42--H2O在298 K下溶解度、密度、折光率测定值Table 3 Expem values of solubility, density and refractive index of ternary system Li+, NH4+ ∥SO42--H2O at 298 K
共饱点C对应的平衡液相组成为w(Li2SO4)=7.12%,w[(NH4)2SO4]=39.11%,w(H2O)=53.77%;其平衡固相为(NH4)2SO4和LiNH4SO4。共饱点D对应的平衡液相组成为w(Li2SO4)=22.02%,w((NH4)2SO4)=13.17%,w(H2O)=64.81%;其平衡固相为Li2SO4·H2O和LiNH4SO4。单变量曲线AC,CD,DB对应的平衡固相分别为(NH4)2SO4,Li2SO4·H2O和LiNH4SO4,其中复盐LiNH4SO4的结晶区最大,对应复盐LiNH4SO4溶解度最小,(NH4)2SO4的结晶区最小,对应(NH4)2SO4的溶解度最大。由此三元体系相图可见,在(NH4)2SO4质量分数一定时,Li2SO4质量分数越大越容易进入复盐LiNH4SO4的结晶区,而在实际的工艺流程中为保证锂浸出液中沉锂的收率会在沉锂前对其进行浓缩,则Li2SO4质量分数会逐渐升高,而此时(NH4)2SO4的质量分数也会逐渐升高,使得在浓缩过程中更容易进入复盐结晶区从而形成了复盐LiNH4SO4。通过此复杂三元体系的相平衡研究,为使得在浓缩、沉锂过程中不形成复盐LiNH4SO4的同时还能达到沉锂时锂浓度的要求,则要通过控制(NH4)2SO4,Li2SO4·H2O其中一种盐的质量分数,因为沉锂过程中Li2SO4为主要成分,则选择控制(NH4)2SO4的质量分数。以11D点为例,在此点的Li2SO4的质量分数已经达到了沉锂溶液中锂浓度的要求,在氨中和除杂之前采用钙离子沉淀法将锂溶液中锂硫比([w(Li2SO4·H2O)/w(NH4)2SO4)]降到1.6以下,就可使得沉锂溶液始终保持在液相区而不进入复盐LiNH4SO4结晶区,从而解决了在此工艺中形成复盐LiNH4SO4导致碳酸锂纯度、收率不高的问题。
2.2 平衡液相物化性质研究
由表3中的数据绘制了该三元体系298K下平衡液相密度-组成图和折光率-组成图,分别如下图4、图5所示。图4平衡液相密度-组成图中各点液相密度是由对各点进行取样5 mL样时,同时对此5 mL样品进行称量,质量与体积之比则为此液相点密度;图5平衡液相折光率-组成图中各点折光率数据是待液相达到平衡后对各点液相间隔3 h取样,3次折光率误差不超过0.000 1则为次液相点折光率数据。

图4 三元体系Li+, NH4+∥SO42--H2O在298 K下平衡液相-密度组成图Fig. 4 The ternary system Li+, NH4+//SO42--H2O equilibrium liquid phase-density composition diagram at 298K

图5 三元体系Li+, NH4+//SO42--H2O在298K下平衡液相-折光率组成图Fig. 5 The ternary system Li+,NH4+//SO42--H2O equilibrium liquid phase-refractive index composition diagram at 298K
在图4平衡液相密度-组成图中和图7平衡液相折光率-组成图中,在AC段中平衡液相的密度和折光率随着w(Li2SO4)逐渐增大而增大;CD段平衡液相密度随着w(Li2SO4)逐渐增大而缓慢减小且减小速率变慢,折光率随着w(Li2SO4)逐渐增大而减小;DB段密度和折光率均随着w(Li2SO4)逐渐增大而减小,由此可见密度、折光率随平衡液相中w(Li2SO4)变化趋势基本相同,其单变量曲线呈现规律性变化。
3 结论
(1)本实验测定了三元体系Li+, NH4+∥SO42--H2O在298 K下相平衡数据并绘制了相图,得出该三元体系为复杂三元体系,且有复盐生成。整个相图有3个结晶区,3条单变量曲线和2个共饱点。
(2)3个结晶区分别为(NH4)2SO4,Li2SO4·H2O和复盐LiNH4SO4,其中复盐LiNH4SO4的结晶区最大,溶解度最小;(NH4)2SO4结晶区最小溶解度最大;由此可见在含有锂离子和铵根离子的体系中更容易结晶析出复盐LiNH4SO4。
(3)该实验结果填补了Li+, NH4+∥SO42--H2O三元体系相图数据的空白,由此相平衡数据和相图,可以指导锂辉石湿法冶金工艺中采用氨中和除杂技术和碳酸铵纯化技术中出现的一些问题。
例如,在锂浸出液中硫酸锂含量一定的情况下,随着浓缩时浸出液中(NH4)2SO4的浓度增高,则易析出复盐LiNH4SO4,此时通过控制含锂溶液中锂硫比[w(Li2SO4·H2O)/w((NH4)2SO4)]小于1.6就可使其在浓缩和碳化沉锂的阶段不形成复盐LiNH4SO4,从而提高了产品收率和质量,为此类工艺提供了科学的指导。
