法氏囊活性肽BP7调节鸡未成熟B细胞的基因表达谱及功能分析
2021-04-13李彤彤张则陈佳静李陈飞卢安然周广防冯秀丽
李彤彤,张则,陈佳静,李陈飞,卢安然,周广防,冯秀丽
( 南京农业大学动物医学院/农业部动物细菌学重点实验室/教育部动物健康与食品安全国际合作联合实验室,江苏 南京 210095)
众所周知,法氏囊(bursa of fabricius,BF)是公认的鸟类特有的中枢体液免疫器官,为研究人类及哺乳动物的中枢体液器官功能机制、疫苗开发等提供了理想的研究模型[1-3]。早在1956年,手术切除新生雏鸡的法氏囊损害了该鸡只对鼠伤寒沙门菌O型抗原2的抗体反应,就证实了法氏囊是鸟类B淋巴细胞生成的关键部位[1-3]。科研人员对法氏囊功能机制研究发现,与人或小鼠模型相比,鸟类B细胞的发育具有一些独特的特性。据报道B细胞的发育经历了3个不同的阶段,即法氏囊前、法氏囊和法氏囊后,这3个阶段在B细胞发育中所起的作用有根本的不同[4-5]。B细胞分化和抗体多样化伴随着生物活性分子的调节和免疫诱导的激活[3,6]。法氏囊源的活性分子对B细胞及抗体的影响是科研人员非常关注的话题。囊素三肽(Lys-His-Gly-NH2)是最早报道的来源于BF的活性分子,可促进B细胞的分化[7],可选择性诱导鸡B细胞分化,促进免疫球蛋白(immunoglobulin,Ig)从IgM向IgG的转变[8]。法氏囊来源的法氏囊五肽Ⅱ(bursal pentapeptide,BPP-Ⅱ),调节了禽前B淋巴细胞DT40参与同源重组的各种基因表达,增强了鸡免疫抗体的产生[9]。而且,BPP-Ⅱ能够调节涉及多种途径和免疫相关的生物学过程的杂交瘤细胞中多个基因的差异表达[10]。这些结果揭示了法氏囊源活性多肽调节抗体反应及B细胞功能的机制,不过法氏囊源活性肽调节未成熟B细胞的功能及分子基础还有待于进一步探索。
法氏囊活性肽BP7是近期报道的一种来源于法氏囊、促进抗体反应及B细胞自噬的一种活性七肽[11]。为了研究法氏囊源性肽对鸡未成熟B细胞的调节作用,本研究采用基因芯片,对BP7处理后DT40细胞的基因表达谱进行了筛选,并应用富集途径和功能分类分析方法,对禽未成熟B细胞系DT40细胞中差异表达的基因及生物学功能进行分析,从而为未成熟B细胞的分化发育提供重要的参考信息。
1 材料与方法
1.1 法氏囊活性肽和细胞系
BP7由南京金斯瑞科技公司合成,纯度为95%以上。
DT40细胞由本实验室保存,采用含有10%胎牛血清和5%鸡血清的1640培养基于37 ℃、5% CO2培养箱中进行培养。
1.2 DT40细胞的培养及检测
将生长状态良好的DT40细胞分装到6孔细胞培养板中,培养12 h后,将2 μg/mL、0.2 μg/mL、0.02 μg/mL 3个剂量的BP7加入到6孔细胞板中,继续培养4 h,同时设计PBS和0.02 μg/mL BSA分别作为对照。收获全细胞,加入TRIzol试剂提取总RNAs,设计DT40细胞的IgM引物序列,Primer-F-GTCAAAGGAGGAGCTGAACG和Primer-R-TGTGTGTGACCCTGCAGGTG,采用一步法定量PCR试剂盒检测IgM的mRNA水平。
1.3 基因芯片分析
将生长状态良好的DT40细胞分装到T25细胞培养瓶中,然后用0.02 μg/mL BP7加入到细胞瓶中,继续培养4 h,收获全细胞,加入TRIzol试剂提取总RNAs,由北京博奥公司完成基因表达谱分析。试验步骤为:采用TRIzol (Invitrogen,Gaithersburg,MD,USA)提取细胞中的总 RNA。并进一步采用 NucleoSpin®RNA清理试剂盒(MACHEREY-NAGEL,Germany)对总 RNA 进行过柱纯化及质检合格。
样品RNA的荧光标记及杂交,即采用晶芯®cRNA 扩增标记试剂盒进行样品RNA 荧光标记。基本步骤如下:以总RNA起始,反转录合成 cDNA的第一条链,然后用RNase H 将杂合链中的RNA 切成短片段,DNA 聚合酶 以RNA短片段为引物延伸,合成2nd-strand cDNA,并纯化双链cDNA。以cDNA 为模板,体外转录合成 cRNA;然后用CbcScriptⅡ酶,随机引物反转录;最后cDNA用KLENOW酶标记。标记的DNA溶于杂交液中(2倍GEx Hyb Buffer,HI-RPM,25%甲酰胺),于45 ℃杂交过夜。杂交结束后,先在42 ℃左右含0.2%十二熔基硫酸钠(SDS),2倍柠檬酸钠缓冲液(SSC)的液体中洗5 min,而后在0.2倍SSC中室温洗5 min。玻片甩干后即可用于扫描。
芯片用安捷伦芯片扫描仪进行扫描,得到杂交图片。采用特征提取图像分析软件对芯片图像进行分析,把图像信号转化为数字信号,并采用GeneSpring GX软件对信号值进行归一化处理,然后用绝对变化倍数≥2进行差异基因筛选,并进一步开展差异表达基因的通路分析,即在GenMAPP和KEGG的系列通路中的分布情况。此外,基因本体论(Gene Ontology,GO)分析差异表达基因在GO体系中各亚型分类的情况。
1.4 靶基因的定量PCR(RT-qPCR)检测
用0.02 μg/mL BP7处理DT40细胞4 h,提取细胞总RNA,从芯片数据的差异表达的基因中,随机选择Ppara、Atg2a1、Rap1b、Fzr1、Fgf8、Gal13等6个差异表达基因,设计引物进行验证。特异引物序列如表1所示。
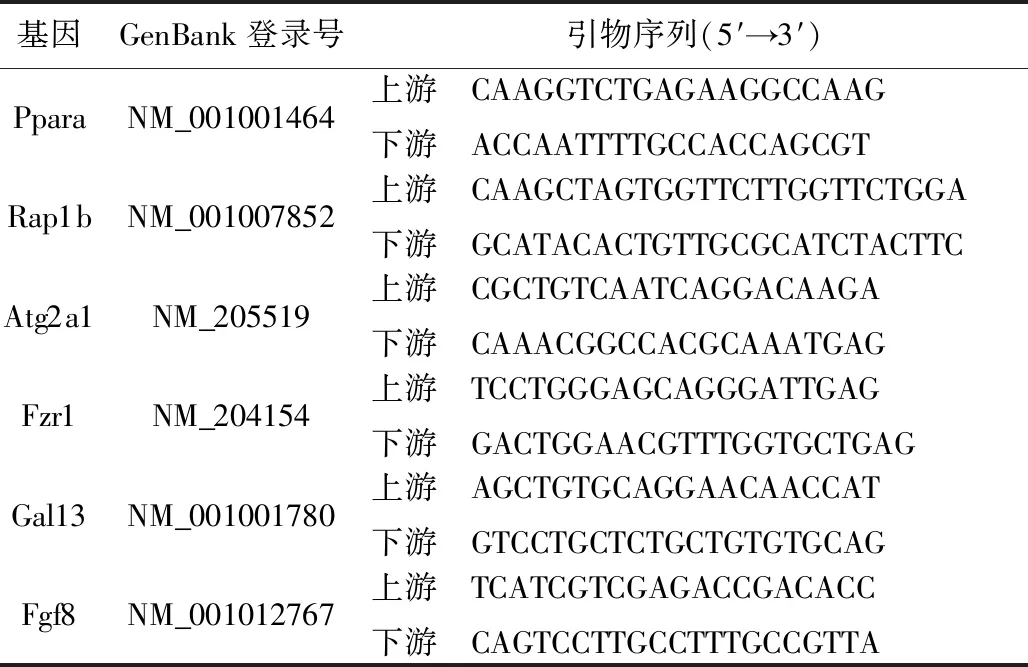
表1 选定基因的定量PCR引物
使用ABI 7300实时PCR系统(Applied Biosystems)进行RT-qPCR操作。GAPDH为内参基因,采用2-ΔΔCt法进行数据分析。
2 结果
2.1 BP7诱导鸡未成熟B细胞分泌IgM产生
以DT40细胞系为模型,BP7刺激后检测IgM水平,结果如图1所示。与PBS对照组相比,经0.02 μg/mL BP7刺激的DT40细胞组,产生的IgM mRNA水平明显升高(图1A),而0.2 μg/mL和2 μg/mL BP7刺激的DT40细胞组的IgM水平与PBS对照组相似,无显著差异。同时,0.02 μg/mL BP7刺激的DT40细胞组产生的IgM mRNA水平也明显高于0.02 μg/mL BSA对照组(图1B)。
2.2 BP7调节DT40细胞的基因表达谱
以DT40细胞为模型,采用基因芯片技术检测了0.02 μg/mL BP7刺激的DT40细胞的基因表达谱,结果如图2所示。热图分析显示了BP7处理后DT40细胞中的基因表达情况(图2A)。在规定的阈值下,与对照组相比,BP7处理的DT40细胞中有733个上调基因和612个下调基因(图2B),其中BP7处理的DT40细胞中大部分基因的调控倍数在1和-1 lg2比值之间(图2B)。
为了证实基因芯片的基因表达数据,采用qRT-PCR技术,从芯片数据中差异表达的基因中,随机检测了BP7处理DT40细胞的6个差异表达基因。与对照组相比,BP7处理后DT40细胞Ppara、Atg2a1和Rap1b基因表达上调,而Fzr1、Fgf8和Gal13基因表达下调。这些结果与BP7处理的DT40细胞的基因芯片数据分析一致(图2C)
2.3 BP7调节DT40细胞的通路分析
为了全面了解鸡未成熟B细胞的生物途径调控,利用GAGE分析工具,在KEGG数据库和PANTHER数据库中,对BP7处理的DT40细胞的差异基因所涉及的信号和代谢途径进行分析,结果如表2所示。BP7诱导DT40细胞的差异表达基因涉及17条通路,包括神经活性配体受体相互作用、ECM受体互作、细胞因子与细胞因子受体互作3个受体互作通路,以及胰岛素/IGF途径蛋白激酶B信号级联、泛素蛋白酶体途径、胰岛素/IGF途径丝裂原活化蛋白激酶/MAP激酶级联和Jak-STAT 信号通路4个信号通路。代谢和蛋白质分解相关的通路包括烟酸和烟酰胺代谢、泛素介导的蛋白质水解和黑色素生成3种。此外,其他细胞生物学功能相关的通路包括紧密连接、粘着、粘合连接、ABC转运子、血管平滑肌收缩、缝隙连接和吞噬体。此外,本文还对BP7刺激DT40细胞的差异基因涉及的通路进一步分析,其富集途径网络如图3所示。c细胞因子与细胞因子受体互作是BP7刺激后DT40细胞相关途径中的关键通路,与Jak-STAT信号通路、粘合连接和缝隙连接等通路密切相关。

A.基因表达谱热图;B.差异表达基因柱状图分析;C.差异基因验证图2 BP7调节DT40细胞的基因表达谱

表2 BP7刺激后DT40细胞中差异表达基因涉及的通路分析

续表2

图3 BP7刺激后DT40细胞中涉及的通路相互作用网络分析
2.4 BP7调节DT40细胞中GO功能分析
为进一步探讨BP7在未成熟B细胞生物学功能中的分子基础,根据GO数据库对BP7刺激的DT40细胞的差异表达基因进行了细胞组分、分子功能和生物学过程分析。图4总结了P值TOP30的显著富集项。BP7处理的DT40细胞中P值TOP30的GO项中,包括15个分子功能,8个生物过程和7个细胞成分。

图4 BP7刺激后DT40细胞差异表达基因涉及的GO功能分析(P值在TOP30以内)
为了证实免疫系统的分子特征,本文还分析了参与免疫相关功能过程的差异基因表达。如表3所示,在BP7处理的DT40细胞中,涉及的免疫相关GO项主要包括免疫应答、免疫应答信号、Th1型免疫应答、细胞因子的产生和调节及其受体活性等方面。

表3 BP7刺激后DT40细胞中差异表达基因涉及的免疫相关功能分析
3 讨论
法氏囊是目前公认的鸟类特有的中枢免疫器官,是B淋巴细胞分化成熟的关键部位。然而法氏囊源生物活性肽在未成熟B细胞发育中独特的分子基础和作用机制却鲜有报道。DT40细胞是来源于禽白血病病毒感染引起的法氏囊淋巴瘤细胞,是一种常见的、研究B细胞功能和机制的未成熟B细胞模型[12-13]。BP7是近期报道的一种法氏囊活性肽,能够促进明显的疫苗免疫反应,且诱导鼠源未成熟B细胞中多种信号通路,同时发现BP7促进鼠源未成熟B细胞自噬[11],然而其调控鸡B细胞的功能机制尚不清楚。
为了探讨BP7对鸡未成熟B细胞的作用机制,本研究中选择禽DT40细胞作为鸡未成熟B细胞模型。结果发现,0.02 μg/mL BP7能显著提高DT40细胞IgM的mRNA水平。高通量测序分析发现,BP7诱导DT40细胞中差异表达的基因涉及到胰岛素/IGF途径蛋白激酶B信号级联、泛素蛋白酶体途径、胰岛素/IGF途径丝裂原活化蛋白激酶/MAP激酶级联和Jak-STAT信号通路4个信号通路。胰岛素样生长因子受体的上游调节因子Klotho在CD19+B细胞中高表达,提示了胰岛素通路参与了B细胞相关的淋巴瘤的发展[14 ]。泛素化蛋白通路参与B细胞的介导的MHC-Ⅱ抗原递呈功能且与BCR功能相关[15]。据报道,MAP激酶级联和Jak-STAT信号通路也参与B细胞的生物过程[16-17]。这些结果提示,多种信号通路可能均参与B细胞的分化发育过程。为了进一步探索BP7调节的通路对B细胞的功能,本文中通路网络分析发现,细胞因子与细胞因子受体互作是BP7刺激DT40细胞的重要靶功能通路。据报道,抗原和细胞因子受体信号引导未成熟B细胞的发育[18]。本研究中,GO通路分析发现,BP7能够调节未成熟B细胞中细胞因子的产生及分泌。由此可以推测,上述信号通路与B细胞发育及分化成熟等生物学功能密切相关。
此外,差异表达的基因还参与了多种免疫相关的生物学过程,主要包括免疫应答、免疫应答信号、Th1型免疫应答、细胞因子的产生和调节及其受体活性等方面。未成熟B细胞的分化成熟是一个复杂的生物学过程,而且B细胞发育不仅是体液免疫反应的重要组成部分,也是先天性免疫及获得性免疫应答的重要组成部分[19-20]。抗原和细胞因子受体信号引导幼稚成熟B细胞的发育。未成熟B细胞到外周成熟B细胞池的阳性选择主要受强BCR信号调节,其次受BAFFR信号调节。这些信号促进了未成熟B细胞向过渡和成熟B细胞的分化,对成熟B细胞的存活起重要作用[21]。Th1免疫反应与B细胞分化及功能密切相关[22-23]。本研究结果显示,法氏囊活性肽BP7能够促进B细胞分泌IgM,揭示了其调节B细胞的分子基础,为研究B细胞的分化成熟及功能机制提供了重要的理论依据。
总之,本研究证实了法氏囊活性肽BP7能够诱导禽未成熟B细胞产生显著的IgM水平;生物信息学分析发现,BP7诱导鸡未成熟B细胞的差异表达基因参与了多种通路,其中细胞因子受体互作是其中的关键通路,而且涉及到多种免疫相关的生物学过程。研究结果为进一步研究法氏囊活性肽调控B细胞分化的分子机制奠定了基础。
