11S球蛋白通过核因子-κB、诱导型一氧化氮合酶、c-Jun N端激酶、p38丝裂原活化蛋白激酶信号通路诱导猪小肠上皮细胞损伤的研究
2021-04-13孙智峰彭成璐丁红研李思婷王承智王希春吴金节
王 蕾 孙智峰 彭成璐 丁红研 王 志 李思婷 王承智 李 玉 王希春 吴金节
(安徽农业大学动物科技学院,合肥230061)
大豆贮藏蛋白主要由球蛋白组成,球蛋白按沉淀系数分为2S、7S、11S和15S 4种主要类型。11S球蛋白是大豆球蛋白的主要成分之一,其质量百分数占大豆籽实总蛋白的19.5%~23.1%和总球蛋白的40.0%,易引起幼龄动物免疫球蛋白E(IgE)型过敏反应[1]。11S球蛋白含有5个亚基,约20 ku的碱性多肽和约40 ku的酸性多肽(由二硫键相连)组成每个亚基的结构。根据蛋白质在动物肠道中的吸收规律,大豆球蛋白主要吸收部位在小肠,小部分见于胃和大肠中[2-3]。11S球蛋白经幼龄动物采食进入肠道后,肠道出现明显炎症浸润,诱导肠黏膜细胞凋亡,使小肠通透性升高,损坏肠黏膜屏障[4]。肠上皮对环境起着动态屏障的作用,整合了多种信号,包括来自代谢物、共生微生物区系、免疫反应和衰老应激源的信号。肠上皮细胞通过不断地增殖更新来替换受损的细胞,以维持肠道上皮的正常屏障功能。
仔猪小肠上皮细胞(IPEC-J2细胞)处于小肠第1层,保存了大部分细胞的原有上皮特性,在构成完整的管腔环境过程中发挥重要作用。体外研究表明,11S球蛋白降低IPEC-J2细胞的跨膜电阻值,提高细胞通透性,抑制细胞增殖,诱导肠细胞损伤凋亡[5]。本课题组前期研究证实,11S球蛋白分别通过核因子-κB(NF-κB)、诱导型一氧化氮合酶(iNOS)、c-Jun N端激酶(JNK)和p38丝裂原活化蛋白激酶(p38 MAPK)信号通路引起IPEC-J2细胞损伤和凋亡[6-7]。p38 MAPK抑制剂SB202190与腺嘌呤核苷三磷酸竞争抑制p38 MAPK活性,降低肿瘤坏死因子-α(TNF-α)含量[8]。JNK抑制剂SP600125可以抑制JNKmRNA的表达[9]。二硫氨基甲酸肽吡咯烷(PDTC)是NF-κB的一种强效抑制剂,它既能抵抗自由基的毒性作用,也能抑制促炎性细胞因子的生成[10]。Nω-硝基-L-精氨酸甲酯(L-NAME)是一种非特异性的一氧化氮合酶(NOS)抑制剂,能同时抑制神经元型一氧化氮合酶(nNOS)、内皮型一氧化氮合酶(eNOS)和iNOS的表达[11]。本试验在前期研究的基础上,构建IPEC-J2细胞体外模型,测定NF-κB、iNOS、JNK和p38 MAPK分别在各自抑制剂作用下,IPEC-J2细胞活性以及相关炎性因子含量和蛋白表达水平,并在透射电镜下观察IPEC-J2细胞结构形态的完整性,分析11S球蛋白通过JNK、p38 MAPK、NF-κB和iNOS信号通路诱导IPEC-J2细胞损伤的差异,为11S球蛋白引起IPEC-J2细胞损伤的分子机制提供科学依据。
1 材料与方法
1.1 试验材料
11S球蛋白购自中国农业大学食品工程学院,并进一步提纯至91.8%。IPEC-J2细胞购自武汉市农业科学院细胞库,RPMI 1640培养基由美国Thermo公司提供,BCA蛋白浓度测定试剂盒购自Biosharp公司,β-肌动蛋白(β-actin)由爱必信(上海)生物科技有限公司提供,HPR辣根酶标记山羊抗兔免疫球蛋白G(IgG)二抗和山羊抗鼠二抗购自Biosharp公司,PDTC、L-NAME、SP600125和SB202190购自碧云天生物技术公司。一氧化氮(NO)、TNF-α、干扰素-γ(INF-γ)、白细胞介素-6(IL-6)和白细胞介素-10(IL-10)酶联免疫吸附测定(ELISA)试剂盒购自南京建成生物工程研究所。
1.2 试验分组与设计
将对数生长期中的IPEC-J2细胞,按照1×105个/mL的密度接种在6孔细胞板后,置于37 ℃、5% CO2恒温培养箱中培养24 h贴壁后,随机分为6组:A组(对照组)无添加,B组添加5 mg/mL的11S球蛋白,C组添加5 mg/mL的11S球蛋白+1 μmol/L的PDTC,D组添加5 mg/mL的11S球蛋白+1 μmol/L的L-NAME,E组添加5 mg/mL的11S球蛋白+1 μmol/L的SP600125,F组添加5 mg/mL的11S球蛋白+1 μmol/L的SB202190,每组设置3个重复。
1.3 细胞活性测定
按照5 000个/孔的密度将对数生长期中的IPEC-J2细胞悬液(100 μL/孔)接种在96孔板中,细胞贴壁后,按照试验设计分别添加11S球蛋白和抑制剂,培养24 h后,每孔加入10 μL的CCK-8溶液,在细胞培养箱内继续孵育至出现明显的颜色反应。用酶标仪测定450 nm处的光密度(optical density,OD)值,检测细胞活性。
1.4 NO、TNF-α、INF-γ和IL-10含量测定
按照试验设计,将各组细胞培养24 h后,收集细胞,1 000 r/min离心5 min,磷酸盐缓冲液(PBS)洗涤3次。随后在每组样品中加入500 μL含0.1%聚乙二醇辛基苯基醚(TritonX-100)的0.1 mol/L Tris-HCl(pH=7.4),超声裂解各组样品(冰水中)。收集细胞裂解液,1 000 r/min离心10 min后,吸取上清液,依据ELISA试剂盒说明进行试验,检测NO、TNF-α、INF-γ和IL-10含量。
1.5 苏木精-伊红(HE)染色
按照试验分组与设计,培养24 h后,收集细胞,制作切片。依次将切片放入二甲苯Ⅰ 10 min,二甲苯Ⅱ 10 min,无水乙醇Ⅰ3 min,无水乙醇Ⅱ 3 min,乙醇Ⅰ(95%) 3 min,乙醇Ⅱ(95%) 3 min,乙醇(80%)3 min,蒸馏水1 min。切片放入苏木素染液中染色细胞核1~3 min,切片放入伊红染液中染色细胞质1~3 min,流水清洗后脱水封片,显微镜镜检,分析图像。
1.6 透射电子显微镜观察细胞形态及内部结构
按照试验设计,将各组细胞培养24 h后,收集细胞,1 000 r/min离心5 min,弃上清液,每管加入1 mL的4%多聚甲醛4 ℃下固定12 h后,PBS洗涤3次(4 ℃、5 000 r/min、15 min)之后用2%锇酸渗透酸固定4 h。PBS缓冲液冲洗后,用30%~100%酒精梯度脱水,渗透包埋,切割超薄切片染色,在JEM-1230透射电子显微镜(transmission electron microscopy,TEM)下拍摄图片。
1.7 实时荧光定量PCR(qRT-PCR)检测NF-κB、iNOS、JNK和p38 MAPK mRNA相对表达量

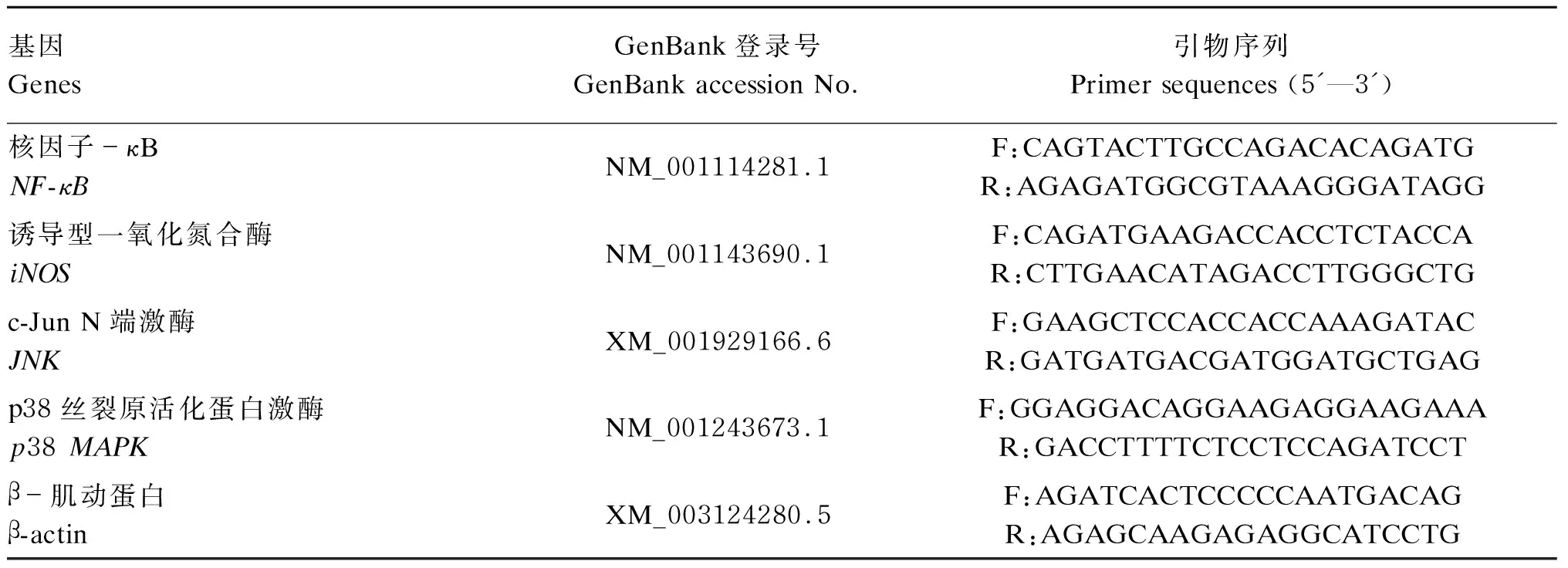
表1 基因引物参数
1.8 Western blot检测NF-κB、iNOS、JNK和p38 MAPK蛋白表达水平
按照试验设计,将各组细胞培养24 h后,收集细胞,将IPEC-J2细胞进行Western Blot印迹处理。每个十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)(12%)泳道加入20 μg的总蛋白电泳并转移至聚偏二氟乙烯(PVDF)膜上。PVDF膜4 ℃下与一抗孵育过夜后用TBST缓冲液清洗3次,进行二抗孵育。洗膜3次,放入凝胶成像系统显影拍摄。
1.9 数据处理
试验数据用平均值±标准差表示,采用SPSS 17.0软件的ANOVA程序进行方差分析,LSD法进行显著性比较,P<0.05表示差异显著,P<0.01表示差异极显著。使用Graph Pad Prism 7.0软件绘制柱状图,使用Quantity One软件分析Western blot结果。
2 结 果
2.1 11S球蛋白、PDTC、L-NAME、SP600125和SB202190对IPEC-J2细胞活性的影响
如图1所示,与A组相比,B组细胞活性极显著下降(P<0.01)。与B组相比,分别添加1 μmol/L的PDTC、L-NAME、SP600125和SB202190后,C、D、E和F组细胞活性极显著上升(P<0.01)。C组细胞活性显著高于D、E和F组(P<0.05)。

不同组别之间,数据点标不同小写字母表示差异显著(P<0.05),不同大写字母表示差异极显著(P<0.01),相同或无字母表示差异不显著(P>0.05)。
2.2 11S球蛋白、PDTC、L-NAME、SP600125和SB202190对IPEC-J2细胞因子和NO含量的影响
如图2所示,与A组相比,B组NO、TNF-α和INF-γ含量均极显著升高(P<0.01)。与B组相比,C、D、E和F组NO、TNF-α和INF-γ含量均极显著降低(P<0.01)。与A组相比,B组IL-10含量极显著降低(P<0.01)。与B组相比,C、D、E和F组IL-10含量极显著升高(P<0.01)。
2.3 IPEC-J2细胞的HE染色图像
HE染色图像如图3所示,A组的细胞膜完整,核仁饱满;B组的细胞肿胀或破裂,细胞外形结构异形,核仁皱缩。与B组相比,C、D、E和F组的细胞损伤情况明显减轻,细胞外形及细胞膜相对完整;与D、E和F组相比,C组的细胞形态及细胞膜更加规则完整,核仁皱缩现象明显改善。
2.4 透射电镜观察结果
如图4所示,A组的细胞外形结构及细胞器形态完整,胞浆致密,核染色质分布均匀;B组的细胞核周围出现空泡,细胞浆减少,细胞核增大异形、边界不整齐,核层退化,染色质皱缩,细胞质凝结。分别添加1 μmol/L的PDTC、L-NAME、SP600125和SB202190后,C、D、E和F组的细胞结构趋于完整且细胞质空泡化减少;与D、E和F组相比,C组细胞膜形态更加规则完整,细胞浆增多,细胞核大小正常、形态规则,染色质分布更加致密均匀。
2.5 PDTC、L-NAME、SP600125和SB202190对NF-κB、iNOS、JNK和p38 MAPK mRNA相对表达量的影响
如图5所示,与A组相比,B组的NF-κB、iNOS、JNK和p38MAPKmRNA相对表达量极显著升高(P<0.01)。与B组相比,分别添加1 μmol/L的PDTC、L-NAME、SP600125和SB202190后,C和F组的NF-κB、iNOS、JNK和p38MAPKmRNA相对表达量显著或极显著下降(P<0.05或P<0.01),D组的NF-κB、iNOS和JNKmRNA相对表达量极显著下降(P<0.01),E组的NF-κB、JNK和p38MAPKmRNA相对表达量显著或极显著下降(P<0.05或P<0.01)。
2.6 11S、PDTC、L-NAME、SP600125和SB202190对NF-кB、iNOS、JNK和p38 MAPK蛋白表达水平的影响
如图6所示,与A组相比,B组的NF-κB、iNOS、JNK和p38 MAPK蛋白表达水平极显著升高(P<0.01)。与B组相比,分别添加1 μmol/L的PDTC、L-NAME、SP600125和SB202190后,C、E和F组的NF-κB、iNOS、JNK和p38 MAPK蛋白表达水平极显著下降(P<0.01),D组的NF-κB、iNOS和JNK蛋白表达水平极显著下降(P<0.01)。
3 讨 论
Stokes等[12]研究发现,大豆抗原蛋白介导T淋巴细胞免疫应答产生过量细胞因子引起猪肠上皮结构损伤。细胞因子IL-10主要由辅助性T细胞2(Th2)产生,在过敏性炎症反应中发挥重要作用。敲除IL-10的小鼠结肠黏膜增厚,肠道炎性细胞浸润明显,炎症相关基因表达量上升,自发形成慢性小肠炎症[13]。刘欣[14]用11S球蛋白灌胃小鼠建立体内试验模型,qRT-PCR检测小鼠小肠组织,发现IL-10 mRNA的相对表达量降低。本试验中,添加5 mg/mL的11S球蛋白后,IL-10含量极显著下降;添加1 μmol/L的PDTC、L-NAME、SP600125和SB202190后,IL-10含量极显著上升。这提示在11S球蛋白诱导的肠道过敏炎症反应中,IL-10是重要的免疫调节剂。IL-10参与的免疫抑制反应是由p38 MAPK途径介导的[15],p38 MAPK、JNK和细胞外信号调节激酶(ERK)是丝裂原活化蛋白激酶(MAPK)信号通路下游的3个信号级联通路,MAPK信号通路调控肠道细胞的增殖和免疫反应,在炎症反应中发挥重要作用[16]。Peng等[17]采用11S球蛋白饲喂断奶仔猪构建体内试验模型发现,11S球蛋白诱导肠道组织JNK和p38 MAPK蛋白过度表达。张瑜[18]通过体外培养IPEC-J2细胞发现,随11S球蛋白浓度增加,IPEC-J2细胞磷酸化c-Jun N端激酶(p-JNK)和磷酸化p38(p-p38)蛋白表达水平逐渐增加,细胞活性显著下降,细胞损伤程度逐渐加重;添加SP600125和SB202190后,p-JNK和p-p38蛋白表达水平显著下降,且能够抑制细胞损伤。本试验中,添加5 mg/mL的11S球蛋白后,IPEC-J2细胞活性极显著下降,JNK和p38 MAPK蛋白表达水平及mRNA相对表达量极显著升高;添加SP600125和SB202190后,细胞活性极显著上升,JNK和p38 MAPK蛋白表达水平及mRNA相对表达量极显著降低,说明11S球蛋白通过JNK和p38 MAPK信号通路介导IPEC-J2细胞损伤。
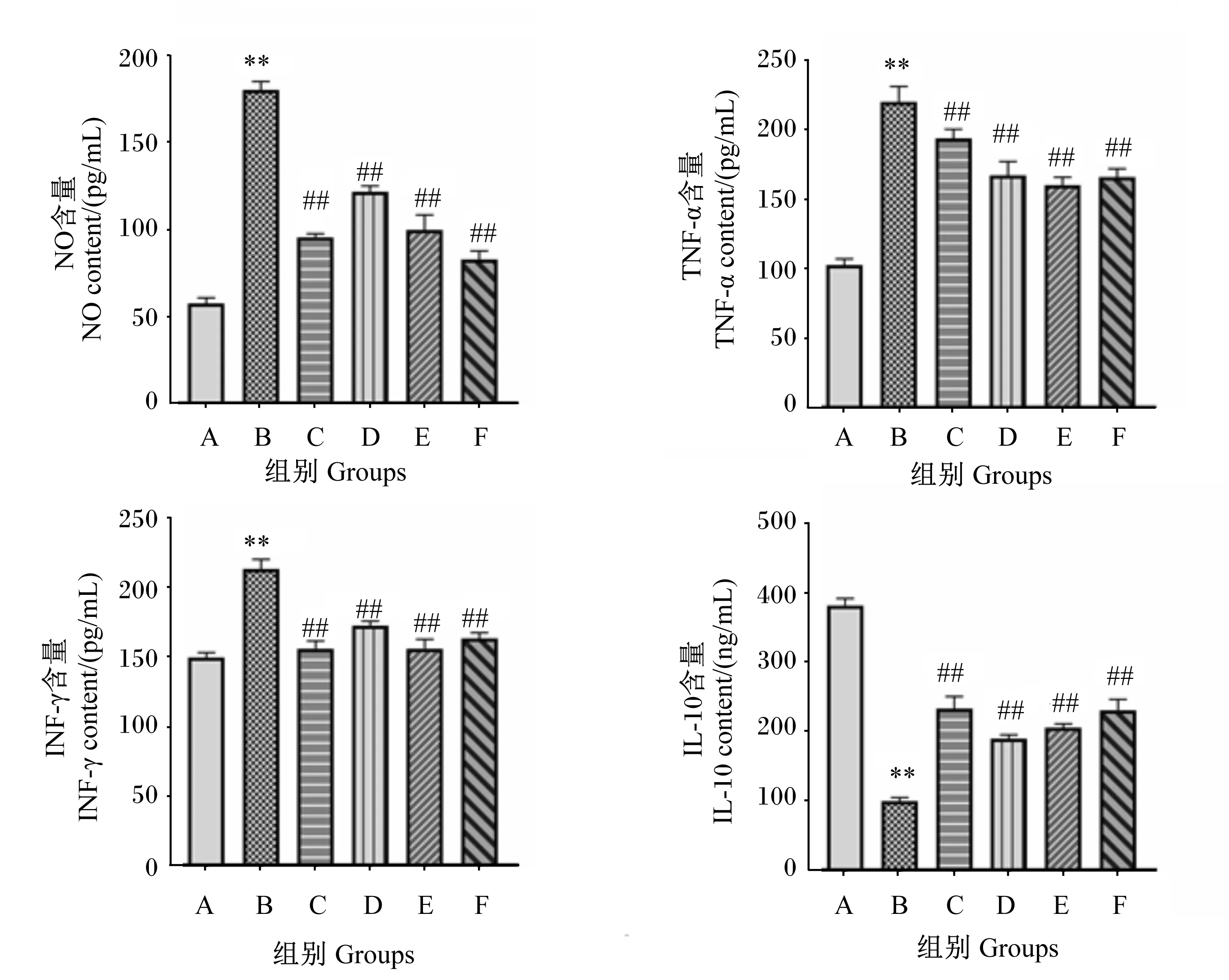
*表示与A组相比差异显著(P<0.05),**表示与A组相比差异极显著(P<0.01)。#表示与B组相比差异显著(P<0.05),##表示与B组相比差异极显著(P<0.01)。下图同。
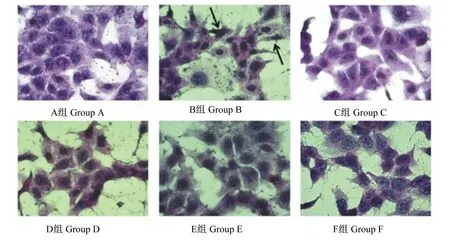
图3 HE染色观察IPEC-J2细胞的细胞形态和结构
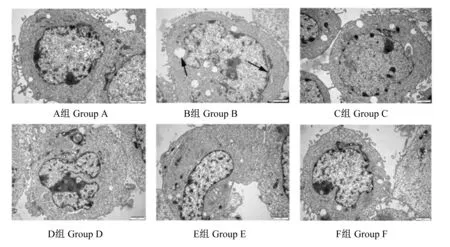
图4 透射电镜观察IPEC-J2细胞的超微结构
11S球蛋白诱导的仔猪过敏反应主要是Th2型免疫反应[1],TNF-α和INF-γ是Th2型免疫反应的重要产物[19]。在卵蛋白致敏的小鼠模型中,TNF-α和INF-γ共同诱导细胞产生炎性介质,促进炎症反应[20]。这与本试验11S球蛋白处理IPEC-2细胞后,ELISA检测显示TNF-α和INF-γ含量极显著上升结果一致。TNF-α和INF-γ共同诱导细胞NF-κB抑制蛋白α的磷酸化和降解,导致NF-κB/p65的磷酸化及其核转位[21],激活NF-κB信号通路。在细胞核中,NF-κB促进炎症反应的基因表达,引起细胞凋亡[22]。体内和体外研究发现,11S球蛋白激活NF-κB信号通路诱导IPEC-J2细胞凋亡,损伤断奶仔猪肠道组织[17-18]。Yi等[23]研究发现,断奶导致的仔猪空肠炎症与空肠IFN-γmRNA相对表达量升高与NF-κB信号通路激活有关。本试验用5 mg/mL的11S球蛋白处理IPEC-J2细胞后,细胞活性极显著下降,HE染色可见细胞膜破裂和细胞核皱缩,透射电镜观察发现胞质空泡化、染色质边集,NF-κB蛋白表达水平和mRNA相对表达量显著提高;添加1 μmol/L的PDTC预处理IPEC-J2细胞后,细胞活性极显著升高,NF-κB蛋白表达水平和mRNA相对表达量显著下降,这表明11S球蛋白通过NF-κB信号通路介导IPEC-J2细胞损伤。

图5 qRT-PCR检测细胞中NF-κB、iNOS、JNK和p38 MAPK mRNA相对表达量
大豆富含的L-精氨酸是NO的前体,NO在iNOS催化L-精氨酸的过程中产生,是一种细胞炎性介质[24]。p38 MAPK通路增加细胞内NO的产生[15],NO除激活细胞死亡受体途径和线粒体途径诱导细胞凋亡外,还能调节其他炎症因子(如TNF-α)的释放进而加强炎症反应[25]。本试验中,添加5 mg/mL的11S球蛋白处理IPEC-J2细胞,结果发现细胞活性极显著下降,NO和TNF-α含量极显著升高,iNOS蛋白表达水平和mRNA相对表达量显著或极显著升高;添加L-NAME后,NO和TNF-α含量极显著降低,细胞活性极显著上升,iNOS蛋白表达水平和mRNA相对表达量显著降低,表明L-NAME能够通过调节iNOS的表达减少炎症介质,抑制细胞损伤。Kaji等[26]研究发现,肠道平滑肌细胞和巨噬细胞中过量表达的iNOS引起细胞损伤,L-NAME预处理可以阻止细胞损伤。Leitão等[27]在甲氨蝶呤(MTX)诱导的肠黏膜炎症中发现iNOSmRNA相对表达量显著增加,添加L-NAME后可减轻小肠绒毛和隐窝损伤、细胞凋亡现象。
细胞信号转导是多通路、多环节、多层次高度复杂的可控反应,信号的启动、放大和终止是相互作用的正负反馈机制。1种或几种信号通路的异常表达,即可能造成整个信号转导系统的失调,进而引发病变。MAPK和NF-κB信号通路的异常激活促进炎症反应,是导致炎症性肠病(inflammatory bowel disease,IBD)的重要原因[28]。研究表明,IBD患者肠组织中的JNK、p38 MAPK和NF-κB蛋白表达水平显著上升[29-30]。Berghe等[31]研究表明,p38 MAPK通路的激活有助于NF-κB调节其p65亚基的反式激活能力。NF-κB是典型的促炎性信号通路,炎性细胞因子激活NF-κB通路[21],持续激活的NF-κB编码促炎细胞因子及iNOS[32],形成炎症反应的正反馈回路。Rogler等[33]在溃疡性结肠炎和克罗恩病患者的黏膜活检标本中,发现NF-κB蛋白表达水平与肠上皮细胞的活性和炎症的严重程度显著相关。体内试验发现,SP600125、SB202190和PDTC均能显著缓解肠道炎症[34-36],这与本试验添加抑制剂后能够显著抑制IPEC-J2细胞损伤的结果相符。本试验中,与分别添加1 μmol/L的L-NAME、SP600125和SB202190组相比,添加1 μmol/L PDTC组的细胞活性显著高于上述3组,HE染色可见细胞折光性强、胞质饱满、核质清晰,透射电镜观察细胞形态与对照组细胞形态相近,细胞核结构完整、核染色质分布更均匀且胞质空泡化明显减少。这说明PDTC能够抑制11S球蛋白介导的IPEC-J2细胞损伤,且抑制细胞损伤效果优于L-NAME、SP600125和SB202190。这表明NF-κB信号通路在11S球蛋白通过JNK/p38 MAPK/NF-κB/iNOS信号通路介导IPEC-J2细胞损伤的过程中发挥关键作用,这可能与持续上调的NF-κB信号通路激活其他促炎途径,使炎症反应级联放大有关。
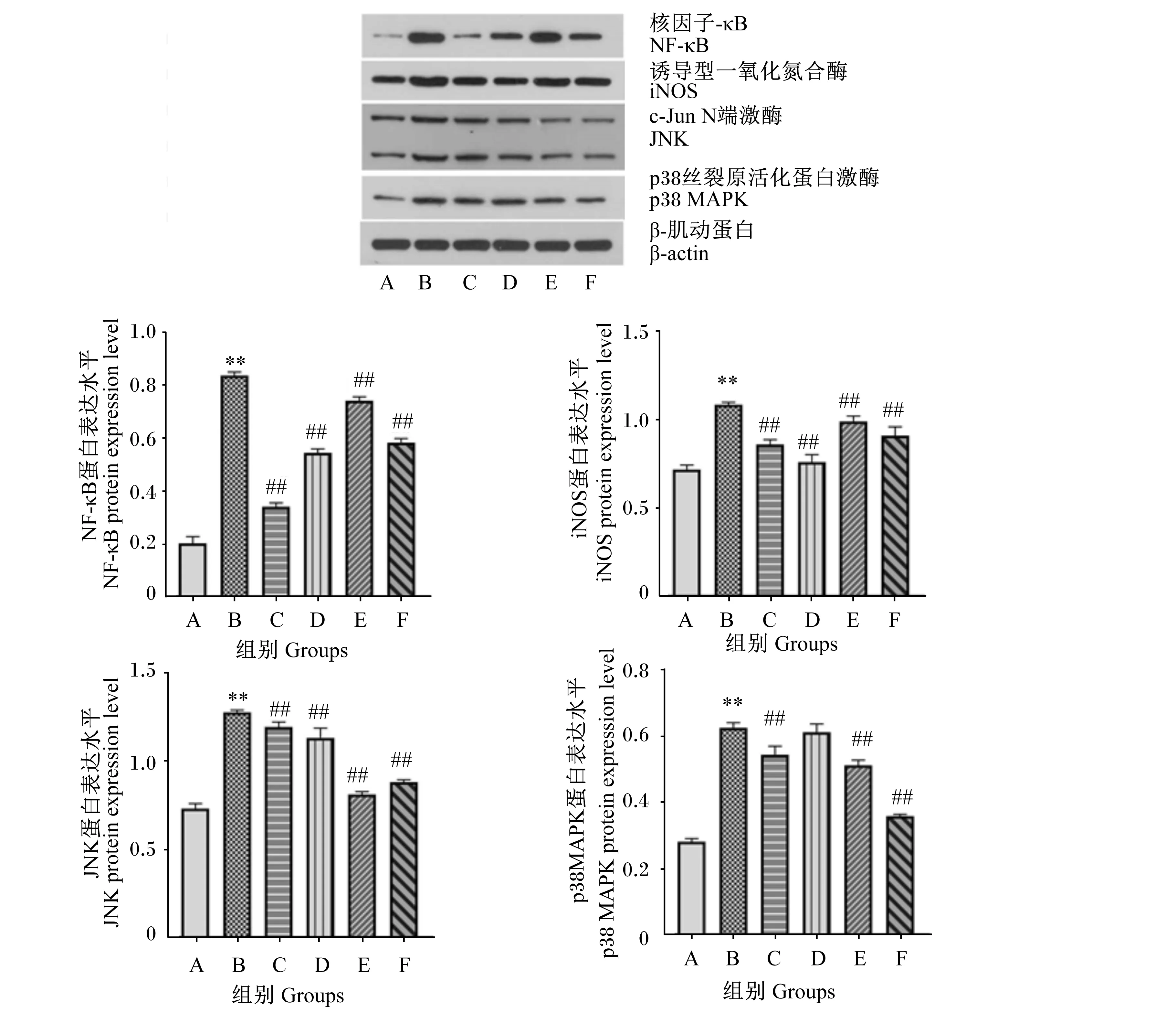
图6 Western blot检测细胞中NF-κB、iNOS、JNK和p38 MAPK蛋白表达水平
4 结 论
①11S球蛋白通过JNK/p38 MAPK/NF-κB/iNOS信号通路诱导IPEC-J2细胞损伤,促进NO、TNF-α和INF-γ分泌,抑制IL-10分泌,提高NF-κB、iNOS、JNK和p38MAPKmRNA相对表达量,增加NF-κB、iNOS、JNK和p38 MAPK蛋白表达水平,添加PDTC、L-NAME、SP600125和SB202190后,均能抑制IPEC-J2细胞损伤。
②添加PDTC组的IPEC-J2细胞的活性、细胞形状和细胞器结构的完整性均优于添加L-NAME、SP600125和SB202190组。NF-κB信号通路在11S球蛋白通过JNK/p38 MAPK/NF-κB/iNOS信号通路介导IPEC-J2细胞损伤的过程中发挥关键作用。
