微生物发酵饲料对奶牛瘤胃发酵功能及饲粮营养物质体外消化率的影响
2021-04-13徐子萱李冬芳于春微李松建胡红莲刘大程
徐子萱 李冬芳 于春微 李松建 高 民 胡红莲 刘大程*
(1.内蒙古农业大学兽医学院,呼和浩特010018;2.农业部动物疾病临床诊疗技术重点实验室,呼和浩特010018;3.内蒙古农牧业科学院动物营养研究所,呼和浩特010031)
反刍动物独特的瘤胃发酵系统能够分解饲料中的营养物质并合成自身所需的营养,如菌体蛋白(BCP)、挥发性脂肪酸(VFA)等。微生物发酵饲料是以植物性农副产品为主要原料,通过微生物的代谢作用,降解部分多糖、蛋白质和脂肪等大分子物质,生成有机酸和可溶性小肽等小分子物质,其营养丰富、适口性好、活菌数量高[1]。大量研究表明,微生物发酵饲料可有效减少棉籽粕等原料的抗营养因子含量,还能产生如活性肽、多糖、有机酸等活性物质[2],这类物质能增强机体的免疫功能[3-4],提高抗氧化功能[5-6],改善动物的肠道微生态平衡[7],同时可提高动物采食量和饲料利用率[8]。微生物发酵饲料的菌种与制备工艺不同,作用效果有很大差异,本课题组前期研究的一种微生物类发酵制剂,由高活性酵母菌和枯草芽孢杆菌经发酵而成,其主效成分包括甘露聚糖、葡聚糖、氨基酸、多肽和有机酸5种营养活性物质[9],能为瘤胃微生物生长提供特殊的营养底物,刺激瘤胃微生物的生长,调控瘤胃功能。实际生产中盲目饲喂微生物发酵饲料的现象也较为常见,缺乏配套的使用技术,效果不佳还会增加养殖成本[10]。目前,不同添加水平微生物发酵饲料对体外瘤胃发酵的影响鲜见报道。因此,本研究通过体外发酵试验评价不同添加水平微生物发酵饲料对奶牛的瘤胃发酵功能及饲粮营养物质体外消化率的影响,为今后微生物发酵饲料在奶牛养殖中的应用提供技术支撑。
1 材料与方法
1.1 微生物发酵饲料
以麸皮、米糠、棉籽粕、玉米皮等9种农副产品为主要发酵原料,将课题组菌种库的酿酒酵母菌(Saccharomycescerevisiae,SC)2株,编号分别为XR4和BC;枯草芽孢杆菌(Bacillussubtilis)1株,编号为A15,以XR4∶BC∶A15按菌液体积2∶2∶1混合,8%接种量接入250 kg的固态发酵饲料中,加水使最终含水量为45%,于车间中30 ℃好氧堆积发酵48 h。根据本课题组前期成果[11-12],其主效指标为:酵母菌数量≥5×108CFU/g,β-葡聚糖含量≥5.484 g/kg,甘露聚糖含量≥3.438 mg/kg,多肽含量≥1.36 mg/g,有机酸含量≥1.48 mg/g。
1.2 试验动物与饲养管理
选择5头体态状况较好、体重相近,带有永久瘤胃瘘管的奶牛,单栏饲养,自由饮水。饲粮营养水平参照NRC(2001)奶牛饲养标准,基础饲粮组成及营养水平见表1。

表1 基础饲粮组成及营养水平(干物质基础)
1.3 试验设计
体外发酵试验中,将玉米秸青贮、羊草、苜蓿干草3种粗料与玉米、豆粕2种精料配成精粗比为5∶5的全混合日粮作为培养底物,对照组全混合日粮中添加奶牛浓缩料(粗蛋白质34.60%、钙2.05%、磷1.40%、食盐1.20%、赖氨酸1.44%、蛋氨酸0.59%),4个试验组全混合日粮中分别添加3%、5%、7%和9%微生物发酵饲料。全混合日粮组成及营养水平见表2。
1.4 试验方法
体外发酵装置:恒温水浴摇床。培养管为100 mL的玻璃注射器,针头的上端连接三通阀橡胶管,试验过程中三通阀关闭以确保严格的厌氧环境。涂抹凡士林在注射器活塞的四周,防止漏气,还能使活塞向上移动的阻力减小。
瘤胃液采集和人工瘤胃培养液配制:在晨饲前采集奶牛瘤胃液,装入保温瓶迅速返回实验室,缓慢通入二氧化碳(CO2)条件下,瘤胃液4层纱布过滤待用。人工瘤胃培养液参照Menke等[13]的方法进行配制。
体外人工瘤胃接种:0.2 g样品放入培养管,加人工瘤胃培养液(瘤胃液∶培养液=1∶2)30 mL,推出气泡。样品做5个平行,无培养底物的瘤胃液作5个空白对照。记录初始的刻度,放置于摇床中39 ℃条件下培养24 h。再称取0.2 g发酵底物放入150 mL广口培养瓶中,向培养瓶中加入120 mL培养液,持续通入CO2;盖上带有气阀的橡皮塞;放入39 ℃恒温水浴摇床中培养,用于测定干物质体外消化率(IVDMD)。
分别在培养0、3、6、9、12、24 h时取样,对培养液的产气量、pH及氨态氮(NH3-N)、VFA、BCP浓度进行测定。
1.5 测定指标及方法
瘤胃发酵参数测定:产气量在发酵管上直接读取刻数进行记录;pH采用pHs-3c型高精度酸度计(梅特勒-托利多公司)进行测定;VFA浓度按秦为琳[14]的方法通过Varian气相色谱仪(GC-450,德国)进行测定;NH3-N浓度按冯宗慈等[15]的比色法,使用T6系列紫外可见分光光度计(北京普析通用仪器有限责任公司)进行测定;BCP浓度采用考马斯亮蓝比色法,使用T6系列紫外可见分光光度计(北京普析通用仪器有限责任公司)进行测定[16]。
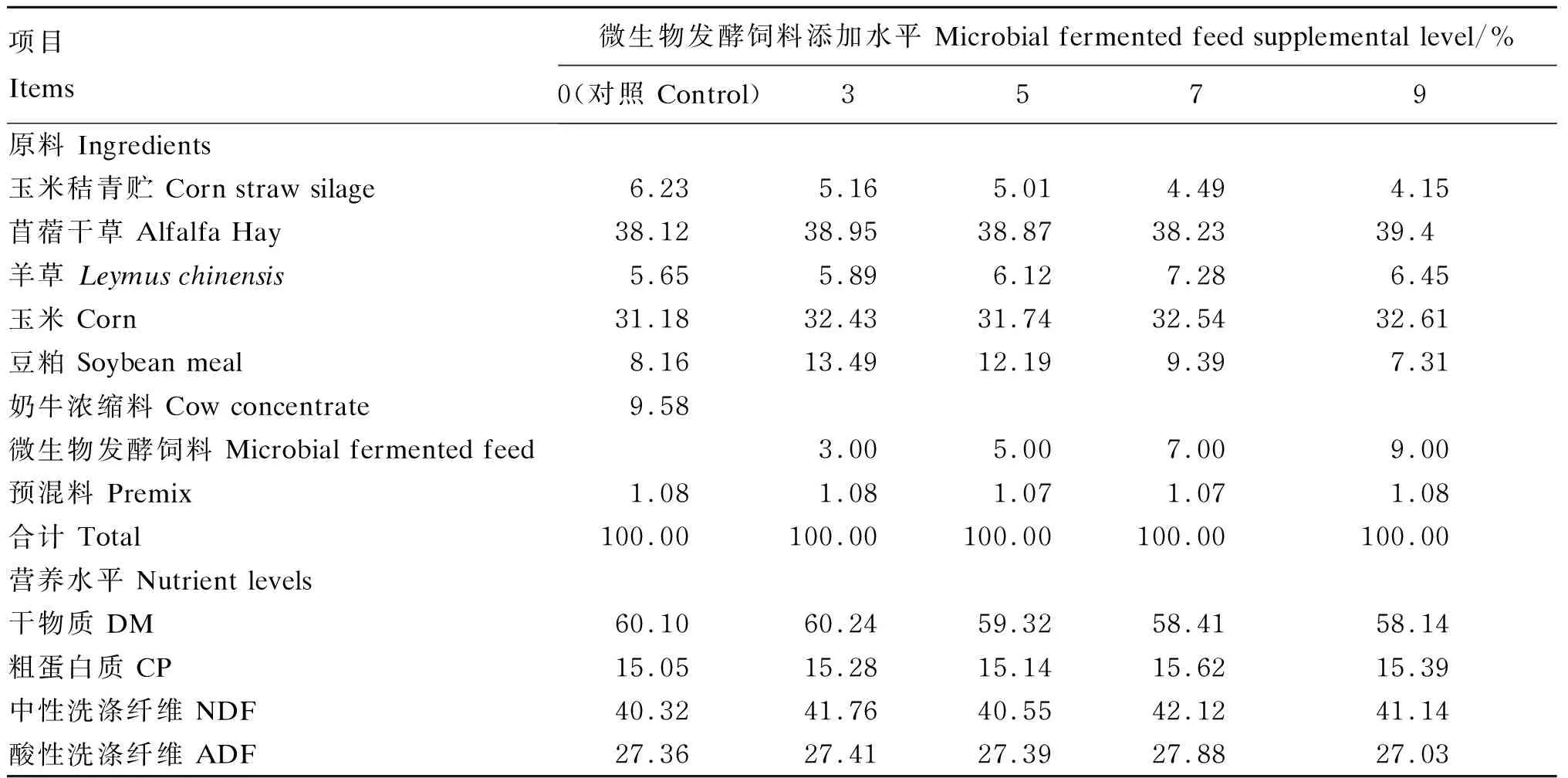
表2 全混合日粮组成及营养水平(干物质基础)
体外24 h培养结束后,培养液用尼龙袋(尺寸为110 mm×80 mm,孔径为400目)过滤,残渣105 ℃烘干后,称重并计算样品IVDMD。对消化后样品中的粗蛋白质(CP)、中性洗涤纤维(NDF)和酸性洗涤纤维(ADF)含量进行测定,CP含量采用全自动凯氏定氮仪(K9860,济南海能仪器有限公司)进行测定,NDF、ADF含量采用滤袋法(ANKOM A200i型半自动纤维分析仪,美国Ankom公司)进行测定[17],并按公式计算粗蛋白质体外消化率(IVCPD)、中性洗涤纤维体外消化率(IVNDFD)、酸性洗涤纤维体外消化率(IVADFD):
营养物质体外消化率(%)=100×{[样品重(%)×
样品中该营养物质含量(%)]-[残渣重(%)×
残渣中该营养物质含量(%)]}/[样
品重(%)×样品中该营养物质含量(%)]。
1.6 数据处理与统计分析
在Excel 2010中对数据进行处理,制作图表;使用SAS 9.0软件中的GLM过程对数据进行方差分析;用DPS 14.0数据处理系统中Topsis法对数据进行综合评价。
2 结 果
2.1 不同添加水平微生物发酵饲料对培养液产气量的影响
由表3可知,随着体外培养时间的延长,培养液产气量逐渐升高。在培养3、6 h时,5%、7%和9%组的产气量显著高于对照组(P<0.05);在培养9 h时,7%组的产气量显著高于对照组(P<0.05),在培养12和24 h时,7%和9%组的产气量显著高于对照组(P<0.05)。7%组的产气量平均值最高,显著高于对照组和3%组(P<0.05)。
通过组织的岗位定位分流后,在大学二年级开启“见习生”计划,即建立校企合作岗位培训基地,利用周末、寒暑假的社会实践机会,在固定企业进行见习生计划,主要进行工作学习分享和社会实践,即类似于现代学徒制,跟随师傅教授职场要诀。
2.2 不同添加水平微生物发酵饲料对培养液pH的影响
由表4可知,随着体外培养时间的延长,培养液pH逐渐降低。在培养0、3、6、9 h时,各组的pH无显著差异(P>0.05);在培养12 h时,9%组的pH显著高于3%组(P<0.05),但与其他各组无显著差异(P>0.05);在培养24 h时,7%组的pH最低且显著低于对照组(P<0.05)。3%组的pH平均值显著低于对照组和9%组(P<0.05)。
2.3 不同添加水平微生物发酵饲料对培养液总挥发性脂肪酸(TVFA)浓度的影响
由表5可知,随着体外培养时间的延长,培养液TVFA含量逐渐增加。在培养3 h时,7%组的TVFA浓度显著高于对照组和3%组(P<0.05);在培养9 h时,5%、7%和9%组的TVFA浓度显著高于对照组(P<0.05);在培养24 h时,3%、5%、7%和9%组的TVFA浓度均显著高于对照组(P<0.05),且以7%组最高。7%组的TVFA浓度平均值最高,显著高于对照组和3%组(P<0.05)。

表3 不同添加水平微生物发酵饲料对培养液产气量的影响
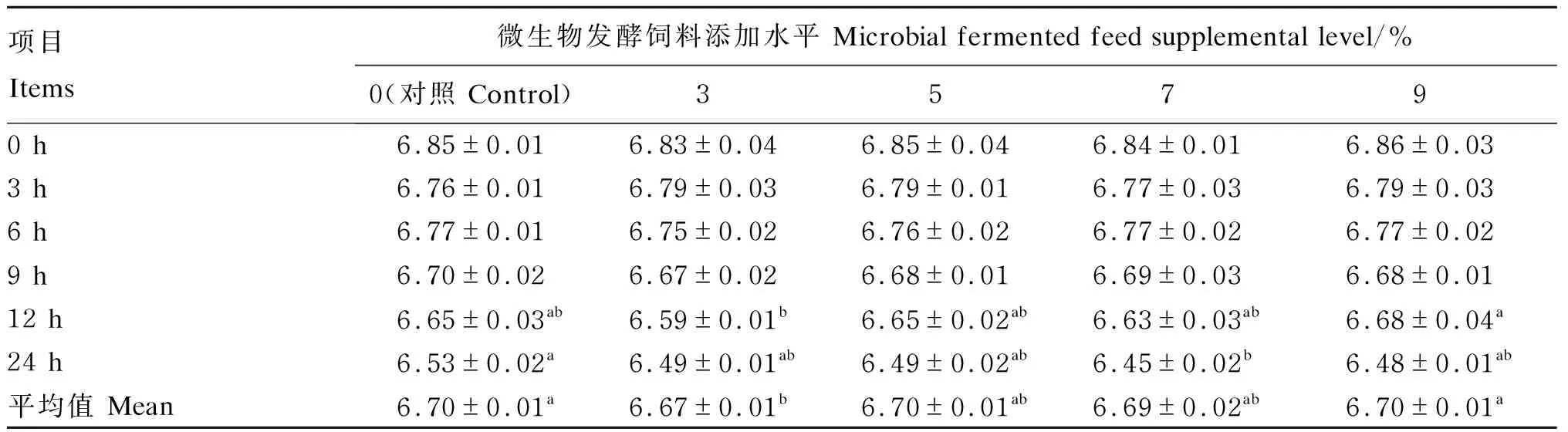
表4 不同添加水平微生物发酵饲料对培养液pH的影响
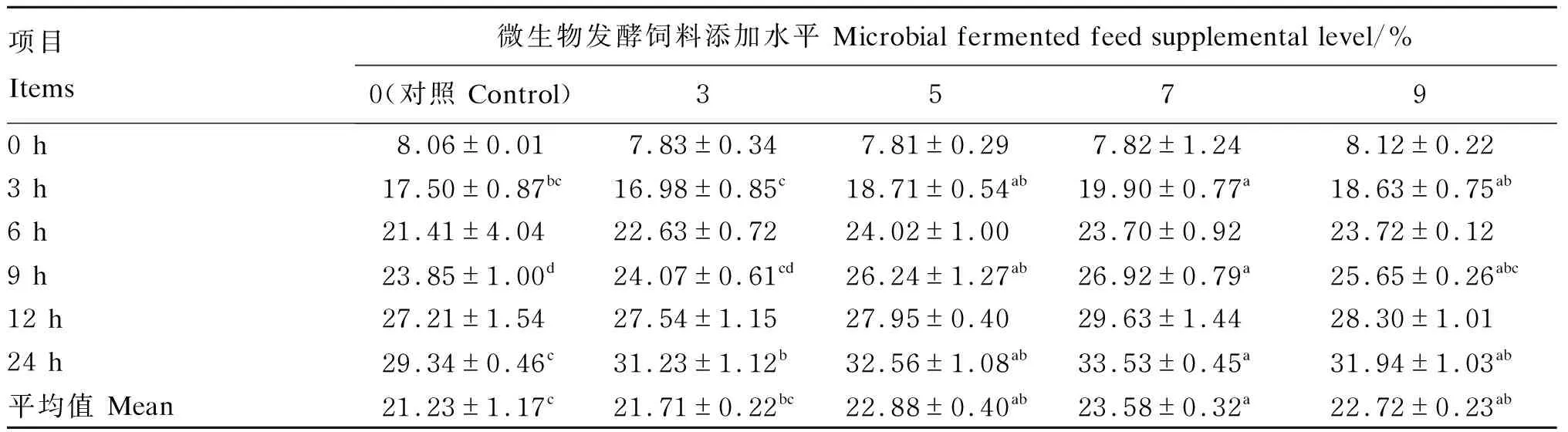
表5 不同添加水平微生物发酵饲料对培养液TVFA浓度的影响
2.4 不同添加水平微生物发酵饲料对培养液乙酸、丙酸、丁酸浓度及乙酸/丙酸的影响
由表6可知,在培养0、3、6、12 h时,各组乙酸浓度无显著差异(P>0.05);在培养9 h时,7%组的乙酸浓度显著高于对照组和3%组(P<0.05);在培养24 h时,7%组的乙酸浓度显著高于对照组(P<0.05)。7%组的乙酸浓度平均值最高,显著高于对照组和3%组(P<0.05)。
在培养0、3、6、9、12 h时,各组丙酸浓度无显著差异(P>0.05);在培养24 h时,3%、5%、7%和9%组的丙酸浓度显著高于对照组(P<0.05)。7%组的丙酸浓度平均值最高,显著高于对照组(P<0.05)。
在培养0 h时,对照组的丁酸浓度显著高于3%、9%组(P<0.05);在培养3 h时,7%组的丁酸浓度显著高于3%、5%组(P<0.05);在培养9 h时,7%组的丁酸浓度显著高于对照组(P<0.05),但与其他各组差异不显著(P>0.05)。7%组的丁酸浓度平均值最高,显著高于对照组(P<0.05)。

表6 不同添加水平微生物发酵饲料对培养液乙酸、丙酸、丁酸浓度及乙酸/丙酸的影响
2.5 不同添加水平微生物发酵饲料对培养液NH3-N浓度的影响
由表7可知,随着体外培养时间的延长,培养液NH3-N浓度在培养0、3 h时下降,之后又逐渐上升,在培养12 h时达到最高值又大幅度下降。在培养0、3、6h时,各组NH3-N浓度无显著差异(P>0.05);在培养9 h时,3%、5%、7%组的NH3-N浓度都显著高于对照组(P<0.05);在培养12、24 h时,各组NH3-N浓度无显著差异(P>0.05)。7%组的NH3-N浓度平均值最高,显著高于对照组(P<0.05)。

表7 不同添加水平微生物发酵饲料对培养液NH3-N浓度的影响
2.6 不同添加水平微生物发酵饲料对培养液BCP浓度的影响
由表8可知,随着体外培养时间的延长,培养液BCP浓度在培养0、3 h时呈增加的趋势,在培养6 h时逐渐下降,在培养9、12 h时逐渐升高趋势,在培养24 h时BCP浓度最高。在培养0、3、6 h时,各组BCP浓度无显著差异(P>0.05);在培养9、12、24 h时,5%、7%组的BCP浓度显著高于对照组(P<0.05)。7%组的BCP浓度平均值最高,显著高于对照组及3%、9%组(P<0.05)。
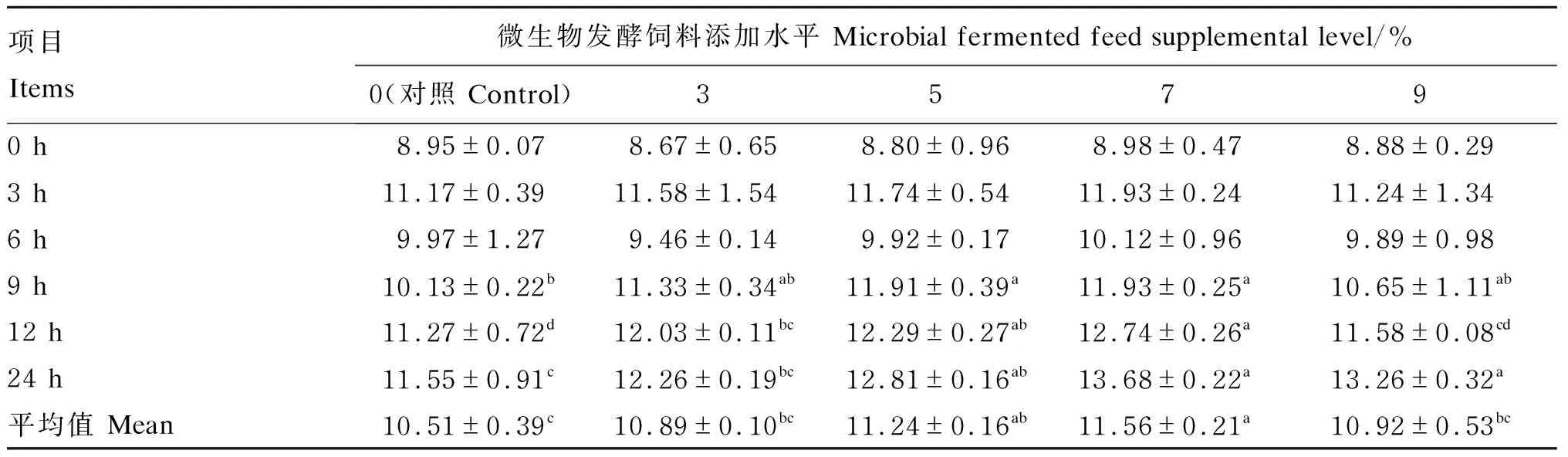
表8 不同添加水平微生物发酵饲料对培养液BCP浓度的影响
2.7 Topsis综合分析结果
由表9可知,使用DPS软件Topsis法对多试验和多指标综合分析,微生物发酵饲料适宜添加水平为7%。
2.8 微生物发酵饲料对饲粮营养物质体外消化率的影响
按7%的微生物发酵饲料适宜添加水平,采用一级离体消化试验来测定饲粮营养物质体外消化率。由表10可知,试验组的IVDMD、IVCPD、IVNDFD、IVADFD均高于对照组,分别比对照组提高了0.80%、1.43%、3.76%和1.98%(P>0.05)。

表9 各瘤胃发酵参数Topsis综合分析结果
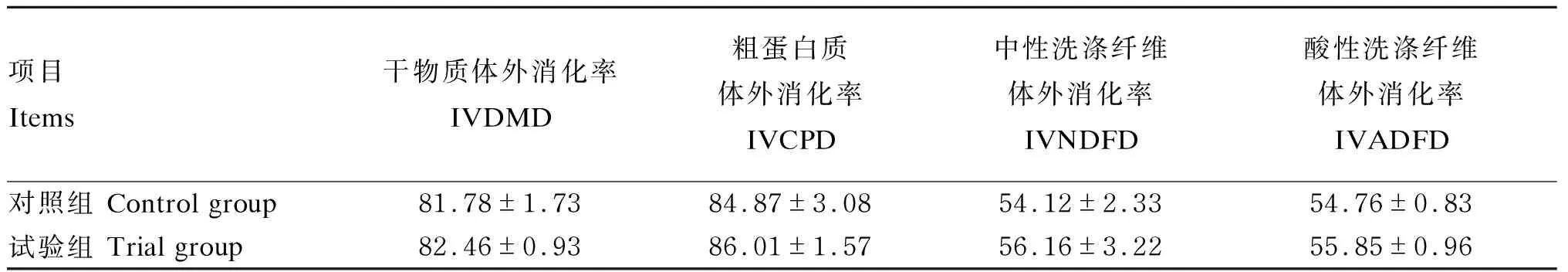
表10 微生物发酵饲料对饲粮营养物质体外消化率的影响
3 讨 论
3.1 不同添加水平微生物发酵饲料对培养液产气量的影响
产气量可反映瘤胃微生物对发酵底物的利用能力,通过试验中产气量的测定,能估测出培养底物的消化水平、消化速率[18-21]。本试验结果显示,在培养3、6 h时,5%、7%和9%组的产气量显著高于对照组;在培养12、24 h时,7%和9%组的产气量显著高于对照组。本课题组使用高活性的3株菌株和特殊工艺的发酵饲料,其中含有大量活性物质,如β-葡聚糖、甘露聚糖、有机酸、多肽等,微生物发酵饲料的添加水平增加,进入培养液中的有机酸、多肽等营养活性物质含量也随之增多,能有效提高瘤胃微生物的活性[22],从而增加了培养液的产气量。
3.2 不同添加水平微生物发酵饲料对培养液VFA浓度的影响
瘤胃在发酵的过程中可以产生的大量VFA,供给动物机体70%左右的能量[23]。多项研究证实,瘤胃内进行乙酸和丙酸发酵,乙酸参与了三羧酸循环,进行氧化供能或用于脂肪酸合成,丙酸是糖异生的前体物质,也是反刍动物所需葡萄糖的主要来源[24]。本试验中,7%组的乙酸浓度高于对照组,各组TVFA浓度均逐渐升高,说明微生物发酵饲料能够加强瘤胃的发酵功能,促进了底物的发酵,产生更多的VFA。在发酵9、24 h时,5%、7%、9%组的TVFA浓度显著高于对照组。培养24 h时与培养0 h相比,各组乙酸/丙酸均降低,说明添加微生物发酵饲料能改变瘤胃的发酵类型,使其趋于丙酸发酵型,从而提高了瘤胃发酵的能量利用率。
3.3 不同添加水平微生物发酵饲料对培养液NH3-N和BCP浓度的影响
微生物发酵饲料中的氮被瘤胃内的微生物分解,最终转化成为NH3-N和BCP。BCP合成效率为有机物用于合成微生物的效率[25],所以瘤胃内合适的NH3-N浓度更有利于BCP合成效率的最大化,又可以防止氮浪费。本试验中,在培养6、9、12 h时,NH3-N和BCP浓度在逐渐增加,表明此时间段微生物发酵饲料能够使饲料利用率增加,还可以使饲粮中的氮被瘤胃内的微生物逐渐分解,微生物发酵饲料也使瘤胃微生物利用NH3-N合成BCP的能力有所提高。3%、5%、7%和9%组培养液中NH3-N和BCP浓度平均值均高于对照组,表明添加微生物发酵饲料既能使饲粮中氮转化为NH3-N的效率提高,又能为合成BCP提供充足底物,促进了瘤胃内BCP的合成。
3.4 微生物发酵饲料对营养物质体外消化率的影响
干物质、CP、NDF、ADF等降解率的大小是饲粮中衡量质量的重要指标,数值越高表明饲粮在瘤胃中的降解程度越高[26]。因此,饲粮在瘤胃内的降解能力可以客观的表明微生物发酵饲料的作用效果和作用方式。本试验中,添加7%微生物发酵饲料后,试验组的IVDMD、IVCPD、IVNDFD、IVADFD均高于对照组,这说明微生物发酵饲料能够刺激瘤胃微生物更好地发酵底物,提高了饲粮中的氮转化为NH3-N等物质的效率,合成了大量的BCP,与植物蛋白质相比,BCP更容易被机体消化利用。
4 结 论
饲粮添加7%微生物发酵饲料可提高瘤胃发酵功能,提高饲粮营养物质体外消化率。
