易误诊为脑肿瘤的颅内静脉窦血栓形成
2021-04-13范冲竹李海南向璇邓达标李业海匡祖颖李智
范冲竹 李海南 向璇 邓达标 李业海 匡祖颖 李智
颅内静脉窦血栓形成(CVST)常因发病缓慢、临床表现多样且不典型等导致临床漏诊或误诊为脑肿瘤而行外科手术。在病理科日常工作中,颅内静脉窦血栓形成样本常见于尸检标本,外科病理活检并不常见,致使病理科医师对此类非肿瘤标本不够重视,常无法及时正确辨识病变,容易导致误诊或漏诊。本研究回顾性总结广东三九脑科医院诊断与治疗的1例颅内静脉窦血栓形成患者的临床病理学特征,以期提高临床医师和病理科医师对该病的重视。
病历摘要
患者 男性,46岁,因头痛伴言语不清3天,于2018年4月13日入院。患者入院前3天无明显诱因出现头痛,表现为全头部疼痛,尤以左侧颞部显著,呈持续性进展,无法缓解,伴头晕和言语不清,呕吐1次,呈非喷射状,呕吐物为胃内容物,无视物旋转、意识障碍、四肢抽搐等表现,未予特殊处理。头痛症状进行性加重,至当地医院急诊就诊,头部CT显示左侧颞叶出血,CT检查后突发意识障碍,伴四肢抽搐、双眼凝视,持续数分钟后自行缓解,发作后精神差;进一步行MRI检查,提示左侧颞叶占位性病变并出血可能,临床诊断为“左侧颞枕叶肿瘤并出血可能”。为求进一步诊断与治疗,至我院门诊就诊,以“颅内占位性病变”收入神经外科。患者自发病以来,精神、睡眠、饮食欠佳,大小便正常,体重无明显减轻。
既往史、个人史及家族史 吸烟史20余年,约20支/d,余既往史、个人史及家族史无特殊。
诊断与治疗经过 入院后体格检查:体温36.5℃,呼吸20次/min,脉搏为71次/min,血压为133/86 mm Hg(1 mm Hg=0.133 k Pa),心、肺、腹部查体未见异常;神志清楚,言语含糊,对答错误,记忆力下降,脑神经检查未见异常,四肢肌力5级、肌张力正常,共济运动和感觉系统检查未见异常,Romberg征阴性,四肢腱反射正常,双侧病理征阴性,脑膜刺激征阴性。实验室检查:血常规白细胞计数16.80×109/L[(4~10)×109/L],中性粒细胞比例80.50%(50%~70%);血浆纤维蛋白原(FIB)为5.20 g/L(2~4 g/L),降钙素原(PCT)0.06 ng/ml(0~0.05 ng/ml),D-二聚体为2.13 mg/L(0~0.55 mg/L)。腰椎穿刺脑脊液检查蛋白定量为520 mg/L(150~450 mg/L),氯化物119.60mmol/L(120~130mmol/L);肌酸激酶(CK)8.40 U/L(0~0.60 U/L),乳酸脱氢酶(LDH)28.10 U/L(10~25 U/L);细胞学检查未见异形细胞,细菌、真菌培养阴性。外院影像学检查结果请我院影像科会诊,MRI可见左侧颞叶后部团片状长T1、长T2信号为主的混杂信号影,其内似可见小液液平,增强扫描强化不明显,邻近脑沟、脑裂可见线样强化和脑膜强化(图1a,1b),T1WI可见上矢状窦血栓呈高信号(图1c);MRV显示左侧横窦、乙状窦未见显影(图1d)。考虑左侧上矢状窦、横窦、乙状窦血栓形成,进而认为左侧颞叶后部混杂信号影为继发性静脉淤滞性缺血性卒中出血性转化。胸部CT显示,双肺下叶后基底段斑片状高密度影,边界模糊,邻近胸膜稍增厚,考虑双肺下叶后基底段少许坠积性肺炎(图2)。临床诊断为左侧颞叶占位性病变,遂于2018年4月16日在全身麻醉下行左侧颞叶占位性病变切除术及颅内压监测探头置入术,术中可见局部暗红色坏死脑组织与硬脑膜粘连明显,显露左侧颞叶血肿和坏死组织,质地柔软,血运一般;手术显微镜下可见血管内血栓形成,边界欠清晰,清除血肿和坏死组织。手术标本行HE染色及免疫组化染色。(1)大体标本观察:手术切除标本为灰黄、灰褐色不规则破碎脑组织一堆,大小约3.50 cm×3.00 cm×2.00 cm,切面呈灰白色,质地柔软,局部可见出血,未见坏死。以质量分数为4%的甲醛溶液浸泡固定,常规脱水、石蜡包埋,制备层厚4μm的组织切片。(2)HE染色:光学显微镜观察,脑组织结构疏松、解离、坏死,可见皮质内灶性出血,小血管增生(图3a),神经细胞明显减少,残留神经细胞呈缺氧性改变(图3b),胶质纤维空泡化,可见大量富含脂质的吞噬细胞浸润(图3c),血管周围淋巴细胞浸润“淋巴袖套”形成(图3d);蛛网膜下腔浅静脉管腔内可见混合血栓形成(图3e)。(3)免疫组化染色:Roche-Ventana全自动免疫组化检测仪购自瑞士Roche公司,采用SP法进行检测。检测用抗体包括CD68(批号2020013075,滴度1∶100)、CD163(批 号2019030603,滴 度1∶100)、CD3(批 号2020030020,滴度1∶100)、CD20(批号2019031802,滴度1∶100)、P53(批号2020111101,滴度1∶100)、Ki-67抗原(批号2021031501,滴度1∶100),购自基因科技(上海)股份有限公司;胶质纤维酸性蛋白(GFAP;批 号20200323,滴 度1∶100)、CD31(批号21020704,滴度1∶100)、神经微丝蛋白(NF;批号18080823,滴度1∶100)、异柠檬酸脱氢酶1(IDH1;批号202103001,滴度1∶100),购自北京中杉金桥生物技术有限公司。结果显示,病灶细胞GFAP呈阳性,提示为反应性增生的神经胶质细胞(图4a);CD31呈阳性,提示为血管内皮细胞(图4b);CD163和CD68呈阳性,提示为组织细胞;CD3和CD20呈阳性,提示为淋巴细胞;NF呈阳性,并可见神经轴索相对保留完好(图4c);IDH1和P53呈阴性,Ki-67抗原标记指数约5%(主要为淋巴细胞阳性)。(4)髓鞘染色:检测试剂盒购自广州维格斯生物科技有限公司(批号19011101),按照试剂盒说明书进行试剂配制及染色,结果显示,无明显髓鞘脱失(图5)。最终病理诊断为大脑浅静脉血栓形成;亚急性期缺血性卒中出血性转化。术后予低分子量肝素(LMWH)0.50 ml/次、2次/d静脉注射和华法林3.75 mg/d口服抗凝、银杏内酯10 ml/d静脉滴注改善循环等对症支持治疗。患者共住院12天,出院时自诉无特殊不适,无头晕头痛、恶心呕吐,精神、睡眠、饮食可,体格检查无明显异常,实验室复查血浆D-二聚体水平为0.59 mg/L。出院后继续服用华法林1.875 mg/次、2次/d序贯抗凝治疗9个月,同时联合康复治疗。出院后常规门诊复诊,于2021年5月24日复查时,一般情况尚可,日常生活可自理,语言、运动不受限,主要遗留症状性局灶性癫发作,1次/月,每次持续数十秒,发作之前自觉不适(具体描述不清),意识转清后未诉特殊不适;嘱持续服用华法林1.875 mg/d抗凝、奥卡西平0.45 g/次、2次/d和奥拉西坦0.80 g/次、2次/d抗癫治疗,定期门诊复诊。

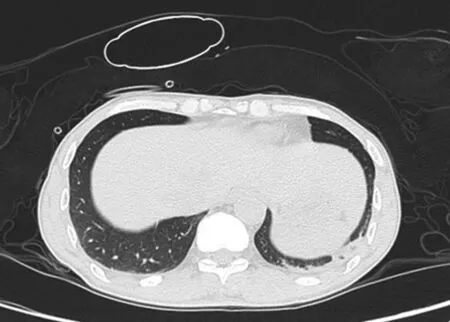
图1 头部MRI所见 1a 横断面T1WI显示,左侧颞叶后部占位性病变呈不均匀低信号(箭头所示) 1b 冠状位T2WI显示左侧颞叶后部病变呈高低混杂信号(箭头所示) 1c 横断面T1WI显示,上矢状窦血栓呈高信号(箭头所示) 1d MRV显示左侧横窦和乙状窦未见明显流空影 图2胸部CT显示,双肺下叶后基底段斑片状高密度影,边界欠清晰,邻近胸膜稍增厚Figure 1 Head MRI findings Axial T1WI showed the posterior lesion of the left temporal lobe uneven hypointensity(arrow indicates,Panel 1a).Coronal T2WI showed the posterior lesions of the left temporal lobe showed mixed signals(arrow indicates,Panel 1b).Axial T1WI showed hyperintensity in the superior sagittal sinus thrombosis(arrow indicates,Panel 1c).MRV showed the left transverse sigmoid sinus were not visible (Panel 1d).Figure 2 Chest CT showed patchy increased density was seen in the posterior basal segment of the lower lobes of both lungs,the boundary was blurred,and the adjacent pleura was slightly thickened.
讨 论
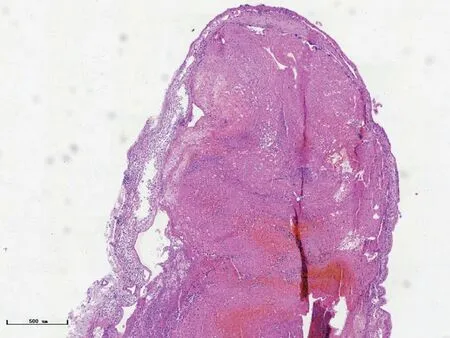
图3 光学显微镜观察所见 HE染色 3a 脑组织结构疏松、解离、坏死,可见皮质内灶性出血,小血管增生 ×100 3b神经细胞明显减少,残留神经细胞呈缺氧性改变 ×200 3c脑组织内灶性出血,大量富含脂质的吞噬细胞浸润 ×100 3d 血管周围淋巴细胞浸润 ×100 3e 浅静脉管腔内可见混合血栓形成 ×40Figure 3 Optical microscopy findings HE staining The structure of brain was loose,dissociated,necrosis,hemorrhage in the cortex,and the vessel was proliferated(Panel 3a). ×100 Neurons decreased significantly,and the remaining neurons showed hypoxic changes(Panel 3b). ×200 Focal hemorrhage in brain parenchyma,lots of foam cells infiltration were seen(Panel 3c). ×100 Perivascular lymphocytic infiltration was seen(Panel 3d). ×100 Mixed thrombosis could be seen in the superficial vein vessel lumen(Panel 3e). ×40
颅内静脉窦血栓形成系指大脑一个或多个引流静脉或静脉窦阻塞导致的脑静脉系统疾病,临床少见,年发病率为2/1000万~5/1000万,占全部脑卒中的0.5%~1.0%[1]。发病年龄分布广,常见于中青年,多数患者发病年龄<50岁[2],女性多发[3],我国关于其流行病学统计数据相对较少,确切发病率尚不十分清楚。临床表现包括头痛、局灶性神经功能缺损、失语、吞咽困难、偏瘫、视觉障碍、遗忘症和癫发作等,其中,约80%的患者初始症状表现为头痛[4],通常为持续性,呈弥漫性或局限性,咳嗽、打喷嚏等导致颅内压升高时疼痛加剧。研究认为,颅内静脉窦血栓形成后可直接增加微静脉和毛细血管压力,造成脑脊液吸收减少,颅内压升高,进而导致脑灌注减少、血-脑屏障破坏、脑缺血性损伤或脑实质出血[5],故其临床表现取决于静脉窦血栓形成的部位、性质、程度以及继发性脑损伤程度。本文患者初始症状即为无法缓解的全头部疼痛,伴头晕和言语不清,且随病程进展逐渐加重,出现癫发作,推测随着病情进展,脑组织缺血、缺氧导致神经元损伤、丢失是颅内静脉窦血栓形成致癫发作的主要原因。

图4 光学显微镜观察所见 免疫组化染色(SP法) 4a GFAP呈阳性提示为反应性增生的神经胶质细胞 ×100 4b CD31呈阳性提示为血管内皮细胞 ×40 4c NF阳性,可见神经轴索相对保留完好 ×100 图5 光学显微镜下未见髓鞘脱失 髓鞘染色 ×100Figure 4 Optical microscopy findings Immunohistochemical staining(SP) GFAP was positive,suggesting reactive proliferation of glial cells(Panel 4a). ×100 CD31 was positive,suggesting vascular endothelial cells(Panel 4b). ×40 NF was positive and showed that the axon was relatively well preserved(Panel 4c). ×100 Figure 5 Optical microscopy found no obvious demyelination Myelin sheath staining ×100
颅内静脉窦血栓形成的危险因素主要包括导致血液淤滞、血管内皮损伤和血液高凝状态的各种因素,也有极少数病例无明显基础疾病或者危险因素[3,6]。其中,局部感染致血管内皮损伤和促凝途径激活是重要危险因素;此外,流行病学调查显示,吸烟是导致心肌梗死的主要危险因素[7],可使血液中一氧化碳含量增加,导致血管内皮细胞缺氧性损伤、内皮功能障碍、血脂异常和血小板活性增强,进而导致血栓形成。本文患者入院时胸部CT显示双肺下叶后基底段坠积性肺炎,血常规显示白细胞计数和中性粒细胞比例均明显升高,提示存在较重的感染,加之吸烟史20余年(约20支/d),因此推测,感染和长期大量吸烟是其颅内静脉窦血栓形成的重要危险因素。目前,颅内静脉窦血栓形成的临床诊断有一定难度。影像学检查虽为最常用的诊断方法,但CT的敏感性和特异性均较低[8],MRI较CT更敏感。实验室检查方面,血浆D-二聚体异常升高可以在缺乏影像学证据的情况下超早期预测颅内静脉窦血栓形成的发生[9]。D-二聚体是一种可溶性纤维蛋白降解产物,可以作为纤溶激活和血栓形成的特异性标志物[10],同时也可以作为敏感性和特异性均较高的颅内静脉窦血栓形成超早期预测因子[11]。抗凝治疗过程中或停止治疗后,测定D-二聚体有助于对复发性静脉血栓栓塞进行风险分层,以提供个性化治疗[12]。本文患者入院时血浆D-二聚体水平明显升高,为诊断颅内静脉窦血栓形成提供重要依据,同时监测D-二聚体表达变化也有助于确定后续溶栓治疗的时间及效果评估。
鉴别诊断方面,颅内静脉窦血栓形成应注意与以下疾病相鉴别。(1)中枢神经系统脱髓鞘疾病:发病年龄相对更年轻;组织学形态较少见组织坏死,常见血管周围淋巴“袖套”,典型病理特征为髓鞘脱失病灶内轴索相对保留完好,周围浸润的巨噬细胞胞质内可见被吞噬的髓鞘碎片,常可见具有诊断意义的含多个小核的反应性星形细胞(Creutzfeldt星形细胞);对激素治疗更敏感。(2)原发性中枢神经系统血管炎(PACNS):血管造影可见多灶性、节段性狭窄、扩张,或软脑膜中小动脉呈“串珠状”等典型改变;典型组织学形态为软脑膜和皮质浅层中小血管节段性坏死或肉芽肿性血管炎,血管周围2层以上的成熟淋巴细胞浸润,管壁模糊不清,并在明显增厚的内膜中可见多核巨细胞,此外还可见脑水肿、缺血及噬神经细胞现象等。(3)高级别胶质瘤:影像学鉴别诊断颅内静脉窦血栓形成与高级别胶质瘤较为困难,二者均表现为明显的占位效应;组织学形态,高级别胶质瘤表现为正常脑组织结构破坏,肿瘤细胞浸润性生长,细胞密度高,异型性明显,核分裂象活跃,以及微血管增生和坏死;免疫组化染色可资鉴别。
抗凝治疗是颅内静脉窦血栓形成最常用的治疗方法[5],急性期静脉注射普通肝素(UFH)或皮下注射低分子量肝素抗凝,急性期后,再服用华法林等序贯抗凝至少3~6个月。前瞻性随机对照临床试验显示,华法林预防复发性颅内静脉窦血栓形成安全、有效[13]。预后方面,由于脑静脉与硬脑膜静脉窦之间存在多支吻合,因此临床表现和预后差异较大,从症状完全缓解至永久性神经功能缺陷甚至因脑卒中和脑水肿死亡,病死率为5%~15%,有35%~85%的患者完全康复[14-15]。由此可见,预后主要取决于颅内静脉窦血栓形成部位和侧支代偿情况,预后不良危险因素包括高龄、昏迷、颅内压明显升高、感染或恶病质、顽固性癫发作、肺栓塞等。
通过总结1例颅内静脉窦血栓形成患者的临床病理学特征,以期提高临床和病理科医师对该病的认识及重视,影像学或临床未能及时正确诊断时,病理学检查应严守诊断的最后一关,尽可能做到早诊断,以为及时进行抗凝治疗争取时间,从而改善患者预后。
利益冲突无
