乙二胺四乙酸(EDTA)改性磁性壳聚糖对Cd2+的吸附性能
2021-04-10吴占超匡少平
于 硕,吴占超,匡少平
(青岛科技大学 化学与分子工程学院,山东青岛266042)
现代工业领域产生的有毒金属离子对水体的污染会导致严重的环境问题和毒理学问题[1-3]。在众多的有毒金属中,Cd2+被认为是最剧毒的一种。它很容易在人体的各个器官中积累,对人体造成严重的伤害,微量的Cd2+就会导致肝脏、肾脏、神经和心血管系统疾病[4-5]。因此,通过合适的方法从污染水体中去除Cd2+是目前最重要的研究课题之一。
目前处理污染水体的方法主要有离子交换、化学沉淀、膜过滤[6]、溶剂萃取[7]、电化学处理[8]和吸附[9]。吸附法由于操作简单,能耗最低,成本低,甚至对低浓度的重金属离子的吸附效率也很高,被认为是最好的方法之一。吸附法体现出的这些优点在很大程度上归因于吸附剂,在各种吸附剂中,壳聚糖由于其可生物降解、抗菌[10]、亲水[11]、可再生、生物相容性和环保等优势被广泛应用于重金属离子的去除。但是,由于其在低于5.5的p H下具有高溶解性,因此传统分离方法很难分离和回收。壳聚糖和磁性成分的结合可以有效地解决这个缺点。另外,为了进一步提高磁性壳聚糖对重金属离子的吸附能力,需要对壳聚糖表面进行修饰改性,以引入更多对重金属离子具有更大吸附能力的官能团。目前对壳聚糖进行接枝改性是改进壳聚糖吸附性能的有效途径。将具有不同功能的基团(如:羧基,氨基或含硫基)接枝到壳聚糖分子中,可以改进壳聚糖的结构和性质,增加壳聚糖的吸附位点数量[12-13]。乙二胺四乙酸(EDTA)拥有丰富的氨基和羧基并以其具有高效的金属螯合能力而著称,将其接枝于壳聚糖将大大提高磁性壳聚糖吸附剂的吸附性能。
本工作制备了EDTA改性的磁性壳聚糖并用其对Cd2+进行了吸附性能研究,通过改变初始p H,时间,溶液浓度,温度等优化吸附剂的最佳使用条件,通过动力学模型和等温线模型研究吸附剂的吸附行为。
1 实验部分
1.1 试剂与仪器
壳聚糖(CS),脱乙酰度≥90%,上海蓝季科技发展有限公司;四氧化三铁,化学纯CP,国药集团化学试剂有限公司;乙酸,分析纯AR,国药集团化学试剂有限公司;戊二醛,分析纯AR,罗恩试剂;乙二胺四乙酸二钠盐(C10H14N2Na2O8·2 H2O),分析纯AR,国药集团化学试剂有限公司;1-乙基-(3-二甲基氨基丙基)碳二亚胺盐酸盐(EDC),98%,罗恩试剂;N-羟基琥珀酰亚胺(NHS),98%,罗恩试剂;硝酸镉,四水合物,分析纯AR,麦克林试剂。
数显酸度计,PHS-25C型,杭州奥利龙仪器有限公司;精密增力电动搅拌器,JJ-1/200A型,常州丹瑞实验仪器设备有限公司;真空干燥箱,DZF-6020型,上海一恒科学仪器有限公司;电热恒温水浴锅,HWS-11型,上海尚道仪器制造有限公司;X射线衍射仪,D-MAX 2500/PC型,日本理学株式会社;红外光谱仪,510P FT-IR型,美国Nicolet公司;冷场发射扫描电子显微镜,JSM-6700F型,日本Hitachi公司;热重分析仪,TG209-F1型,德国Match公司;原子吸收分光光度计,AA-7000型,日本岛津公司。
1.2 EDTA-CS/Fe3 O4的制备
将0.3 g壳聚糖溶于30 m L 3%(质量分数)的乙酸溶液中,然后通过机械搅拌将0.1 g Fe3O4完全分散在壳聚糖溶液中。将2.0 m L戊二醛加入混合溶液中并在60℃下搅拌2 h。将产物依次用乙醇和去离子水洗涤数次置于50℃真空干燥箱干燥12 h。最后,将所得产物研磨通过150目标准筛(粒径100μm)筛分。制得CS/Fe3O4。
将2 g Na2EDTA溶于40 m L去离子水中,加入0.1 g EDC和0.2 g NHS搅拌2 h,之后加入所制备的CS/Fe3O4复合物0.2 g继续搅拌4 h。将得到的黑色产物去离子水洗涤数次后50℃下真空干燥[14]。制得EDTA-CS/Fe3O4。
合成路线示意图见图1。
1.3 样品的表征
1.3.1 X射线衍射分析
分别取1~2 g经过干燥处理的CS,Fe3O4,CS/Fe3O4以及EDTA-CS/Fe3O4样品,将其用研钵研细后用X-射线衍射分析仪在工作电压为40 k V,工作电流为150 m A的条件下进行表征测试。
1.3.2 红外光谱分析
将1~2 mg CS,Fe3O4,CS/Fe3O4以及EDTACS/Fe3O4样品干燥处理后分别与200 mg干燥的纯KBr粉末研细均匀,置于模具中,在油压机上压成透明薄片用红外光谱仪进行表征测试。
1.3.3 扫描电镜分析
将EDTA-CS/Fe3O4样品用无水乙醇洗涤干燥后进行喷金制样,用冷场发射扫描电子显微镜观察样品的结构与形貌。
1.3.4 热重分析
取10 mg EDTA-CS/Fe3O4样品在氮气的氛围条件下用热重分析仪进行热重分析。测试的温度范围是室温至900℃,升温速率是10℃·min-1。
1.4 对Cd2+的吸附实验
在设定p H,时间,Cd2+初始质量浓度,温度等初始条件下进行吸附实验,用火焰原子吸收分光光度计测定达到吸附平衡时Cd2+的质量浓度,根据吸附前后Cd2+浓度的变化得到吸附量。计算公式如式(1)所示:

其中:Q是吸附剂对Cd2+的吸附量,mg·g-1;ρ0和ρe是吸附前后溶液中Cd2+的质量浓度,mg·L-1;V是Cd2+溶液的体积,L;m是吸附剂的质量,g。
1.4.1 p H的影响
配制质量浓度100 mg·L-1不同p H的Cd2+溶液各20 m L,上述溶液均加入10 mg EDTA-CS/Fe3O4,将溶液在25℃下振荡吸附。当吸附达到平衡以后,磁性分离吸附剂取上层清液用原子吸收分光光度计测定吸附后重金属离子的浓度。
1.4.2 吸附时间的影响
配制质量浓度100 mg·L-1,p H=5的Cd2+溶液20 m L,加入10 mg EDTA-CS/Fe3O4,将溶液在25℃下振荡吸附,每隔一段时间用磁铁分离吸附剂取上层清液用原子吸收分光光度计测定吸附后重金属离子的质量浓度。
1.4.3 初始质量浓度的影响
配制p H=5,质量浓度为50,100,150,200,250,300 mg·L-1的Cd2+溶液各20 m L,上述溶液均加入10 mg EDTA-CS/Fe3O4,将溶液在25℃下振荡吸附。当吸附达到平衡以后,磁性分离吸附剂取上层清液用原子吸收分光光度计测定吸附后重金属离子的质量浓度。
1.4.4 温度的影响
配制3份质量浓度100 mg·L-1,p H=5的Cd2+溶液各20 m L,加入10 mg EDTA-CS/Fe3O4,将溶液在不同温度下(15,25,35℃)振荡吸附,当吸附达到平衡以后,磁性分离吸附剂取上层清液用原子吸收分光光度计测定吸附后重金属离子的质量浓度。
1.5 吸附剂再生
将吸附后的吸附剂加入到20 m L 0.1 mol·L-1Na2EDTA洗脱液中超声处理10 min,然后在25℃下振荡脱附4 h,最后在外部磁场的作用下收集吸附剂,用去离子水洗涤数次后50℃真空干燥用于下一轮吸附。
2 结果与讨论
2.1 吸附剂的表征
2.1.1 XRD谱图表征
图2为Fe3O4,CS,CS/Fe3O4,和EDTA-CS/Fe3O4的XRD谱图。
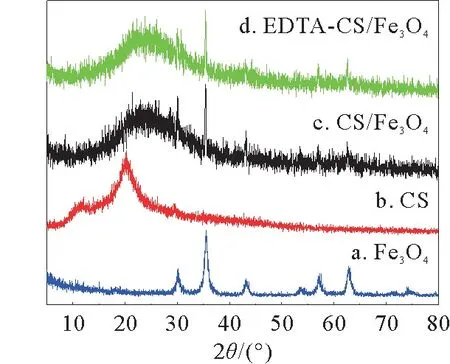
图2 Fe3 O4,CS,CS/Fe3 O4和EDTA-CS/Fe3 O4的XRD谱图Fig.2 XRD spectra of Fe3 O4,CS,CS/Fe3 O4 and EDTA-CS/Fe3 O4
由图2可知:CS的衍射峰在2θ=10°和20°处。CS/Fe3O4和EDTA-CS/Fe3O4在2θ=10°处的衍射特征峰消失,在2θ=20°处的衍射特征峰有所减弱,这是由于戊二醛、EDTA、四氧化三铁的引入破坏了CS的结构有序度,导致其结晶度降低,然而壳聚糖的非晶型结构更有利于重金属离子的吸附。CS/Fe3O4和EDTA-CS/Fe3O4中出现了几个新的衍射特征峰,这几个峰的位置与四氧化三铁衍射特征峰的位置一一对应,强度有所下降,说明吸附剂中成功引入了四氧化三铁。
2.1.2 红外光谱分析
图3为CS,CS/Fe3O4和EDTA-CS/Fe3O4的红外谱图。从图3中可以看出:对于CS,在3 445 cm-1处是N—H键的特征吸收峰,2 920,2 847 cm-1处是C—H键的不对称与对称伸缩振动特征吸收峰。对于CS/Fe3O4,CS的特征峰出现并有所减弱,在564 cm-1处出现了一处新的特征吸收峰,这是Fe—O键的特征吸收峰,说明磁性壳聚糖复合物的成功制备。对于EDTA-CS/Fe3O4,在1 639和1 558 cm-1处出现了两处新的特征吸收峰,这是酰胺键中的羰基伸缩振动和酰胺的N—H弯曲振动特征吸收峰,表明EDTA通过酰胺化反应成功接枝到CS的氨基上。1 406 cm-1处的特征吸收峰是COO-中C—O键的伸缩振动特征吸收峰,这进一步说明了EDTA中的羧基引入了磁性壳聚糖。
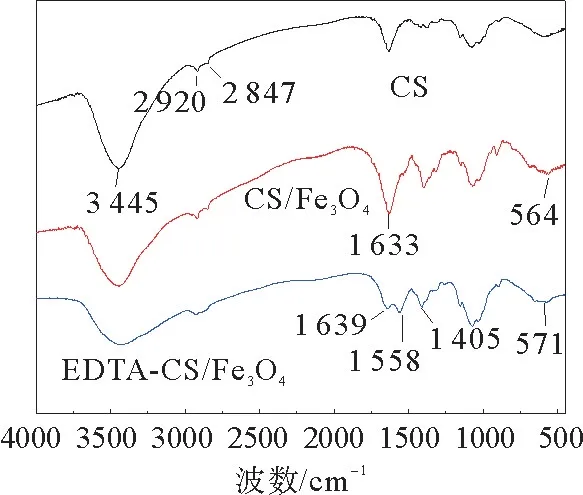
图3 CS,CS/Fe3 O4和EDTA-CS/Fe3 O4的红外谱图Fig.3 Infrared spectra of CS,CS/Fe3 O4 and EDTA-CS/Fe3 O4
2.1.3 扫描电子显微镜分析
图4是EDTA改性磁性壳聚糖扫描电子显微镜照片。从图4中可以看出,吸附剂是形状较为不规则的块状结构,粒径在50~100μm之间。由于交联剂的加入,吸附剂颗粒之间出现了黏连现象。吸附剂表面有丰富的孔隙,这有助于增大吸附剂的吸附能力。

图4 EDTA-CS/Fe3 O4的扫描电镜照片Fig.4 SEM images of EDTA-CS/Fe3 O4
2.1.4 热重分析
图5是EDTA改性磁性壳聚糖的TG和DTG曲线图。从图5中可以看出,在25~200℃左右,TG曲线有小幅降低的现象,这是吸附剂的脱水阶段,失重率约为10%。200~620℃,CS和EDTA等有机组分迅速分解,失重率约在54%左右。在620℃以后,随着温度的升高,吸附剂还有平缓的失重现象,失重率约在10%,这可能是有机成分降解后生成的难降解物进一步降解造成的。Fe3O4在N2的保护作用下不会分解,含量约为26%。

图5 EDTA-CS/Fe3 O4的热重曲线Fig.5 Thermogravimetric curve of EDTA-CS/Fe3 O4
2.2 Cd2+吸附的影响因素
2.2.1 p H的影响
图6为初始p H对吸附量的影响曲线。从图6可以看出:p H从1增加至2,吸附量略微有所增加,p H在2~5的过程中,吸附量迅速增加。在低p H条件下,由于质子化作用导致氨基与Cd2+发生静电排斥作用,因此吸附能力非常弱。随着p H值的增加,质子化作用减弱,吸附剂可以提供更多的吸附位点,吸附能力增强。在p H=5时,吸附剂的吸附量最大,最大值为122.44 mg·g-1。
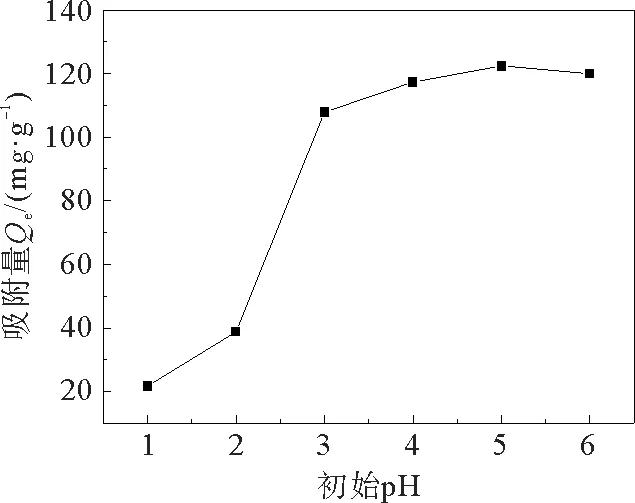
图6 初始p H对吸附量的影响Fig.6 Effect of initial p H on adsorption capacity
2.2.2 吸附时间的影响和吸附动力学
吸附时间对吸附量的影响如图7所示。从图7中可以看出:在30 min之前,吸附量随着吸附时间的增加快速增加。30 min之后,吸附量几乎不再变化,吸附剂在30 min左右达到了吸附平衡,平衡吸附量为122.44 mg·g-1。
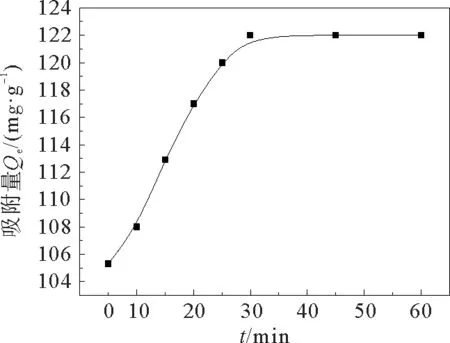
图7 吸附时间对吸附量的影响Fig.7 Effect of time on adsorption capacity
为了研究吸附剂的吸附行为和限速步骤,引入了一级动力学,二级动力学和分子内扩散模型,线性拟合的结果如图8所示,动力学参数列于表1。式(2)、(3)、(4)分别是一级动力学,二级动力学和分子内扩散模型的方程式。
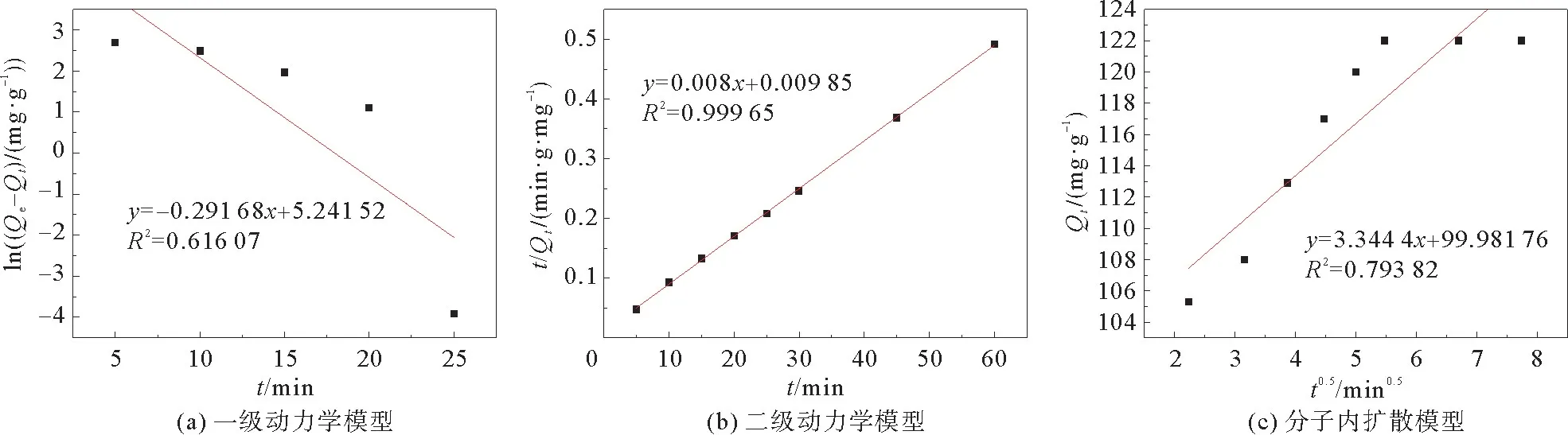
图8 一级动力学模型,二级动力学模型和分子内扩散模型Fig.8 First-order kinetic model,second-order kinetic model and intramolecular diffusion model
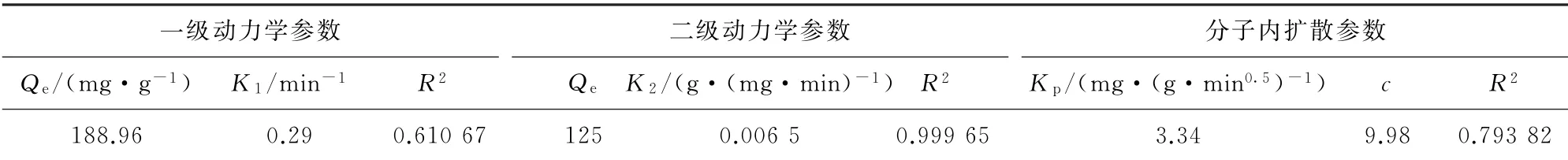
表1 EDTA-CS/Fe3 O4的吸附动力学参数Table 1 Adsorption kinetic parameters of EDTA-CS/Fe3 O4
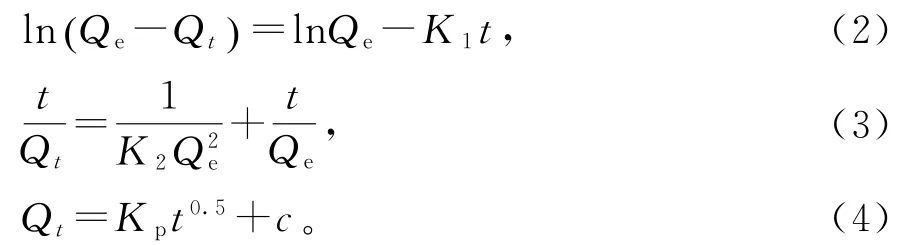
其中:Qt和Qe分别是t时刻和吸附平衡时的吸附量,mg·g-1;K1是一级动力学吸附速率平衡常数,min-1;t是吸附时间,min;K2是二级动力学吸附速率平衡常数,g·(mg·min)-1;Kp是分子扩散速率常数,mg·(g·min0.5)-1。
对比图8中一级、二级动力学和分子内扩散模型的线性拟合结果可以看出,一级动力学模型和分子内扩散模型的线性拟合数据不在一条直线上,有较大的偏离,而二级动力学模型的线性拟合数据基本在一条直线上。说明吸附剂的吸附行为符合二级动力学吸附机制,分子扩散不是速率控制步骤,速率控制步骤是化学吸附作用。表1中的二级动力学吸附参数Qe与实验值(122.44 mg·g-1)相差不大,R2=0.999 65>0.95,这进一步说明了吸附行为符合二级动力学吸附机制。
2.2.3 初始浓度的影响和吸附等温线
图9是不同初始浓度对吸附量的影响。
从图9中可以看出:随着初始浓度的增加,平衡吸附量逐渐增加。在初始浓度达到200 mg·L-1时吸附达到饱和,再增加初始浓度,吸附量几乎不变。吸附剂在p H=5,T=298 K,t=30 min,ρ0=200 mg·L-1的条件下,饱和吸附量为176.32 mg·g-1。
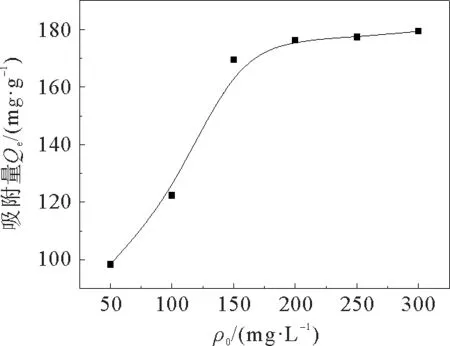
图9 初始质量浓度对吸附量的影响Fig.9 Effect of initial concentration on adsorption capacity
本研究采用了Freundlich等温线和Langmuir等温线模型(图10)来研究溶液中金属离子与吸附剂之间的相互作用,其参数汇总在表2中。方程式(5),(6)是Freundlich等温线和Langmuir等温线的方程式。
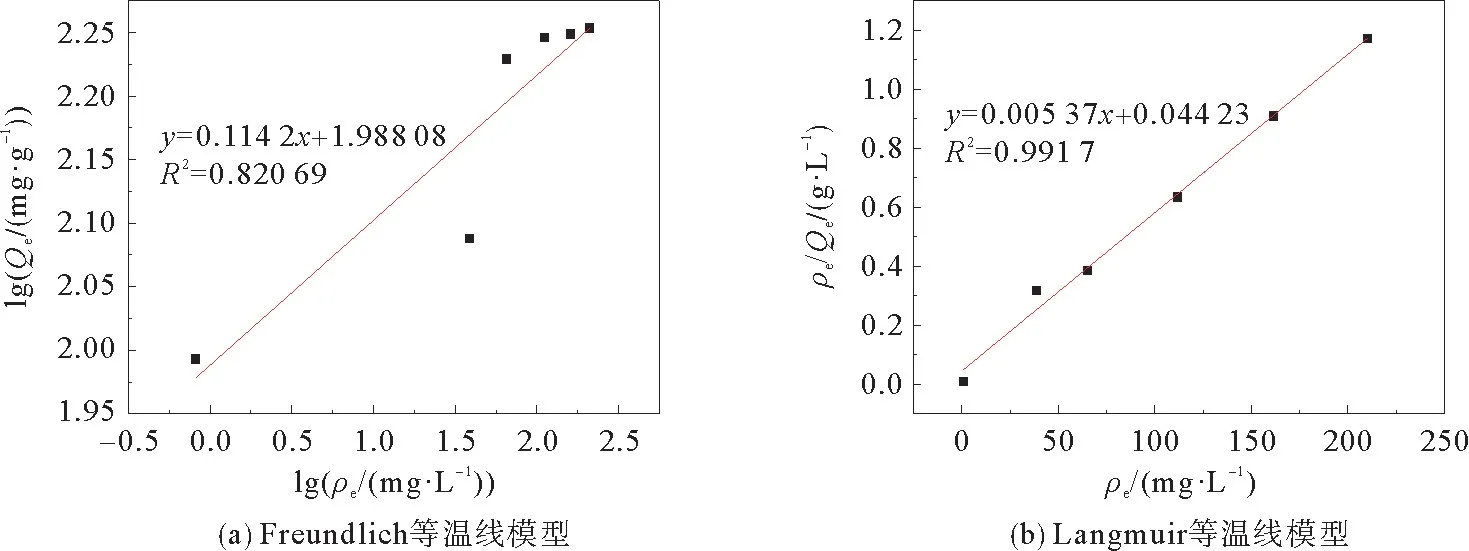
图10 Freundlich等温线模型和Langmuir等温线模型Fig.10 Freundlich isotherm model and Langmuir isotherm model
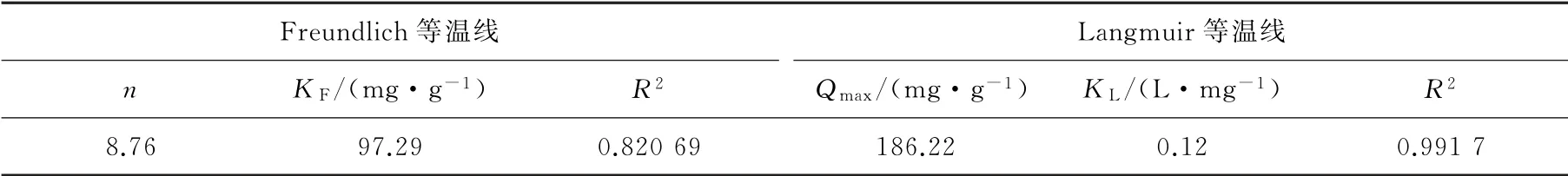
表2 EDTA-CS/Fe3 O4的吸附等温线参数Table 2 Adsorption isotherm parameters of EDTA-CS/Fe3 O4
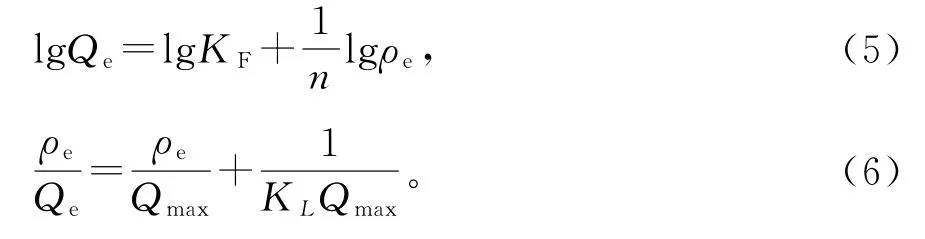
其中:Qe是吸附平衡时的吸附量,mg·g-1;ρe是吸附平衡时溶液中Cd2+的质量浓度,mg·L-1;KF和n均是Freundlich常数,KF的单位是mg·g-1;Qmax是最大吸附量,mg·g-1;KL是Langmuir吸附平衡常数,L·mg-1。
从图10看出:与Freundlich等温线模型相比,Langmuir等温线模型可以与实验数据得到更好的拟合。表2中的Langmuir吸附等温线参数Qmax=186.22 mg·g-1与实验值(176.32 mg·g-1)基本一致,R2=0.991 7>0.95,这说明了吸附剂的吸附机制与Langmuir等温线模型相符合,对Cd2+的吸附是以单层吸附为主。
2.2.4 温度的影响和吸附热力学
为了研究吸附剂的热力学性质,进行了不同温度下(288,298,308 K)的吸附实验。通过Van′t Hoff方程(7)和等式(8)获得热力学参数。
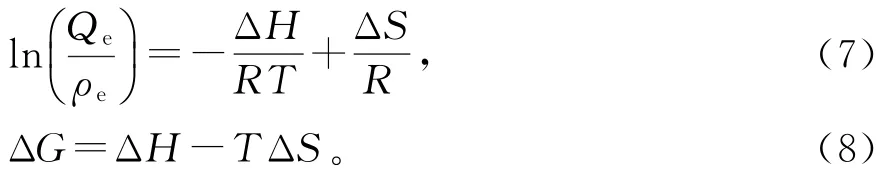
其中:R为理想气体常数,8.314 J·(mol·K)-1;T是热力学温度,K;ΔH是吸附焓,kJ·mol-1;ΔS是吸附熵,J·(mol·K)-1;ΔG是吉布斯吸附自由能,kJ·mol-1。
图11是Van′t Hoff方程中ln(Qe/ρe)对T-1作的图。由图11直线的斜率和截距可以计算出ΔH和ΔS,进而由式(8)可以计算出ΔG,结果见表3。
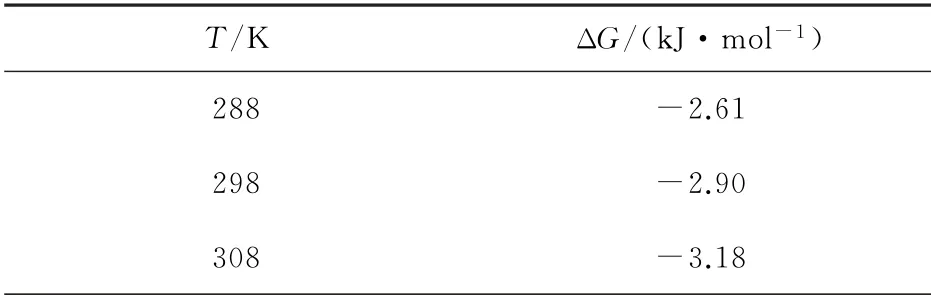
表3 不同温度下的热力学参数Table 3 Thermodynamic parameters at different temperatures
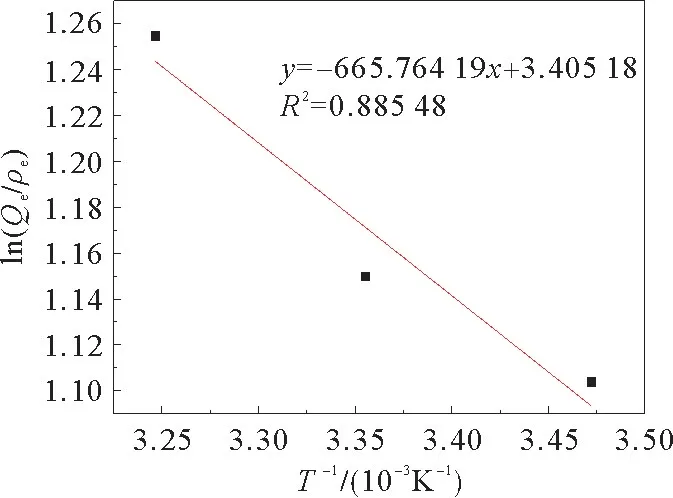
图11 Van′t Hoff方程中ln(Qe/ρe)-T-1图Fig.11 ln(Q e/ρe)-T-1 in the Van′t Hoff equation
表3中是不同温度下的热力学参数。ΔG均为负值,说明吸附过程是自发的。ΔG随温度的升高而降低,说明较高的温度有利于吸附剂的吸附。ΔH的正值说明吸附的吸热性质。ΔS为正值说明随着吸附剂与Cd2+的结合,固/液界面处的随机性增加[15]。
通过表4数据可以发现:与已报道的CS/SiO2/Fe3O4(CMS)和EDTA修饰的CS/SiO2/Fe3O4(EDCMS)吸附剂[15]相比,本工作制备的EDTAFe3O4/CS对Cd2+的吸附表现出了更大的吸附容量和更短的吸附平衡时间,因此具有更优异的吸附性能。
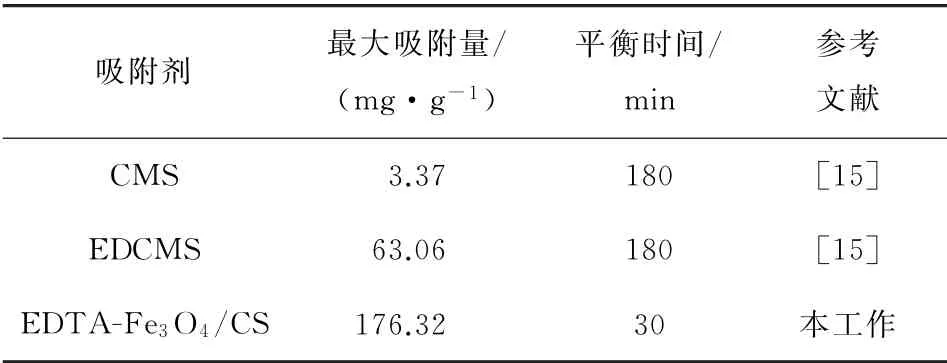
表4 不同吸附剂对Cd2+吸附性能比较Table 4 Comparison of Cd2+adsorption performance by different adsorbents
2.3 吸附剂的再生
在实际的废水处理中,吸附剂的再生吸附性能,直接影响吸附剂对重金属离子的吸附效率和投入成本。为了测试吸附剂的再生吸附性能,我们将吸附过Cd2+的吸附剂加入到Na2EDTA洗脱液中进行解吸,在外部磁场的作用下收集吸附剂,用去离子水洗涤数次后50℃真空干燥用于下一轮吸附。如图12所示,吸附剂经过5次吸附-脱附过程对Cd2+的吸附量为93.48 mg·g-1,仍然可以达到第一次吸附量的76.3%,这说明吸附剂有较好的再生吸附性能。
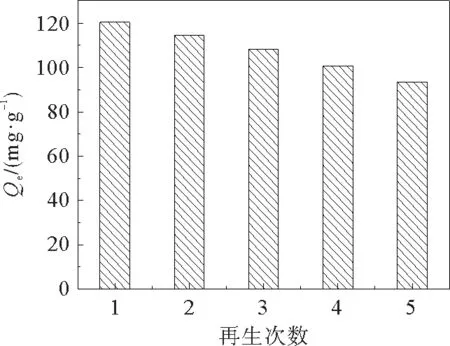
图12 吸附剂再生次数对吸附量的影响Fig.12 Effect of regeneration times of adsorbent on adsorption capacity
3 结 论
采用戊二醛交联反应和酰胺化反应制备了乙二胺四乙酸(EDTA)改性的磁性壳聚糖,采用X射线衍射,红外光谱,扫描电镜和热重分析对样品进行了表征和测试。测试结果表明:成功制备了EDTA改性的磁性壳聚糖的目标产物。研究了吸附剂对Cd2+的吸附能力,实验结果表明吸附剂在p H=5,T=298 K,ρ0=200 mg·L-1,t=30 min的条件下,饱和吸附量为176.32 mg·g-1。对吸附剂的吸附行为进行了动力学、热力学以及吸附等温线模型拟合,动力学研究表明,吸附剂吸附行为符合二级动力学模型,速率控制步骤是化学吸附作用;热力学研究表明,升温有利于Cd2+的吸附;吸附等温线与Langmuir吸附等温线模型一致,吸附是以单层为主。吸附剂在吸附-脱附5次后仍有较好的吸附性能。
