miR-384靶向HTRA1影响瘢痕疙瘩成纤维细胞的增殖和凋亡
2021-04-09王东王珍刘岩
王 东 王 珍 刘 岩
沈阳市第七人民医院皮肤科,辽宁沈阳,110003
瘢痕疙瘩是皮肤损伤后伤口愈合过程异常形成的良性皮肤肿瘤,以成纤维细胞过度增殖和细胞外基质过度沉积为特征[1]。虽然瘢痕疙瘩为良性皮肤肿瘤,但其并不会随着时间推移而消退,常常伴有瘙痒和疼痛,严重影响患者身心健康。此外,瘢痕疙瘩临床治疗效果不佳,手术切除后复发率高。因此,亟需开发有效的治疗方法。微小RNA(microRNA,miRNA)是长度约为22 nt的非编码RNA,其通过与靶基因3’非翻译区结合,抑制靶基因表达,从而影响细胞增殖、代谢、凋亡等多种生理和病理过程。有证据表明miRNA表达失调有助于瘢痕疙瘩形成[2,3]。miR-384已被证实在骨肉瘤[4]、肾细胞癌[5]等恶性肿瘤中表达下调,上调其表达可降低肿瘤细胞增殖、迁移和侵袭能力,诱导细胞凋亡。然而miR-384在瘢痕疙瘩中的生物学功能尚不清楚。因此,本研究旨在通过体外细胞实验阐明miR-384在瘢痕疙瘩形成中的作用和分子机制。
1 材料与方法
1.1 实验材料 人瘢痕疙瘩成纤维细胞(keloid fibroblasts,KFBs)购于中国科学院典型培养物保藏委员会;DMEM培养液、胎牛血清为美国Hyclon公司产品;Lipofectamine 2000、Trizol试剂为美国Invitrogen公司产品;miR-384抑制物(anti-miR-384)及其对照(anti-miR-NC)、miR-384模拟物(miR-384 mimics)及其对照(miR-NC)、HTRA1小干扰RNA(si-HTRA1)及其对照(si-con)、PCR引物由广州复能基因公司提供;PrimeScript逆转录酶试剂盒、SYBR®Premix ExTaq为大连Takara公司产品;细胞计数试剂盒8(Cell count kit 8,CCK-8)、膜联蛋白V异硫氰酸荧光素/碘化丙啶(Annexin V-FITC/PI)双染法细胞凋亡检测试剂盒为上海碧云天生物技术有限公司产品;兔源高温需求因子A1(high temperature requirement A1,HTRA1)抗体、兔源Ki-67抗体、兔源增殖细胞核抗原(proliferating cell nuclear antigen,PCNA)抗体、兔源B淋巴细胞瘤-2(B-cell lymphoma-2,Bcl-2)抗体和兔源Bcl-2相关X蛋白(Bcl-2 associated X protein,Bax)抗体、山羊抗兔IgG为美国Abcam公司产品。
1.2 组织来源 45例标本取自2016年3月至2018年10月于我院住院患者成对瘢痕疙瘩组织和正常皮肤组织标本,并经我院病理科确诊。所有患者均未接受放、化疗等治疗,并排除肿瘤、家族遗传病、感染患者。其中男18例,女27例。本实验在开展前已获得每位患者知情同意,并获得我院伦理委员会批准。
1.3 细胞培养和分组 KFBs在添加10%胎牛血清的DMEM培养液中于37℃、含5% CO2的细胞培养箱中培养。根据Lipofectamine 2000使用说明书将anti-miR-NC、anti-miR-384、si-con、si-HTRA1、anti-miR-384+si-con、anti-miR-384+si-HTRA1分别转染KFBs,同时设置对照(Control)组,48 h时收集细胞,检测转染效果合格后进行后续实验。
1.4 RT-qPCR检测miR-384和HTRA1 mRNA的表达水平 采用Trizol试剂分别从人正常皮肤组织、瘢痕疙瘩皮肤组织、HSF和各组KFBs中提取总RNA。利用PrimeScript逆转录酶试剂盒合成cDNA,并利用SYBR®Premix ExTaq进行RT-qPCR检测miR-384和HTRA1 mRNA的表达水平。U6和β-actin分别作为miRNA和mRNA的内源性参照,利用2-△△Ct法计算miR-384和HTRA1 mRNA的表达量。引物序列如下:miR-384上游5′-TGTTAAATCAGGAATTTTAA-3′,下游5′-TGTTACAGGCATTATGAA-3′;U6上游5′-AAAGCAAATCATCGGACGACC-3′,下游5′-GTACAACACATTGTTTCC-TCGGA-3′;HTRA1上游 3′-TTGTTTCGCAAGCTTCCGTT-5′,下游3′-ACGTG-GGCATTTGTCACGAT-5′;β-actin:上游5′-CATGTACGTTGCTATCCAGGC-3′,下游5′-CTCCTTAATGTCACGCACGAT-3′。
1.5 CCK-8法检测细胞增殖活力 将各组KFBs接种到96孔板,接种密度为1×106cells/孔。培养48 h后,每孔加入10 μL的CCK-8溶液,培养箱孵育2 h,在450 nm波长处检测各孔细胞的吸光度值。
1.6 流式细胞术检测细胞凋亡 细胞转染48 h时,消化后收集悬浮细胞,预冷的PBS液洗涤细胞后,加入结合缓冲液制备细胞密度为1×106cells/mL的单细胞悬液。取100 μL细胞悬液,分别加入5 μL的Annexin V-FITC混匀后,室温避光孵育15 min,再加入5 μL的PI染色,流式细胞仪检测细胞凋亡。
1.7 Western Blot检测HTRA1、Ki-67、PCNA、Bcl-2、Bax蛋白表达 采用RIPA裂解缓冲液提取人正常皮肤组织、瘢痕疙瘩皮肤组织、HSF和各组KFBs的总蛋白,二喹啉甲酸蛋白检测试剂盒进行定量。利用十二烷基硫酸钠聚丙烯酰胺凝胶电泳分离细胞蛋白,转移到聚偏二氟乙烯膜上。5%脱脂奶室温封闭膜1 h,洗膜后,用稀释的一抗溶液4℃孵育膜过夜,洗膜后,加入稀释的二抗室温孵育膜1 h。使用增强型化学发光试剂显影,Image J软件分析目的蛋白的灰度值,以β-actin为内参,计算其相对表达水平。
1.8 双荧光素酶报告基因实验 含有miR-384结合位点的野生型(WT-HTRA1)或含有miR-384结合位点突变序列的突变型(MUT-HTRA1)荧光素酶报告基因载体由广州复能基因公司提供。利用脂质体转染法将miR-384 mimics、miR-NC分别与WT-HTRA1或MUT-HTRA1共转染KFBs,48 h后,采用双荧光素酶报告系统测定各组KFBs荧光素酶活性。同时将miR-384 mimics、miR-NC分别转染KEIFIB细胞,48 h后,RT-qPCR和Western Blot检测HTRA1的表达水平。
2 结果
2.1 miR-384和HTRA1在人瘢痕疙瘩成纤维细胞和组织中的表达情况 如表1和图1所示,相较于人正常皮肤成纤维细胞HSF,人瘢痕疙瘩成纤维细胞中miR-384的表达量显著降低,HTRA1 mRNA和蛋白表达量显著升高(P<0.05)。如表2和图2所示,相较于正常皮肤组织,人瘢痕疙瘩组织中miR-384的表达量显著降低,HTRA1 mRNA和蛋白表达量显著升高(P<0.05)。

表1 qRT-PCR和western blot检测人瘢痕疙瘩成纤维细胞中miR-384、HTRA1 mRNA和蛋白的表达
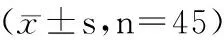
表2 qRT-PCR和Western Blot检测人瘢痕疙瘩组织中miR-384、HTRA1 mRNA和蛋白的表达
2.2 miR-384敲减对KFBs增殖和凋亡的影响 如表3、4和图3、4所示,与对照组和转染anti-miR-NC比较,转染anti-miR-384后KFBs miR-384表达量显著降低,细胞活力显著增加,细胞凋亡率显著降低,Ki-67、PCNA和Bcl-2蛋白的表达显著升高,Bax蛋白的表达显著降低(P<0.05)。

表3 miR-384敲减对KFBs增殖和凋亡的影响

表4 miR-384的敲减对KFBs增殖和凋亡相关蛋白表达的影响
2.3 miR-384靶向负调控HTRA1 生物信息学分析工具ENCORI在线预测显示miR-384与HTRA1之间存在相互作用,见图5。双荧光素酶报告实验验证二者靶向关系显示,miR-384 mimics和WT-HTRA1共转染组KFBs荧光素酶活性与miR-NC和WT-HTRA1共转染组比较显著降低(P<0.05);miR-384 mimics和MUT-HTRA1共转染组KFBs荧光素酶活性与miR-NC和MUT-HTRA1共转染组比较无明显变化,见表5。RT-qPCR和Western Blot检测显示,与对照组、转染miR-NC组比较,转染miR-384 mimics后KFBs HTRA1 mRNA和蛋白的表达显著降低(P<0.05),见表6。提示miR-384靶向负调控HTRA1表达。
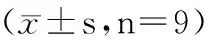
表5 双荧光素酶报告实验
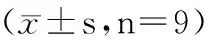
表6 miR-384调控HTRA1蛋白表达
2.4 干扰HTRA1对KFBs增殖和凋亡的影响 如表7、8和图7、8所示,与对照组和转染si-con比较,转染si-HTRA1后HTRA1 mRNA和蛋白的表达显著降低,细胞活力显著降低,细胞凋亡率显著增加,Ki-67、PCNA和Bcl-2蛋白的表达显著降低,Bax蛋白的表达显著升高(P<0.05)。
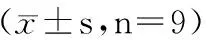
表7 干扰HTRA1对KELFIB细胞增殖和凋亡的影响
2.5 干扰HTRA1逆转了抑制miR-384对KELFIB细胞的影响 如表9、10和图9、10所示,与转染anti-miR-384比较,转染anti-miR-384后KFBs活力显著升高,细胞凋亡率显著降低,Ki-67、PCNA和Bcl-2蛋白的表达显著升高,Bax蛋白的表达显著降低;与转染anti-miR-384+si-con比较,转染anti-miR-384+si-HTRA1后KFBs活力显著降低,细胞凋亡率显著升高,Ki-67、PCNA和Bcl-2蛋白的表达显著降低,Bax蛋白的表达显著升高(P<0.05)。
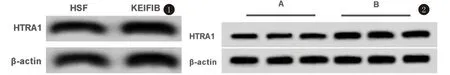
图1 人瘢痕疙瘩成纤维细胞中HTRA1蛋白的表达 图2 人瘢痕疙瘩组织中HTRA1蛋白的表达 A:人正常皮肤组织;B:人瘢痕疙瘩皮肤组织
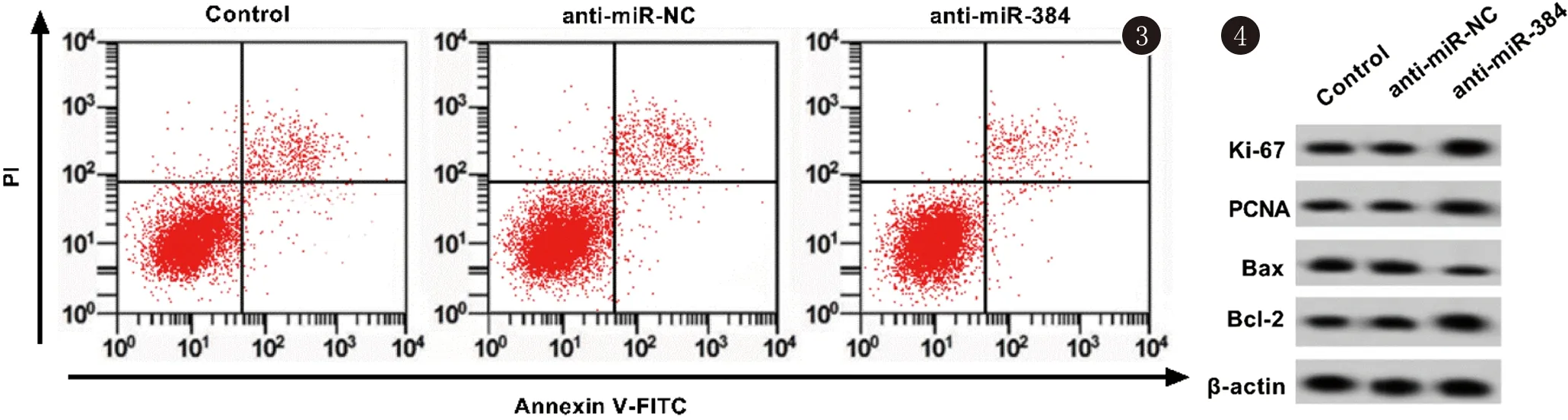
图3 TRAIL对KFBs凋亡的影响 图4 miR-384的敲减对KFBs增殖和凋亡相关蛋白表达的影响

图5 HTRA1的序列中含有与miR-384互补的核苷酸序列 图6 miR-384调控HTRA1表达

图7 抑制HTRA1对KELFIB细胞凋亡的影响 图8 干扰HTRA1对KFBs增殖和凋亡相关蛋白表达的影响
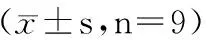
表8 干扰HTRA1对KFBs增殖和凋亡相关蛋白表达的影响
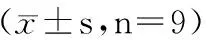
表9 干扰HTRA1逆转了抑制miR-384对KFBs增殖和凋亡的影响
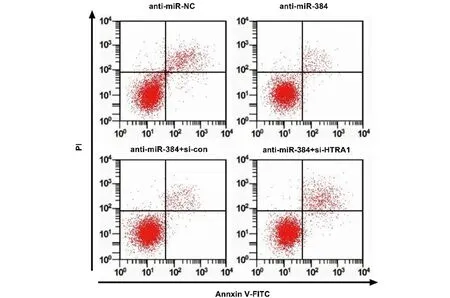
图9 干扰HTRA1逆转了抑制miR-384对KFBs凋亡的影响
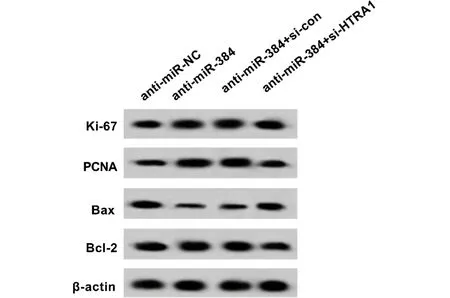
图10 干扰HTRA1逆转了抑制miR-384对KFBs增殖和凋亡相关蛋白的影响
3 讨论
最近研究表明,miRNA在瘢痕疙瘩形成中具有重要作用,是治疗该病的潜在靶点[6,7]。miR-384是一种多功能miRNA,参与包括细胞生长、增殖、凋亡和迁移在内的多种细胞过程。研究显示miR-384在乳腺癌中表达下调,上调miR-384可降低乳腺癌体内外增殖和迁移能力发挥抑癌基因作用[8]。在非小细胞肺癌中miR-384也呈低表达,上调miR-384可降低非小细胞肺癌细胞的增殖和致瘤能力,诱导细胞凋亡和自噬[9]。此外,上调miR-384还可抑制喉癌细胞增殖,提高caspase-3活性,诱导细胞凋亡[10]。本研究数据显示,miR-384在人瘢痕组织和KFBs细胞中的表达分别低于正常皮肤组织和HSF细胞。功能实验显示,抑制miR-384表达可促进KFBs细胞增殖,抑制细胞凋亡。进一步分析显示,抑制miR-384表达还可升高促增殖蛋白PCNA和Ki-67、抗凋亡蛋白Bcl-2的表达水平,降低促凋亡蛋白Bax的表达水平。因此,需要进一步研究来阐明miR-384在瘢痕疙瘩形成中的分子机制。
为揭示miR-384在瘢痕疙瘩形成中的分子机制,采用生物信息学软件进行靶基因预测发现HTRA1是miR-384的潜在靶基因,并通过双荧光素酶报告实验、RT-qPCR、Western blot检测证实miR-384靶向HTRA1并负调控其表达。HTRA1是一种丝氨酸蛋白酶,由四个不同的功能域组成,是HTRA家族中最先被发现的成员。研究表明瘢痕疙瘩中HTRA1表达增加,沉默HTRA1可抑制KFBs的增殖和细胞外基质沉积[11,12]。miR-494-3p通过靶向HTRA1可降低KFBs增殖、迁移和胶原蛋白合成能力,促进KFBs凋亡和细胞周期阻滞[13]。与前人研究结论相似,本研究发现HTRA1在人瘢痕组织和KFBs中的表达分别高于正常皮肤组织和HSF细胞,干扰HTRA1表达可降低KFBs的增殖能力,促进细胞凋亡,降低Bax、升高PCNA、Ki-67和Bcl-2蛋白的表达。然而,在胰腺癌[14]、胃癌[15]、卵巢癌[16]等恶性肿瘤中HTRA1表达下调,上调其表达可抑制肿瘤发生发展。此外,干扰HTRA1还可逆转抑制miR-384表达对KFBs增殖促进和凋亡抑制作用。
综上所述,瘢痕疙瘩中miR-384呈低表达,miR-384低表达通过靶向HTRA1可促进KFBs增殖和抑制细胞凋亡,是瘢痕疙瘩形成的重要促进因素。因此,miR-384是瘢痕疙瘩治疗的潜在靶点。
