Hippo信号通路与肾脏损伤修复的研究进展
2021-04-09周蔚然综述丁小强审校
周蔚然(综述) 赵 栓 丁小强(审校)
(复旦大学附属中山医院肾内科 上海200032)
Hippo信号通路在各物种之间高度保守,通过调控细胞增殖-凋亡平衡在维持组织稳态和器官形态方面具有重要作用[1-5]。目前已经证实Hippo信号通路参与心脏、肝脏及肠道等多种器官损伤后的再生修复过程[6-8]。近年来,Hippo信号通路在肾脏疾病中的作用得到越来越多的关注。深入理解Hippo通路在肾脏损伤后发挥的作用及其机制,将有助于找到Hippo通路的相关靶点,为急慢性肾脏病的治疗提供有效的治疗策略。
Hippo信号通路的组成和生物学功能
Hippo信号通路的组成在哺乳动物中,Hippo信号通路是哺乳动物不育系20样激酶1/2(mammalian sterile 20-likekinase 1/2,MST1/2)、大肿瘤抑制激酶1/2(large tumor suppressor 1/2,LATS1/2)、Yes激 酶 相 关 蛋 白(Yes-associated protein,YAP)/含PDZ结合基序的转录共激活因子(transcriptional co-activator with PDZ-binding motif,TAZ)组成的三步激酶级联信号通路。Hippo信号通路的激活过程为:MST1/2与调节蛋白SAV1(salvador homolog 1)结合,磷酸化激活LATS1/2,LATS1/2与 调 节 蛋 白MOB1(Mps one binder kinase activator-like 1)结合进一步磷酸化下游分子YAP/TAZ,磷酸化的YAP并无活性,滞留在细胞质中,随后通过泛素蛋白酶体途径降解。而当Hippo信号通路受到抑制,YAP去磷酸化激活,入核与TEA转录因子(TEA domain transcription factor,TEAD)结合,启动下游靶基因的表达[9](图1)。

图1 Hippo信号通路示意图Fig 1 Principle of Hippo pathway
Hippo信号通路的生物学功能YAP和TAZ
是Hippo信号通路中的两个共激活转录因子,入核后通过结合序列特异性转录因子TEAD 1~4来调节 下 游 基 因 表 达[10]。TEAD结 合YAP的S94A位点并且显著增强YAP的转录活性,该位点的突变则抑制Hippo通路下游基因的表达[11]。TAZ是YAP的旁系同源物,和YAP具有约50%的序列同源性和相似的结构[12-14],但是两者的功能并不完全相同,敲除YAP导致胚胎早期死亡或者卵黄囊血管生成缺陷,而敲除TAZ后导致小鼠罹患囊性肾脏疾病[15-16]。
Hippo信号通路受到多种因素的调控。与表皮生长因子受体(epithelial growth factor receptor,EGFR)信号通路、转化生长因子-β(transforming growth factor-β,TGF-β)信号通路或Wnt通路等其他经典信号通路不同,Hippo信号通路没有特定的受体和细胞外配体。机械应力、氧化应激、细胞密度或者细胞间连接的变化都能调控Hippo信号通路[1,17-19]。细胞受到的机械应力是Hippo通路重要的调节因素,当细胞在坚硬表面上生长或暴露于较大的机械应力环境时会抑制Hippo通路,激活YAP/TAZ[20-21]。此外,在细胞密度较高时,细胞之间产生接触抑制,激活Hippo通路;而当细胞密度较低时,Hippo通路被抑制,YAP入核并促进靶基因转录和细胞增殖[22]。此外,Hippo通路还受其他信号通路调节。例如,G蛋白偶联受体(G protein-coupled receptor,GPCR)途径可以通过F-actin调节YAP/TAZ活性[23];Wnt/β-catenin通路与YAP/TAZ有直接的相互作用[24];Src家族激酶可以激活YAP[25];我们最新研究发现Rac-GTP酶激活蛋白1(Rac-GTPase activating protein 1,RacGAP1)也可以通过激活YAP促进肾小管上皮细胞损伤后的修复[26]。总之,Hippo通路的激活/失活是一个动态过程,受胞内外多种信号通路的调节,这些通路也为调节Hippo通路活性提供了潜在的药物靶点。
Hippo信号通路在AKI早期的作用AKI是常见的临床危重症,目前除了液体复苏和肾脏替代治疗等支持性疗法外,尚缺乏有效的治疗手段[27]。肾小管上皮细胞(tubular epithelial cell,TEC)作为肾脏中含量最高的细胞对缺血缺氧造成的损伤极其敏感,并且TEC的修复与否在AKI向慢性肾脏病(chronic kidney disease,CKD)演化过程中起到决定作用[28]。肾脏受到轻度损伤时,幸存的TEC通过去分化增殖再分化完成肾小管的修复[29]。而当肾脏受到反复损伤、严重损伤或者持续损伤,TECs修复不良导致肾脏间质纤维化(tubulointerstitial fibrosis,TIF)的发生[29]。Hippo信号通路在AKI后肾脏的修复和再生中扮演重要角色(表1)。

表1 Hippo通路在肾脏损伤修复中的作用Tab 1 Function of Hippo pathway in kidney injury repair
在AKI早期肾小管通过抑制Hippo信号通路促进幸存上皮细胞再生。2016年,Xu等[30]利用小鼠缺血再灌注损伤(ischemia-reperfusion injury,IRI)模型进行肾脏转录组测序发现,在再灌注后24 h,YAP在肾脏中的表达增加了1.7倍,而LATS2表达显著下 降。Chen等[31]在IRI-AKI小 鼠 的肾 近 端 小管 中发现YAP的蛋白水平在IRI后24 h升高,并一直持续到IRI后第7天。此外,在AKI患者肾脏中也观察到YAP被显著激活。使用YAP抑制剂或在小鼠肾脏中敲除YAP,在IRI后24 h至第7天小鼠肾功能相比对照组显著恶化。Chen等[31]同时指出,小鼠肾脏中敲除TAZ对IRI小鼠肾功能恢复没有影响,说明YAP和TAZ在AKI后可能发挥着不同的功能。Wu等[32]的最新研究提出,IRI后24 h小鼠肾脏中TAZ表达显著上调且发挥保护作用。小鼠双侧肾盂内注射TAZ siRNA导致IRI-AKI小鼠肾小管损伤加重、小鼠肾功能恶化,而小鼠腹腔注射氯喹可以诱导小鼠肾小管中TAZ高表达,减轻小鼠IRIAKI后肾脏损伤。值得注意的是,Chen等[31]的研究采用了夹闭双侧肾蒂35 min的小鼠IRI模型,而Wu等[32]的 研 究 采 用 了 夹 闭 双 侧 肾 蒂10 min(TAZ siRNA组)和20 min(氯喹组)的小鼠IRI模型,TAZ是否在不同损伤程度的IRI-AKI后发挥不同的功能还有待进一步研究。此外,Hippo通路中的关键激酶MST1阻碍肾脏损伤修复过程,敲除MST1后则显著减轻小鼠IRI后4 h的肾脏损伤[33]。
抑制Hippo信号通路主要通过促进细胞增殖同时减少细胞凋亡从而促进肾脏修复过程。细胞周期调节蛋白D(Cyclin D)被认为是YAP的靶基因之一[34-36],小鼠IRI-AKI后6~48 h,YAP上调Cyclin D的表达水平,同时诱导视网膜母细胞瘤蛋白(retinoblastoma,Rb)磷酸化,激活周期蛋白依赖性激酶(cyclin-dependent kinases,CDK)4和CDK 6,加速细胞周期进程和幸存TECs增殖,促进肾脏适应性修复[31]。在体外培养的TEC中过表达YAP,能增加细胞缺氧复氧损伤后增殖细胞核抗原(proliferating cell nuclear antigen,PCNA)和Ki67的表达以及G2/M和S期的细胞数量[31,37]。在乙酸铀酰诱导的AKI大鼠模型中,YAP的激活水平与生存素的表达以及TECs的细胞抵抗能力正相关[38]。在小鼠肾脏中敲低TAZ,IRI后24 h时p38和c-Jun氨基末端激酶(c-Jun N-terminal kinase,JNK)信号明显激活,细胞周期阻滞和细胞凋亡更为严重[32]。敲除小鼠肾脏中的MST1基因也能抑制IRI后TECs的凋亡,起到保护作用[33]。
AKI中后期Hippo信号通路持续失活可能诱导AKI-CKD转 化2016年,Xu等[37]最 早提 出 在IRIAKI早期激活YAP可以促进受损肾小管上皮的修复,而YAP的持续激活可能导致肾间质纤维化和肾小管异常的去分化。在该研究中,尽管YAP和pYAP的比值在大鼠轻度IRI(夹闭肾动脉30 min)和重度IRI(夹闭肾动脉45 min)后均有明显上调,但重度IRI后YAP的活化持续了4周,而轻度IRI后YAP的活化仅有2周[37]。在重度IRI后对小鼠腹腔注射YAP激动剂(地高辛),4周后地高辛组相比对照组小鼠肾小管损伤程度和TIF程度明显加重[37]。因此,YAP激活持续的时间与AKI严重程度密切相关,并且可能是AKI-CKD转化中的关键因子。当损伤较轻时,YAP的短时活化有助于肾小管的修复和再生,而当损伤较重时,YAP被持续激活,导致肾脏修复不良和向CKD发展。另一研究团队也提出,在小鼠重度IRI(夹闭左肾动脉45 min后切除右肾)后21天内YAP的表达持续增加[39]。在小鼠IRI-AKI后第7天对小鼠肾内注射YAP-shRNA后可以显著减轻IRI-AKI导致的肾功能不全,降低TGF-β和结缔组织生长因子(connective tissue growth factor,CTGF)的表达,延缓了TIF进展。因此,尽管YAP在AKI早期可能发挥保护作用,但在AKI的中后期YAP的持续激活则预示AKI的不良预后[39]。
以上研究均提示,AKI发生后短期抑制Hippo信号通路可能促进肾脏恢复,而长期抑制则可能导致AKI向CKD发展,YAP激活的程度和持续时间可能在AKI的转归中起到关键作用。
Hippo信号通路持续失活促进肾脏纤维化进展的机制
诱导小管上皮细胞的间质转化和肌成纤维细胞形成肾脏重度损伤后,TECs发生上皮-间质转化(epithelial-mesenchymal transition,EMT)获得间充质表型,同时分泌大量细胞外基质(extracellular matrix,ECM),促进TIF进展[40]。马兜铃酸(aristolochic acid,AA)可以导致AKI并诱导AKI的慢性化转归。AA-AKI的小鼠肾脏中TAZ和CTGF表达显著增加。在体外培养的人肾小管上皮细胞(HK-2)中过表达TAZ,造成细胞去分化和成纤维细胞样表型[41]。肾脏中特异性敲除SAV1的小鼠发生AAAKI后Hippo通路被抑制,肾脏中各类胶原、纤维连接蛋白和间质标志物波形蛋白的表达水平均较野生型小鼠显著升高[42]。
肌成纤维细胞比普通成纤维细胞具有更强的合成和分泌ECM的能力,导致肾脏瘢痕化和挛缩[43-44]。肌 成 纤 维 细 胞 可 由TECs通 过EMT转 分化形成,而肾脏固有成纤维细胞的转化是肌成纤维细 胞 的最主要 来源[44-45]。在 单 侧输尿管 梗阻(unilateral ureter obstructive,UUO)小鼠模型中,抑制YAP/TAZ可以阻断TGF-β诱导的成纤维细胞向肌成纤维细胞转化,从而抑制ECM产生、延缓TIF进展[46-47]。此外,YAP是细胞对生物力学信号的感受器,可以被ECM激活,促进成纤维细胞转化为肌成纤维细胞。ECM的积累与YAP的激活形成正向反馈调节,导致肾脏纤维化的持续进展[47]。综上,AKI中后期YAP/TAZ的持续激活不仅调控EMT进程,也诱导成纤维细胞向肌成纤维细胞转化,从而促进TIF的进展。
调控巨噬细胞M2型极化和炎症反应调控巨噬细胞(macrophage,Mø)在不同的刺激下可以极化为经典活化的M1型Mø或者替代活化的M2型Mø。M2的持续活化会通过促进ECM生成、分泌基质金属蛋白酶以及巨噬细胞-肌成纤维细胞转化等途径导致肾小管间质损伤和肾脏纤维化[48]。在UUO和IRI两种肾脏损伤模型中,敲除TAZ或者抑制YAP可以阻断Wnt5a和TGF-β1诱导的Mø向M2型极化,从而延缓肾脏纤维化的进展[49]。另一研究中,敲除MST1/2后小鼠肾脏皮质和髓质中巨噬细胞数量明显增加,而同时敲除MST1/2和YAP后,小鼠肾脏的炎症和纤维化水平与对照组无异,进一步说明YAP在巨噬细胞活化中的核心作用[50]。持续性的炎症反应也是导致肾脏纤维化的重要原因,在小鼠肾脏中,TNF-α和YAP之间可以形成正反馈促进肾脏炎症反应和纤维化的进展[50]。
介导TEC细胞周期阻滞和细胞肥大G2/M期检查点是细胞周期的重要调控靶点,参与肾脏损伤修复及纤维化过程[51]。发生G2/M期阻滞的TECs大量表达纤维化因子,导致小管上皮过度修复并发生纤维化[52]。TAZ在UUO小鼠肾脏中被大量激活,导致肾小管上皮细胞G2/M期阻滞和生长受抑,提示TAZ的过度激活是肾小管不良修复的重要原因[41]。
肾脏代偿性肥大(renal compensatory hypertrophy,RCH)是指肾脏损伤后由于肾单位数量的减少导致的残余肾单位的代偿性生长,是CKD的病理改变之一。目前认为,适度的RCH可以在一定程度上代偿正常的肾脏功能,而过度的RCH会导致小管肥大,间质纤维化和肾功能的进行性下降[53]。RCH动物模型中YAP被大量激活,通过活化Akt/mTOR信号通路导致肾脏细胞肥大[54]。
结语在AKI早期,Hippo信号通路的失活对肾脏适应性修复具有促进作用,而Hippo信号通路的持续失活可能导致AKI向CKD的进展(图2)。目前,我们对YAP/TAZ在肾脏疾病中的激活和作用机制认识尚浅,肾脏损伤后YAP/TAZ激活的触发因素、Hippo信号通路与其他信号通路的相互作用以及调控机制还有待深入研究。因此深入阐明Hippo信号通路在AKI中的作用机制,将为肾脏损伤后的修复和再生提供新的思路。
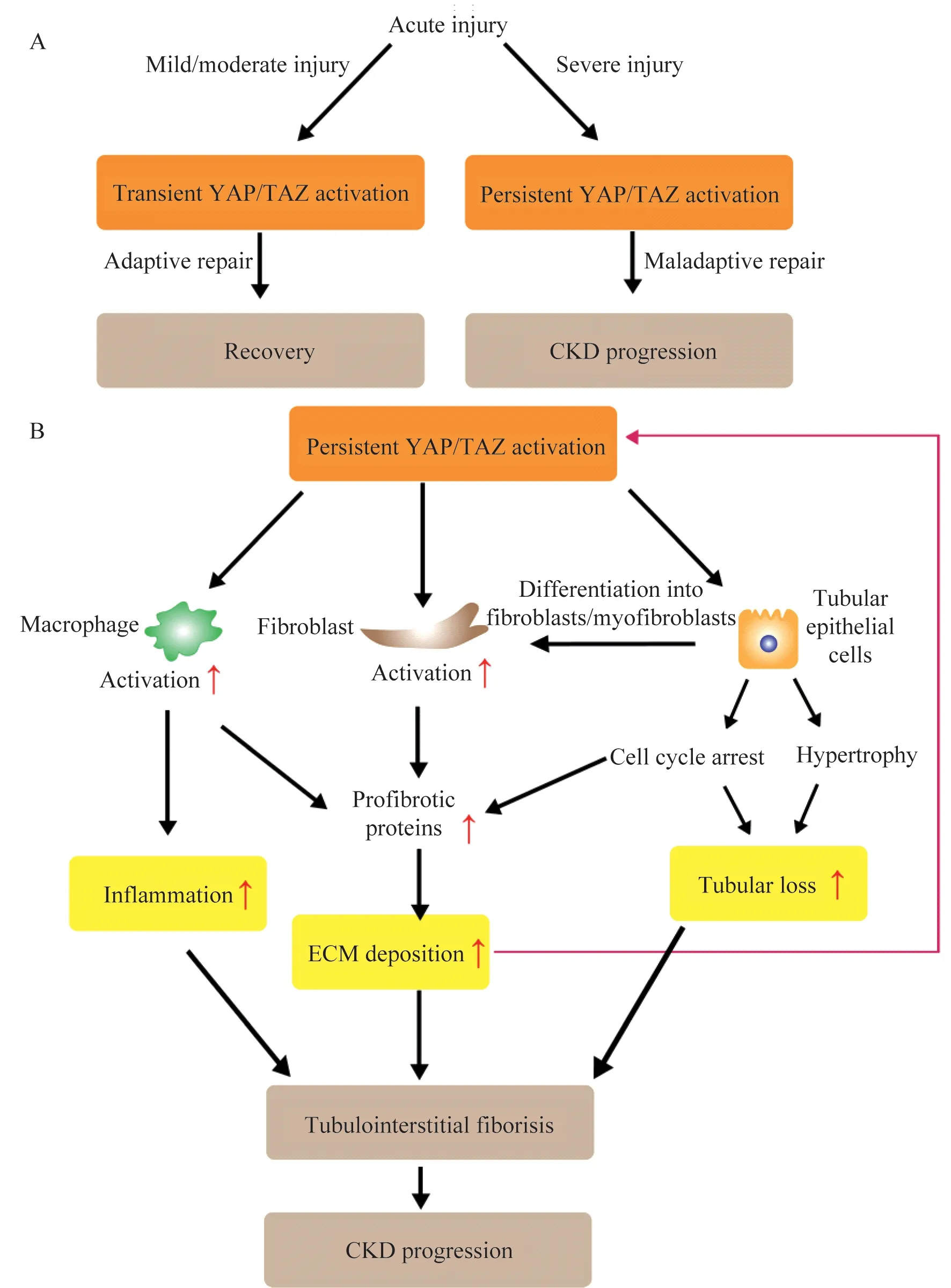
图2 Hippo信号通路在急性肾损伤后发挥不同作用Fig 2 The function of Hippo pathway after acute kidney injury
作者贡献声明周蔚然论文构思和撰写,文献调研,绘制图表。赵栓论文设计和修订,获取资助。丁小强论文设计和修订,监督指导。
利益冲突声明所有作者均声明不存在利益冲突。
