生物力学影响的靶区位姿精度保持方法研究
2021-04-08李瑞星张来喜陈惠贤宋明涛雷武乐张鹏
李瑞星,张来喜,陈惠贤,宋明涛,雷武乐,张鹏
1.兰州理工大学机电工程学院,甘肃兰州730050;2.中国科学院近代物理研究所,甘肃兰州730000
前言
恶性肿瘤的发病率越来越高,当下如何有效治疗癌症得到广泛关注[1]。随着医疗技术的快速发展,人们发现重离子放射治疗肿瘤具有非常好的治疗效果[2]。放疗尤其实现精确放疗成为人们追求的目标,放疗摆位中引起放疗误差的原因除了摆位及检测等设备系统误差外,患者器官移动引起的误差也影响放疗效果[3]。目前在精确放疗中对于肿瘤靶区位姿的控制方法主要有放大计划靶区[4]、屏气技术[5]、呼吸门控技术[6]以及实时追踪技术[7]等。扩大计划靶区可以保证临床靶区一直处在计划靶区内部,但是更多正常组织进入束流射野范围从而受到不必要的损伤;屏气技术是通过简易训练让患者在治疗过程中屏住呼吸直到治疗结束,此方法对肺功能障碍患者的不可控性太大;呼吸门控并非减少肿瘤运动,而是使束流放射周期与呼吸同步,与实时追踪技术一样,时间延迟所带来的问题在一定意义上并不能实现真正的精确放疗。由于放射治疗对肿瘤的位姿精度要求很高,为了进一步提高放疗精度,在进行初次摆位后需进行二次摆位来提高放疗精度,如何在二次摆位过程中对肿瘤位姿实现精确定位成为研究的重点。
对于靶区肿瘤位置可以通过体表的标记点与内部器官的关系预测,通过建立模型后采用神经网络[8]或滤波算法[9]等求解体内肿瘤的运动,但不确定性和个体差异性太大;对于人体器官的生物力学特性可以进行有限元分析[10],利用人体解剖学原理和生物力学相关知识建立精确的人体有限元模型。本文针对内部器官及肿瘤在生物力学作用下的靶区位姿误差,通过仿真调整机械臂位置,探寻末端患者器官和内部肿瘤分别在各个方向相应调整角度后的变形,得到末端靶区随机械臂运动的误差规律,提出机械臂在二次摆位中控制精度的方法。
1 材料与方法
1.1 三维模型
生物软组织模型的建立向来是个难题,利用常规的三维建模软件建立人体组织模型尤其是软组织三维模型有相当大的局限性,模型的准确性可以很好地还原软组织结构特征。目前常用的软组织建模是基于医学CT 图像,例如基于CT 和NURBS 技术的CAD 表面重建[11],可以重建软组织结构特征,但是此方法较为繁琐。本研究采用交互式医学影像控制系统Mimics17.0 软件进行DICOM 格式CT 数据的处理,此软件可以与很多逆向处理及有限元分析软件简易通讯,满足后期对模型简化并分析的需求。
本研究数据来源为Cancer Imaging Archive 网站的一名中年男性患者的胸腔CT 影像数据,该数据集由美国国立癌症研究所和美国国立卫生研究院(FNIH)基金会联合建立的胸部X 线断层扫描数据库提供。每层图像像素均为512×512,切片层厚为1 mm,共计305 张DICOM 格式的CT 图像。图1可以看出患者肿瘤位置(十字光标中心)在右肺上叶靠近肺尖位置处。
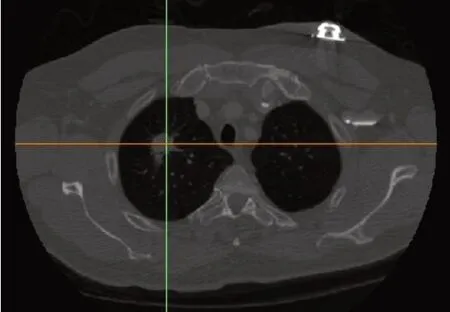
图1 含肿瘤患者CT影像Fig.1 CT images of patients with tumors
肺组织由于呼吸等运动的存在是一个动态过程,我们选取初始时刻CT 影像为基础数据。由于不同器官组织灰度值不同,可以通过阈值分割选定需要器官的蒙版,然后通过区域增长对彼此不相连的区域进行进一步细分。针对建立肺和肿瘤蒙版进行布尔操作减去相互重叠的部分,准确还原组织结构关系,最后依靠选定的蒙版建立肺组织及内部肿瘤的三维模型,如图2所示。
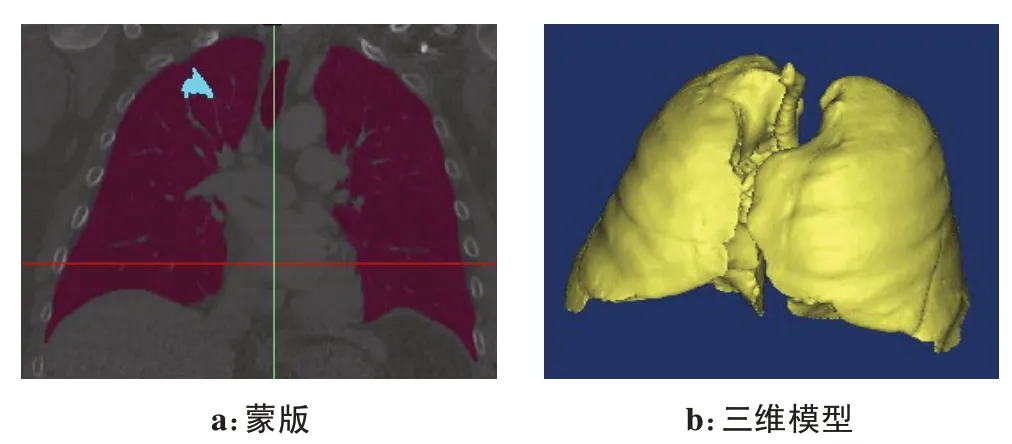
图2 肺组织和肿瘤蒙版及三维模型Fig.2 Mask and 3D model of the lung and tumor
1.2 有限元模型
对肺组织进行有限元建模工作最早始于Mead等[12]学者,他们将肺组织模拟为一个非线性弹簧网络,但精度有限,后来诸多学者开始对生物软组织建立有限元模型进行分析。对建立的三维模型可以利用Geomagic Studio 处理,它是一款常用的逆向处理软件,但针对CT 获取的三维模型,逆向重建的功能得不到最大限度的应用。我们选用3-matic对建立的三维模型进行图像光顺简化等处理并划分面网格与体网格,使用边界明确的CT 图像建立图3所示的四节点四面体单元有限元模型,肺组织节点数为195 067,网格数为1 172 283,肿瘤节点数为7 028,网格数为24 483。考虑肿瘤位于肺组织右肺上肺叶中,为简化处理模型,只建立了包含肿瘤的右肺有限元模型。

图3 肺组织和肿瘤的有限元模型Fig.3 Finite element models of the lung and tumor
1.3 材料属性
通过解剖学相关知识了解到由于肺裂的存在,右肺分左2右3共5叶,是人体呼吸的重要器官,而肿瘤是在各种致癌因子作用下组织突变产生的新生物,通常密度比正常组织大。生物软组织在体内的变化与刚性体不同,为了考虑软组织的变形,采用力学含义明确的生物力学模型解释软组织的变形行为很有必要。人体软组织具有诸多特性,如弹性、非线性、超弹性等。超弹性是指材料存在一个弹性势能函数,该函数表示应变张量的标量函数,其对应变分量的导数是对应的应力分量,应力和应变不再是线性对应的关系,而是以弹性能函数的形式一一对应。前人对生物软组织的材料及超弹性本构方程有诸多研 究[13],Rivlin 在Mooney 理论基础上提出的Mooney-Rivilin 模型[14]在描述百分百拉伸变形时此模型可以很好地体现出材料的变形行为,其应变能密度函数用公式(1)表示:
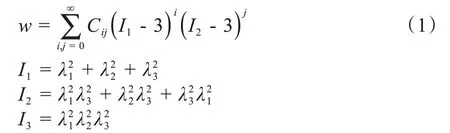
将此解析形式用I1,I2的双重傅里叶级数表示,只取前2 项,可得到公式(2)表示的含2 个常数的应变能密度函数方程:

但在二次摆位中肺组织变形为小变形,在描述小变形时,Neo-Hookean 模型[15]在使用中具有无条件稳定性,它的应力应变可以预测许多条件下的变形,因此定义肺组织材料为Neo-Hookean模型,其可压缩情况下的应变能密度函数为公式(3)所示:
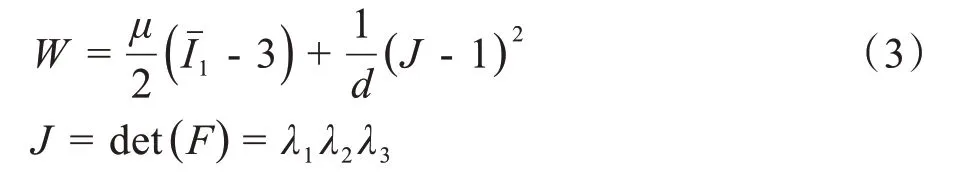
其中,μ和d为材料常数=J-2/3I1,I1是左柯西格林变形张量的第一不变量。此外,较常用的本构模型还有多项式超弹模型、Ogden模型、Yeoh模型等,在有限元分析不同的材料时选择合适的模型可以更好地模拟材料特性。为准确模拟患者二次摆位时的小变形,本文采用Neo-Hookean模型作为肺组织的本构模型,选取μ=1.63,d=3.802;对于肿瘤和肺的泊松比分别取值为0.3186 和0.42;杨氏模量分别取49 MPa 和500 kPa;由于涉及到重力,选取肺组织和肿瘤密度[16]分别为600 kg/m3和10 000 kg/m3。
2 结果与验证
2.1 有限元分析
将所建立的患者有限元模型导入ANSYS 中进行求解,建立患者胸腔定义为肺组织边界条件,施加不同方向重力模拟患者随治疗终端机械臂角度的变化,施加位移载荷模拟患者生理运动造成的变形,定义肺组织与胸腔接触类型为无摩擦滑动,模拟肺组织在胸腔内的滑移行为,定义肿瘤与肺组织接触类型为绑定接触,模拟肿瘤完全填充于肺组织中,模拟组织相互作用力。得到包含肿瘤的肺组织有限元模型摆位后肺(图4a)及内部肿瘤(图4b)的位移分布图。其中肺组织和最大变形为21.24 mm,肿瘤的最大变形为3.17 mm,可以看出肺中叶肺下叶由于缺少内部肝脏等器官的支撑,变形显然较大。
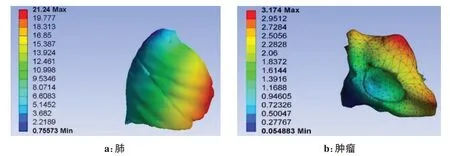
图4 肺和肿瘤的位移云图Fig.4 Displacement cloud map of the lung and tumor
2.2 误差模型
为了获取肿瘤中心位移误差,在肿瘤表面选取30 个肿瘤节点,将所有节点变形误差均值定义为肿瘤中心位移,将绕单轴摆位不同角度后得到的肿瘤中心位移进行多项式数据拟合,得到绕固定轴旋转特定角度时肺组织最大变形和肿瘤中心点在各坐标轴上的误差与摆位角度的关系(图5~图7),如下:
绕X 轴旋转时肿瘤中心变形误差与旋转角度的

绕Y 轴旋转时肿瘤中心变形误差与旋转角度的

图5 绕X轴Fig.5 Rotating around X axis

图6 绕Y轴Fig.6 Rotating around Y axis

图7 绕Z轴Fig.7 Rotating around Z axis

绕Z 轴旋转时肿瘤中心变形误差与旋转角度的

可以明显看出在二次摆位小范围调整下肿瘤中心位置误差与旋转角度成一定关系。在一定范围内,随着变化角度增大,变形相应增大,并且在绕固定轴旋转时相应轴方向的位置误差最小,对于给定目标位姿[P']的姿态矩阵[R']与二次摆位前位姿[P]的姿态矩阵[R]通过如下坐标旋转计算可以求得由当前姿态摆位到目标姿态后的变化角度α、β、γ:

其中,α、β、γ分别对应仿真分析中的绕X、Y、Z轴的旋转角度θX、θY、θZ,将α、β、γ与θX、θY、θZ对应可以得到肿瘤中心的误差模型:

[O]为系数矩阵。由误差分析可知在绕固定轴旋转时相应轴方向的位置误差最小,根据权重综合得到在位姿变化后肿瘤中心变形误差。由此设计前馈误差修整器,用以二次摆位中修正器官与肿瘤变形,保持摆位精度。
2.3 误差验证
为了验证本文提出的肺组织和肿瘤在生物力学影响下的摆位误差模型的正确性,利用中国科学院近代物理研究重离子放疗治疗室相关前期研发设备(图8)验证摆位时的肿瘤变形误差。实验器材包括:重离子束流末端治疗室;SM-50HF-B-D移动式X射线机;自带平板DR 的RAYER ISCOUT Image-guided positioning system(图像引导放疗系统)等,考虑到验证的是肺组织及肿瘤的位移误差,所以使用现有的六维治疗床模拟摆位角度的调整可以进行验证误差模型的准确性。首先拍摄患者术前CT,在重离子放疗过程一次摆位完成后得到的DR影像与术前治疗计划中CT序列影像经过光线追踪算法并进行器官标记勾画后DRR图像进行校对验证,可以得到胸腔肺组织和肿瘤在各个方向转动时的摆位误差的均值与标准差(表1),与仿真分析中得到的误差模型具有一致性。
图8 误差验证实验平台Fig.8 Error verification experiment platform
表1 肺组织和肿瘤不同方向位移偏差(mm,± s)Tab.1 Displacement deviations of the lung and tumor in different directions(mm,Mean±SD)

表1 肺组织和肿瘤不同方向位移偏差(mm,± s)Tab.1 Displacement deviations of the lung and tumor in different directions(mm,Mean±SD)
变形误差头脚左右前后肺肿瘤20.12±2.61 2.36±0.47 17.12±1.46 1.41±0.35 18.63±1.49 1.53±0.21
目前在放疗治疗过程中通常会将临床靶区(CTV)向外扩展形成计划靶区(PTV),用来补偿一些动态误差带来的摆位误差,但无形中增大了对正常组织的损伤。为此进一步有分析肺组织在生物力学影响下横断面、矢状面、冠状面的误差,在制定放疗计划利用现有公式M= 2Σ+0.7δ制定PTV 区域时可以减少对正常组织的损伤,节省束流资源。
3 二次摆位精度控制
3.1 运动学控制模型
自主设计法的重离子放疗摆位机械臂如图9所示,由底座、升降机构、大臂、小臂、翻转机构、俯仰机构及偏转机构等组成。

图9 自主设计摆位机械臂Fig.9 Self-designed positioning mechanical arm
机械臂的运动学模型是实现机器人位姿控制的数学模型,针对自主设计的重离子放疗治疗系统终端摆位机械臂进行运动学分析,建立运动学控制模型。考虑到本设计中的摆位机器人的关节轴线存在相互平行的情况,选用MD-H法[17]根据空间坐标变换原理可以得到从坐标系{i-1}到坐标系{i}的位姿变换矩阵:
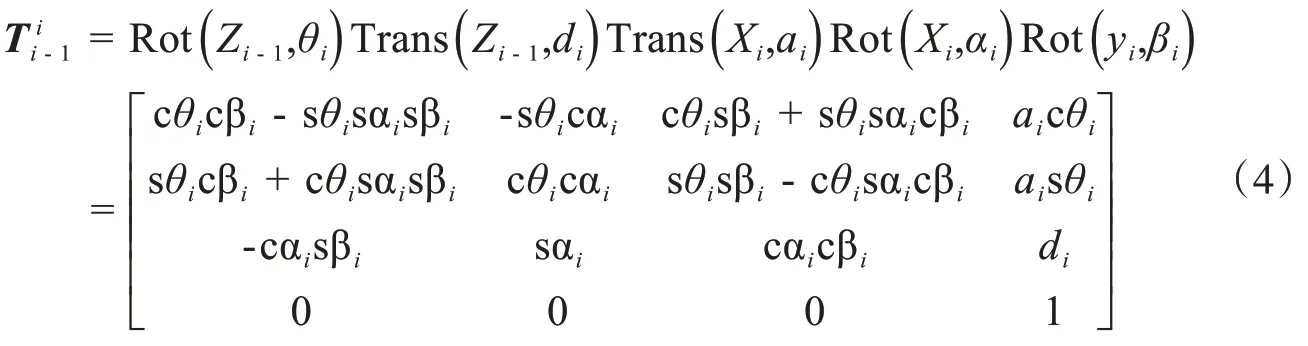
其中cθi=cos θi;sθi= sinθi;θ23=θ2+θ3,其余类推。机械臂D-H参数如表2所示:
代入表2相关参数后求得6 根相邻杆件位姿变化矩阵T10T21T32T43T54T65T10T21T32T43T54T,由此可以得到机械臂末端坐标系与终端设备基坐标系位姿变换矩阵:
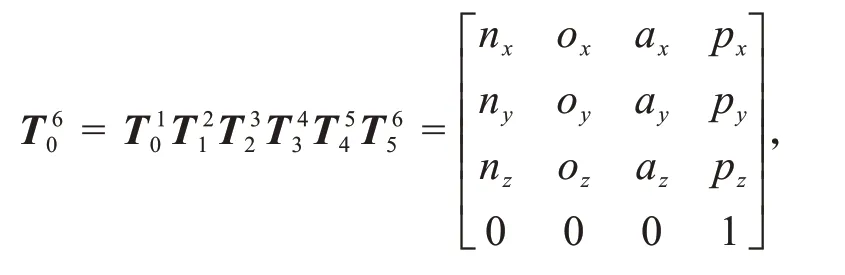

表2 重离子治疗终端摆位机械臂D-H参数Tab.2 D-H parameters of the positioning mechanical arm of heavy ion therapy terminal
其中,

3.2 前馈误差补偿
为了补偿二次摆位中肿瘤移动造成的摆位误差,本文提出了一种在放疗摆位过程中通过控制机械臂补偿摆位误差的方法。重离子放疗过程中,在一次摆位完成后将验证平板DR 影像与术前治疗计划中CT 序列影像经过光线追踪算法得出的DRR 图像进行校对验证,给出二次摆位目标位姿[P'],输入前馈误差修正器中对比目标点与摆位前靶区中心位姿变化,结合前文分析给出的误差模型求得肿瘤中心摆位后与目标位姿的误差[ΔP],然后赋予机械臂控制器修正后的末端位姿[P-ΔP],通过运动学逆解求得各关节变量,控制机械臂各关节变量补偿肿瘤中心变形误差。摆位完成后再次通过DR 验证,保证靶区中心与束流中心在误差范围内保持一致,便可开始放疗。此前馈补偿肿瘤运动误差流程见图10。

图10 前馈误差补偿流程Fig.10 Feed-forward error compensation process
4 讨论
人体软组织是不同于其它结构规则的物体。岳玉亮等[18]运用MATLAB软件通过数字图像处理技术获得人体器官的点云数据,在CATIA 软件中建立人体器官的三维实体模型,但常规建模软件及方法对生物软组织的三维建模并不适用,为了得到精确的软组织结构,我们利用CT 影像通过医学影像处理软件Mimics 联合ANSYS 精确建立了人体肺组织及其内部肿瘤三维模型和有限元模型。
对所建立的患者有限元模型进行分析,考虑到患者最终定位指标是肿瘤中心,选取肿瘤轮廓上标记点计算肿瘤中心的位移,得出肿瘤在摆位时的变形误差规律,可以看出在一定范围内肿瘤中心位移误差随绕单轴旋转角度增加相应变大,由此对肿瘤的误差模型进行拟合时可以近似采用多项式拟合,得到肿瘤中心位移与旋转角度的关系。并且分析了肿瘤在头脚、左右及前后方向的最大变形,旨在引导制定放疗计划时尽可能避免损伤正常组织。
现有的放疗过程中对靶区病灶的精度控制中,Schweikard 等[19]提出可以通过控制束流达到精确定位的目的,但对于固定束流的重离子治疗系统中通过调整束流的方式显然不可行,而图像引导的三维适形放疗配合六自由度机械臂的精准摆位可以很好地解决这一问题。本文提出的依靠摆位机械臂补偿摆位过程中肺组织和肿瘤变形位移误差的方法在小范围二次摆位调整中可行。本文采用静态CT 图像建立有限元模型分析二次摆位过程中由于位姿角度的调整带来的肺组织和肿瘤的变形误差,虽然考虑了生物力学特性材料参数和组织间接触等因素,但并没有考虑呼吸以及心脏跳动等对肿瘤带来的周期性位移误差,后期可以利用4D-CT 图像对周期内呼吸等生理运动造成的误差进行更精确的分析。
5 结论
本文在前人对人体软组织材料力学特性研究的基础上,基于人体解剖学和生物力学相关知识,探寻重离子放疗摆位过程中器官及内部肿瘤变形误差与靶区规律;通过有限元分析模拟了肺组织及内部肿瘤在二次摆位过程中随着机械臂角度的调整带来的变形误差,给出了二次摆位目标位姿及体内肺组织和内部肿瘤在生物力学影响下的误差模型,并验证了模型的准确性。针对在固定束流二次摆位中目标靶区存在的变形提出了前馈误差补偿方法,通过调整终端机械臂运动位置控制靶区变形误差,大大提高了放疗精度和效率。
