甘蓝型油菜BnbHLH122基因的克隆、表达模式及胁迫响应分析
2021-04-08唐佳佳万云宝王茂林
唐佳佳, 万云宝, 王茂林
(四川大学生命科学学院 生物资源与环境教育部重点实验室, 成都 610065)
1 引 言
甘蓝型油菜(BrassicanapusL.)是我国种植面积最广的油菜类型,可用于生产食用油、生物柴油和动物饲料等,有着很高的经济价值[1].然而,甘蓝型油菜的产量和品质常常受到极端温度、高盐、干旱等非生物胁迫的影响,因此,培育具有较强抗逆性的甘蓝型油菜新品种已然成为了农业生产的当务之急[2].相关研究表明,植物转录因子(Transcription factors, TFs)可与环境胁迫应答基因的启动子区的顺式作用元件相互作用,并通过元件调节应答基因的表达水平,从而增强植物机体对环境胁迫的耐受力[3].
植物bHLH(basic Helix-Loop-Helix)转录因子是植物体内必不可少的转录因子家族成员之一,能够参与调控植物的生长发育、胁迫响应等过程[4].在拟南芥(Arabidopsisthaliana)中,SPATULA基因参与调控花器官的发育和种子的萌发过程[5-6];PIF3基因能够负向调控植物的光的形态建成[7];AtbHLH92基因的过表达能在一定程度上增强转基因植株对高盐和甘露醇的耐受性[8].在烟草(Nicotianabenthamiana)中,NbbHLH1和NbbHLH2基因正向调控由茉莉酸诱导的尼古丁的合成[9];NtbHLH123基因能够参与调控植物冷应激反应[10].在水稻(Oryzasativa)中,OsbHLH148基因所编码的蛋白能够与OsJAZ蛋白相互作用,从而调控水稻的耐旱性[11].除此之外,人们还发现辣椒中的CabHLH94基因在青枯菌对辣椒的侵染过程中起正向调节作用[12].
综上所述,植物bHLH转录因子家族参与调节植物体内的多项生理生化反应是植物体内重要的调控因子.但是,目前对于植物bHLH转录因子家族的功能研究还十分局限,大部分研究工作都还停留在拟南芥、烟草、水稻等模式植物中.本研究对甘蓝型油菜bHLH122转录因子基因进行了克隆、表达模式和胁迫响应分析,为进一步阐明甘蓝型油菜中该转录因子的作用和有效利用bHLH转录因子家族成员培育抗逆性油菜新品种奠定基础.
2 材料与方法
2.1 材 料
甘蓝型油菜(BrassicanapusL.)科乐油1号和本氏烟草(Nicotianabenthamiana),由本实验提供,种植在25 ℃的植物光照培养室内(光照/黑暗=16 h/8 h).
2.2 方 法
2.2.1 甘蓝型油菜总RNA的提取与cDNA的合成 利用植物总RNA提取试剂盒(购自成都福际公司)提取甘蓝型油菜的总RNA,具体操作步骤详见试剂盒说明书.然后以检测合格的RNA为模板,按照TransScript®One-Step gDNA Removal and cDNA Synthesis SuperMix反转录试剂盒(购自北京全式金公司)操作步骤合成cDNA.
2.2.2BnbHLH122基因编码区全长的克隆 根据NCBI甘蓝型油菜数据库中所预测的bHLH122转录因子基因序列,设计特异性引物(见表1),然后采用Phanta Max Super-Fidelity DNA Polymerase(购自南京喏维赞)扩增其编码区全长序列,扩增体系为50 μL,扩增程序为95 ℃预变性3 min,95 ℃变性15 s,58 ℃退火15 s,72 ℃延伸1 min 30 s,34个循环,72 ℃后延伸5 min.PCR产物经1%的琼脂糖凝胶电泳检测后,采用北京天根的胶回收试剂盒进行纯化回收,回收产物再连接到pESAY®-Blunt克隆载体上,转化进Trans1-T1感受态细胞,菌液涂在含有卡那霉素的LB平板上,37 ℃过夜培养,结合蓝白班筛选和菌落PCR鉴定结果,挑选出阳性单菌落扩大培养并采用质粒小提试剂盒(购自北京天根生物公司)提取质粒,最后将质粒送往华大基因有限公司进行测序.
2.2.3BnbHLH122基因的生物信息学分析 利用DNAMAN软件对测序所得的基因序列进行序列比对;采用ExPASY在线分析系统里的ProtParam(https://web.expasy.org)工具预测蛋白质的理化性质;使用在线工具SWISS-MODEL(https://www.swissmodel.expasy.org/)对BnbHLH122基因所编码的蛋白进行三级结构预测;利用MEGA 7.0软件构建系统进化树.

表1 PCR扩增引物序列
2.2.4 亚细胞定位分析和转录激活活性验证 首先根据BnbHLH122-1和BnbHLH122-2基因的CDS区分别设计出带有特异性酶切位点的引物,引物序列见表2和表3(下划线标示酶切位点).然后以2.2.2所得的测序正确的阳性克隆质粒为模板,参照2.2.2中的方法对目的基因(不包含终止子)进行PCR扩增和纯化回收.再用T4连接酶将双酶切后的目的片段与pBI221-EGFP、pGBKT7载体质粒分别连接起来.再转化进Trans5α感受态细胞,在含有抗生素(氨苄霉素/卡那霉素)的LB平板上进行筛选.菌落PCR鉴定和质粒测序后,①亚细胞定位:利用PEG介导的烟草原生质体瞬时表达法将测序正确的重组质粒分别转化进烟草叶片原生质体,并以pBI221-EGFP空质粒为对照组,经22 ℃暗培养16 h后,在显微镜下观察原生质体;②转录激活活性验证:利用LiAc介导的酵母细胞转化法将pGBKT7-BnbHLH122-1和pGADT7、pGBKT7-BnbHLH122-2和pGADT7、pGBKT7和pGADT7(对照组)三组混合质粒分别共转化进酵母感受态细胞中,再将菌液分别划线在二缺SD/-Leu/-Trp和四缺SD/-Leu/-Trp/-His平板上,倒置于30 ℃培养箱中暗培养3~7 d后,拍照保存.

表2 亚细胞定位引物
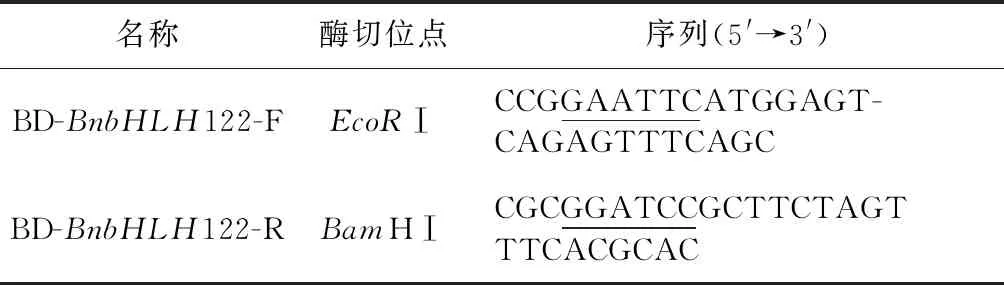
表3 转录激活活性验证引物
2.2.5BnbHLH122基因的时空表达模式分析 将科乐油一号油菜置于25 ℃,光照16 h∶黑暗8 h条件下培养,分别采集油菜苗期、抽薹期以及花期的根、茎、叶与花速冻于液氮中,每3株油菜为1个样品池,不同时期不同组织各取3个重复样品池.分别提取各个样品的RNA,并反转录成cDNA,以其为模板进行qRT-PCR分析BnbHLH122基因的时空表达模式.定量引物见表4,内参基因为甘蓝型油菜β-actin基因(GenBank登录号:AF111812).按照TransScript®Tip Green qPCR Super Mix(购自北京全式金公司)使用说明书,设计反应体系为:20 μL,其中模板1 μL,上下游引物各0.4 μL,2×TransStart®Tip Green qPCR Super Mix 10 μL,Nuclease-free Water 8.2 μL.反应程序采用三步法:94 ℃预变性30 s,40个循环(94 ℃变性5 s,55 ℃退火15 s,72 ℃延伸10 s),同时绘制溶解曲线(从65 ℃上升至95 ℃,每个循环上升0.5 ℃).实验设有3次技术重复,并且最终结果采用2-△△Ct法计算基因表达量,GraphPad Prism7作图.

表4 荧光定量引物
2.2.6BnbHLH122基因在逆境胁迫和激素处理下的基因表达分析 种植于土壤中的甘蓝型油菜,待其长至四叶一心期时,参照王静等人[13]的处理方法,选取长势相同的植株分别进行以下处理:①非生物胁迫:将植株分别放在4 ℃和40 ℃的光照培养箱(日照16 h∶黑暗8 h)中进行冷胁迫处理和热胁迫处理,然后每间隔2 h进行一次取样;渗透、盐以及干旱的处理是将植株清洗干净后,转移至1/2×Hogland营养液中缓苗3 d,然后把油菜分别放在含有200 mmol/L甘露醇、200 mmol/L NaCl和20% PEG6000的1/2×Hogland营养液中进行处理,再在0、3、6、9、12、24、48 h时各取一次样.②核盘菌胁迫:将直径为6 mm的带有核盘菌(购自北纳生物公司,菌种编号为BNCC 122299)菌丝的菌块接种在油菜叶片上,套上塑料袋保持湿度,然后在0、6、9、12、24、48、72 h时各取一次样.③激素处理:将植株转移至1/2×Hogland 营养液中缓苗3 d,然后把油菜分别放入含有0.05%无水乙醇和0.01% Tween-20的100 μmol/L ABA、SA以及MeJA激素的1/2×Hogland营养液中进行处理,再在0、3、6、9、12、24 h时各取一次样.以上所有处理均设置三次独立重复试验.将采集的所有样品分别进行RNA提取并合成cDNA后,参考2.2.5进行qRT-PCR定量分析.
2.2.7BnbHLH122基因的启动子分析 在NCBI上查找到BnbHLH122参考基因上游约2 000 bp左右的DNA序列,将其载入PlantCARE在线软件中进行分析.
3 结果与分析
3.1 BnbHLH122基因编码区克隆和序列比对
采用同源克隆技术,以甘蓝型油菜cDNA为模板进行PCR扩增,得到两条不同的基因序列,分别命名为BnbHLH122-1(GenBank登录号:MT795160)和BnbHLH122-2(GenBank登录号:MT795161).BnbHLH122-1的CDS区全长为1 086 bp,共计编码361个氨基酸,BnbHLH122-2的CDS区全长为1 095 bp,共计编码364个氨基酸.这两个基因的CDS序列的相似性为96.57%,氨基酸序列的相似度为97.53%.与甘蓝型油菜参考基因组数据库中预测的2个参考基因相比,BnbHLH122-2与LOC106435350所编码的氨基酸序列一致,BnbHLH122-1与LOC106346071的氨基酸序列的相似度为98.08%.与拟南芥AtbHLH122基因相比,BnbHLH122-1、BnbHLH122-2与拟南芥AtbHLH122基因所编码的氨基酸序列相似度分别为79.95%、81.51%,氨基酸序列比对结果见图1.

图1 氨基酸序列比对 注:“.”表示缺失位点.Fig.1 Alignment ofamino acid sequences Note:“.” Represents the missing site.
3.2 BnbHLH122蛋白质理化性质分析和三级结构预测
3.2.1 BnbHLH122蛋白质理化性质分析 利用Protparam工具对两个甘蓝型油菜BnbHLH122基因所编码的蛋白质的理化性质进行分析,结果如表5所示,两个基因所编码的蛋白的不稳定系数均高达60多,均为不稳定蛋白质.两个BnbHLH122基因所编码的蛋白质的总平均亲水性(GRAVY)分别为-0.694、-0.684,均为亲水性蛋白质.

表5 BnbHLH122蛋白的理化性质
3.2.2 BnbHLH122蛋白质的三级结构预测 利用SWISS-MODEL在线分析平台构建BnbHLH122蛋白和AtbHLH122蛋白的三级结构模型,结果发现两个BnbHLH122蛋白同AtbHLH122蛋白的三级结构均含有bHLH转录因子家族中的典型的螺旋-环-螺旋结构,进一步表明两个BnbHLH122蛋白属于bHLH转录因子家族,但三者空间结构并不完全相同,存在一定差异.
3.3 BnbHLH122蛋白系统进化树分析
系统进化树结果表明(见图2),BnbHLH122-1蛋白与白菜(Brassicarapa)中的bHLH122转录因子高度同源,BnbHLH122-2蛋白则与甘蓝(Brassicaoleracea)中的bHLH122转录因子高度同源.众所周知,甘蓝型油菜(AACC,n=19)是白菜(AA,n=10)和甘蓝(CC,n=9)自然杂交加倍而成,因此我们推测BnbHLH122-1位于A组染色体,来源于白菜,而BnbHLH122-2位于C组染色体,来源于甘蓝.进化树中BnbHLH122蛋白与拟南芥中的bHLH122转录因子并没有被划分在同一分支上,即它们之间的亲缘关系并没有比甘蓝、白菜、萝卜等物种近,这也暗示着它们之间的生物学功能可能在进化过程中出现了分化.
3.4 BnbHLH122蛋白的亚细胞定位
将构建好的pBI221-BnbHLH122-1-EGFP和pBI221-BnbHLH122-2-EGFP重组质粒转入烟草原生质体进行瞬时表达,结果如图3所示,在对照组35S-EGFP中,烟草原生质体的细胞核和细胞质内均观察到绿色荧光信号,而在实验组35S∶∶BnbHLH122-1-EGFP和35S∶∶BnbHLH122-2-EGFP中,只在烟草原生质体的细胞核内观察到较强的绿色荧光信号,表明BnbHLH122-1和BnbHLH122-2蛋白定位在细胞核,这符合转录因子的一般特征.
3.5 BnbHLH122蛋白的转录激活活性验证
转录激活活性验证结果如图4所示,在二缺(SD/-Leu-Trp)平板上无论是两个实验组还是对照组的酵母细胞都能正常生长,表明实验组和对照组的质粒都成功共转化进了酵母细胞,并且pGBKT7质粒中的TRP1基因和pGADT7质粒中的LEU2基因在酵母细胞中均正常表达.但是,在四缺平板(SD/-Leu-Trp-His-Ade)上只有两个实验组pGBKT7-BnbHLH122-1+pGADT7和pGBKT7-BnbHLH122-2+pGADT7的酵母细胞能够正常生长,对照组pGBKT7+pGADT7的酵母细胞不能正常生长,由此说明BnbHLH122-1和BnbHLH122-2基因所编码的两个蛋白均具有转录激活活性,能够启动下游报告基因的表达.
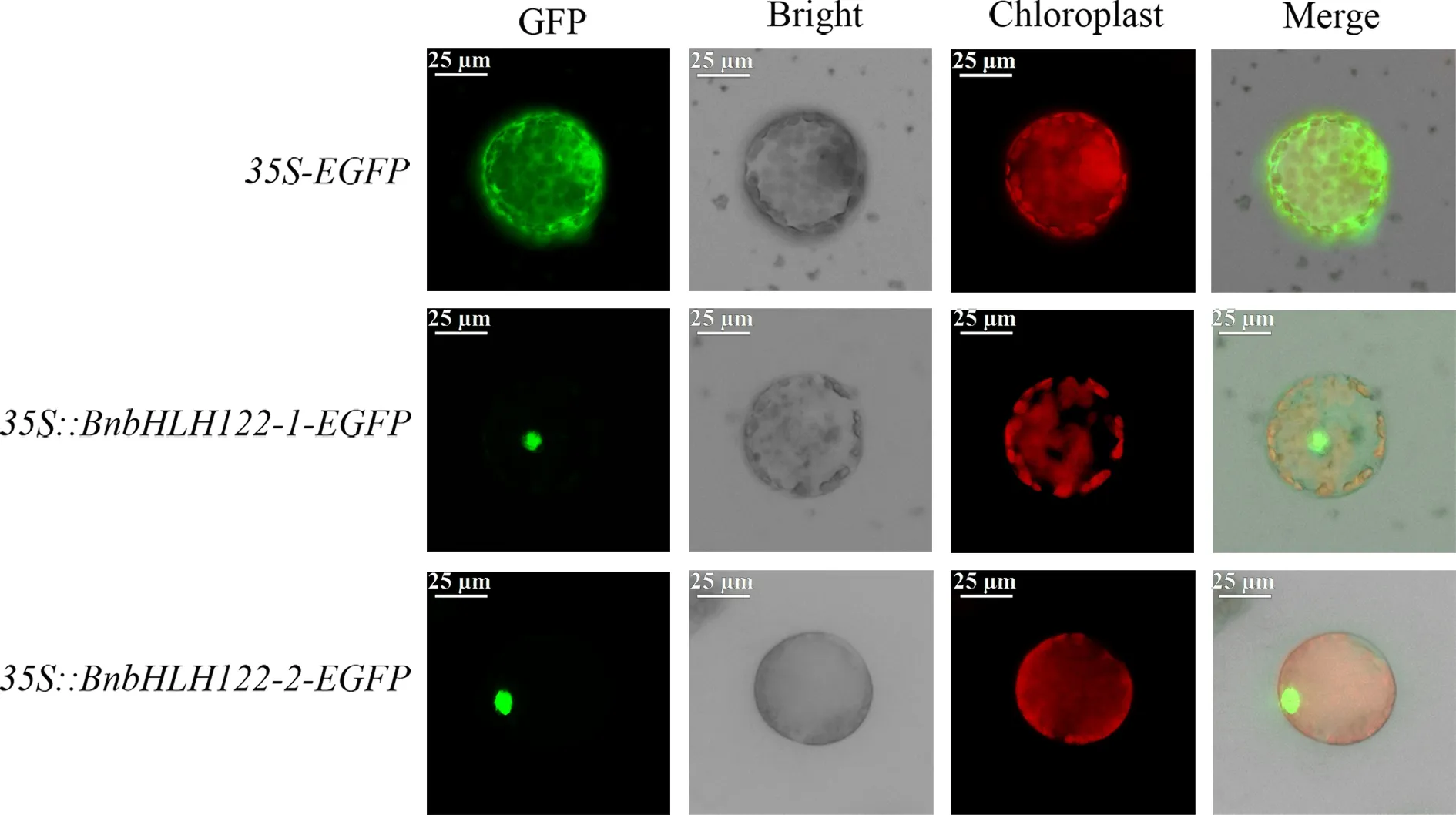
图3 甘蓝型油菜BnbHLH122蛋白的亚细胞定位Fig.3 Subcellular localization of BnbHLH122
3.6 BnbHLH122基因时空表达模式分析
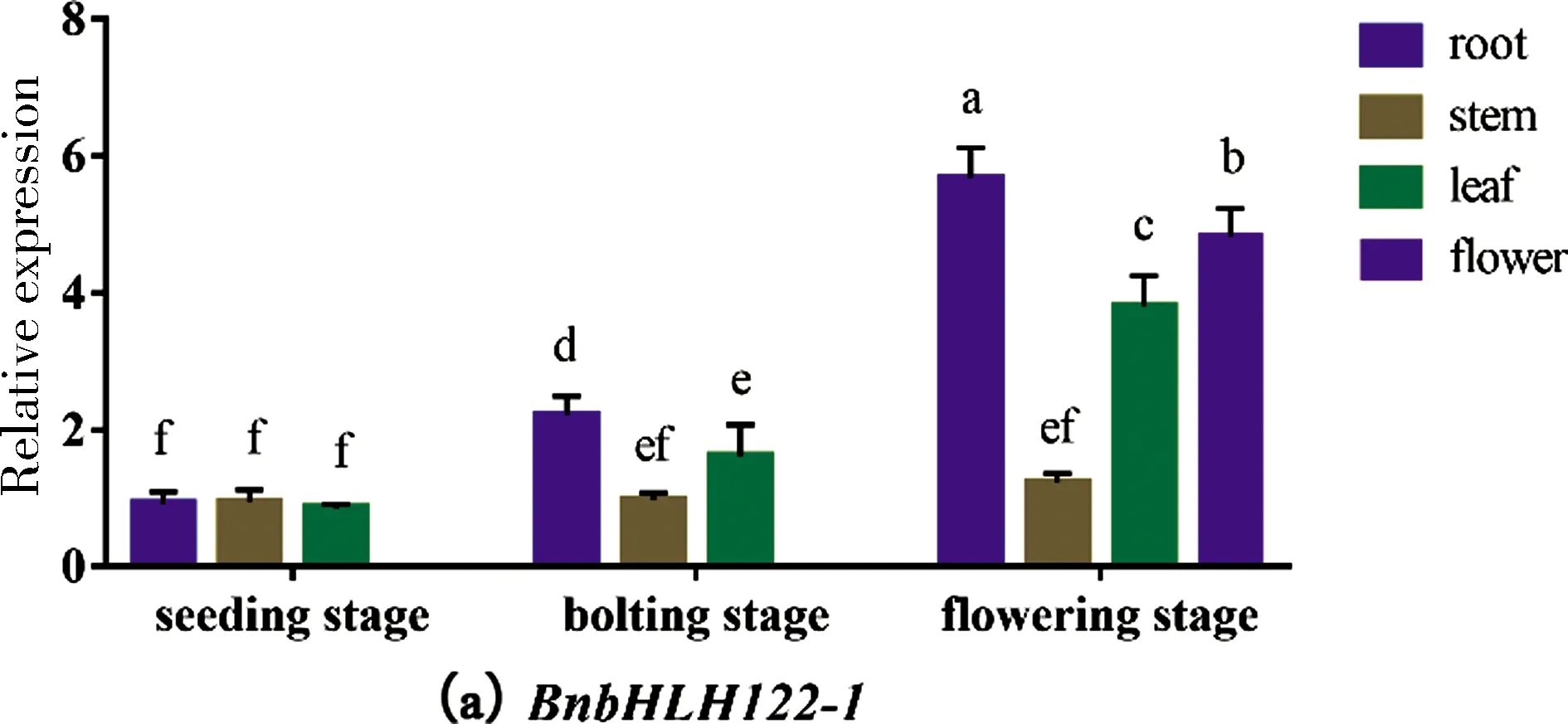
利用qRT-PCR分析甘蓝型油菜BnbHLH122基因的时空表达模式,结果如图5所示,甘蓝型油菜BnbHLH122基因在植株苗期、抽薹期以及花期的根、茎、叶、花中均有表达.从苗期到花期,甘蓝型油菜的根和叶中的BnbHLH122-1基因的表达水平呈现出上升趋势,而茎中BnbHLH122-1基因的表达水平相对较低且稳定,整体而言,BnbHLH122-1基因在花期的根中的表达量最高.从苗期到花期,BnbHLH122-2基因的表达水平在根、茎、叶中均呈现出先下降后上升的趋势,在抽薹期的表达量相对较低.整体而言,相较于其他组织器官,茎中BnbHLH122-2基因的表达量相对较低,在苗期的根中和花期的花中BnbHLH122-2基因的表达量最高.
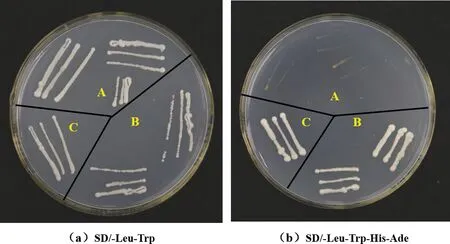
图4 BnbHLH122蛋白转录活性验证结果
3.7 逆境胁迫和激素处理下的BnbHLH122基因表达响应
在非生物胁迫条件下,甘蓝型油菜BnbHLH122基因的表达情况见图6(a)~(e).在低温胁迫下,BnbHLH122-1和BnbHLH122-2基因的表达均受抑制,分别在胁迫后的第6和2 h表达量降至最小值,分别是0 h的0.5和0.2倍.在高温胁迫下,BnbHLH122-1和BnbHLH122-2基因的表达水平均呈现先上升后下降的趋势,分别在胁迫后的第8 h和4 h表达量达到最大值,分别是0 h的10倍和5.4倍.在干旱胁迫下,2个BnbHLH122基因的表达均受诱导,且均在胁迫后的第48 h表达量达到最大值,分别为0 h的3.8倍和3.9倍.此外,BnbHLH122-1和BnbHLH122-2基因还能响应高盐和渗透胁迫,表达量均呈现先上升后下降的趋势,在盐胁迫后的第12 h表达量均达到最大值,分别约为0 h的4倍和3.5倍,在渗透胁迫后第12 h、第9 h表达量分别达到最大值,分别是0 h的6.8倍和9.2倍.
在核盘菌胁迫下,2个BnbHLH122-2基因的表达量均呈现先上升后下降的趋势(见图6(f)),在胁迫后的第9 h时BnbHLH122-1和BnbHLH122-2基因的表达量均达到最大值,分别为0 h的3.5倍和2倍,之后基因的表达量开始下调,到第72h表达量降到最低值,分别为0 h的0.2倍和0.03倍.
在外源激素ABA、SA和MeJA处理条件下,甘蓝型油菜BnbHLH122基因的表达情况如图6(g)~(i)所示,甘蓝型油菜BnbHLH122-1基因的表达受ABA、SA和MeJA的诱导,分别在处理后的第6、12和6 h时表达量达到最大值,分别为0 h的3、11.4和4倍,BnbHLH122-2基因的表达受外源激素SA的诱导,在第6 h达到最大值为0 h的6.9倍,而在ABA和MeJA处理条件下,该基因的表达量下降,分别在第3 h和6 h达到最低值,均只有0 h的0.08倍.
3.8 BnbHLH122基因的启动子序列分析
通过PlantCARE在线软件对两个BnbHLH122参考基因的启动子序列进行分析,结果显示它们的启动子均含有参与ABA响应的元件顺式作用元件ABRE以及参与MeJA响应的顺式作用元件CGTCA-motif、TGACG-motif.此外,LOC106346071参考基因的启动子区还包含参与SA响应的顺式作用元件.

图6 BnbHLH122基因在不同胁迫和激素处理下的表达分析
4 讨 论
bHLH转录因子家族广泛分布在真核生物体内,是植物体内不可缺少的调控因子.本实验从甘蓝型油菜中克隆到2个基因,分别命名为:BnbHLH122-1、BnbHLH122-2.经序列比对、生物信息学分析、亚细胞定位和转录激活活性验证实验结果表明克隆所得基因为甘蓝型油菜bHLH122转录因子基因,且BnbHLH122-1、BnbHLH122-2和AtbHLH122基因的氨基酸序列、蛋白质结构均不完全相同,2个BnbHLH122基因分别与白菜、甘蓝中的bHLH122转录因子基因的同源性较高,与AtbHLH122基因不属于同一分支,由此推测它们发挥的生物学功能可能存在差异.
研究表明,植物bHLH转录因子能够结合在下游基因启动子区的E-box顺式作用元件上,调控相关基因的表达[14],参与植物的生长发育和抗逆反应,例如拟南芥bHLH122转录因子可以参与调节CO基因的表达从而影响拟南芥花周期,促使植株出现早花现象;烟草NtbHLH123转录因子能够激活NtCBF基因的表达,提高植株对冷胁迫的耐受性[10].本实验通过qRT-PCR技术分析了2个BnbHLH122基因的时空表达模式和胁迫响应,结果发现它们主要在甘蓝型油菜的根和花中表达,并且响应低温、高温、干旱、高盐、渗透以及核盘菌胁迫,在多种胁迫条件(如低温、高温、渗透等)下两个基因的表达模式存在差异,例如表达量的极值、达到极值的时间点以及表达量上调或者下调后持续的时间等,因此推测BnbHLH122-1基因和BnbHLH122-2基因不仅能够参与调节甘蓝型油菜的花和根的生长发育过程,在甘蓝型油菜抵御生物胁迫和非生物胁迫过程中发挥着重要的调节,并且它们之间可能不存在功能冗余,而是通过相互配合共同参与调控,但具体的调节机制需要进一步研究.
植物激素ABA、JA所介导的信号转导途径不仅能够参与调节植物的生长发育,同时也在植物抵御外界胁迫过程中发挥重要作用[16-17].研究表明,一些bHLH转录因子能够通过调节ABA和JA信号通路参与植物的抗逆过程,如bHLH转录因子ZmPIF3是ABA信号途径中的正向调节因子,它通过减少气孔开口以控制水分流失来增强植株节水和抗旱性状[18]等.本次实验结果表明甘蓝型油菜BnbHLH122-1和BnbHLH122-2基因响应ABA和MeJA激素处理,但两者的响应模式存在明显差异,而且BnbHLH122基因的启动子区还含有依赖于ABA信号通路的响应元件ABRE以及MeJA响应元件CGTCA-motif和TGACG-motif,由此推测甘蓝型油菜中的BnbHLH122-1和BnbHLH122-2基因对胁迫的响应过程可能依赖于ABA信号转导途径和MeJA信号转导途径,并且它们可能以不同的调节方式参与调控相关靶基因的表达,从而协同调节植物的抗逆反应.
此外,2个BnbHLH122基因的表达还受激素SA的诱导,BnbHLH122基因的启动子区也找到了与SA信号转导途径相关的响应元件.SA信号通路是植物抗病过程中重要的调节途径[19],表达分析显示甘蓝型油菜BnbHLH122基因响应核盘菌胁迫,因此推测甘蓝型油菜BnbHLH122基因可能参与调节植株的抗病过程,并且该过程还依赖于SA信号转导途径.但有趣的是,本实验发现核盘菌和SA处理均能诱导BnbHLH122-2基因的表达,JA处理能抑制该基因的表达,研究表明,JA和SA所介导的信号通路能以相互拮抗的方式调控植株的抗病过程[20],如拟南芥WRKY70转录因子[21],这似乎暗示着BnbHLH122-2基因可能以JA和SA信号通路相互拮抗的方式调控植株的抗病过程.
综上所述,甘蓝型油菜BnbHLH122基因响应高温、低温、高盐、干旱、渗透、核盘菌等多种胁迫,对该类基因的功能研究将有利于培育出具有更强抗逆性甘蓝型油菜新品种,但它们的具体的抗逆机制尚不明确,还需进一步的探究.
