拟南芥CARK家族响应脱落酸信号的研究
2021-04-08黄彦菱姜雅淇李小意李高明
黄彦菱, 姜雅淇, 李小意, 李高明, 杨 毅
(1.四川大学生命科学学院 生物资源与环境教育部重点实验室, 成都 610065;2.四川大学文学与新闻学院, 成都 610065)
1 引 言
植物不能像动物那样通过迁移来寻找适宜的生存环境,因此,为了能够在不断变化的环境中生存,植物通常会被不同的环境驯化出一系列的调控机制[1].在遭遇干旱、冷冻、盐碱等逆境胁迫时,植物的各种内源激素便单独或协同地发挥重要作用以应对这些非生物胁迫[2].植物在干旱时,体内ABA含量迅速增加,进而激活ABA信号通路,合成干旱相关基因的表达,或通过抑制气孔开放以降低植物的蒸腾作用,从而使其更好地应对干旱胁迫.此外,ABA参与调节植物生长发育的诸多过程,能够迟滞种子的萌发,抑制植物的生长[3-4].
ABA通路中三大核心元件包括:ABA受体(Regulatory Components Of ABA Receptors/Pyrabactin Resistance/ PYR Like, RCAR/PYR/PYL)、SNF1相关联的蛋白激酶(SNF1-Related Protein Kinases, SnRK2s)和下游的转录因子.ABA存在时,在ABA受体与ABA结合后,抑制蛋白磷酸酶2C(protein phosphatase 2Cs, PP2Cs)的活性,从而释放了对SnRK2s的抑制[5-6].SnRK2s自我磷酸化后,激活其磷酸激酶活性,磷酸化离子通道蛋白,控制对渗透胁迫的适应性反应[7].ABA受体除了响应ABA应答外,也会参与到植物对其它非生物胁迫的应答.近期研究表明,在拟南芥中过表达RCAR12或RCAR13 后,经过高温或者冷冻处理,与野生型的拟南芥相比,其存活率明显较高,揭示了RCAR12和RCAR13可能在拟南芥对极端温度的响应方面发挥了积极作用[8].在小麦中,TaOPR1(12-Oxo-Phytodienoic Acid Reductase 1)通过ABA信号通路调控逆境因子MYC2(Myelocytomatosis 2), 从而提高了小麦对盐的耐受性[9].因此,研究植物对ABA的响应有利于提升农作物对非生物胁迫的适应性,对指导农业生产具有重要意义.
本实验先前以拟南芥中的ABA受体RCAR3/PYL8为诱饵筛选到CARK1,荧光双分子互补实验和酵母双杂交实验证明:该激酶分别与RCAR3、RCAR11、RCAR12、RCAR13、RCAR14在体内外均有较强的相互作用,并且能够磷酸化它们[10].根据蛋白质同源性分析,除CARK1外,该家族还拥有10个同源蛋白,分别命名为CARK2-11,同时将该家族分为三个亚家族,其中CARK4为Ⅲ亚家族,CARK5-9为Ⅱ亚家族,剩下的均为Ⅰ亚家族.前期的研究证明了CARK1通过磷酸化ABA受体从而正调控ABA信号的传递.因此,通过对CARK家族单突变体和双重突变体的分析,探究CARKs是否全部参与ABA信号的调控,且在ABA信号途径.
2 材料与方法
2.1 材 料
cark1,cark2,cark4,cark5,cark6,cark7,cark11七种T-DNA插入突变体从拟南芥生物资源中心(ArabidopsisBiological Resource Center, ABRC)购买,背景为哥伦比亚野生型(Col-0),详细信息见表1.鉴定引物根据突变体种子编号在http://signal.salk.edu/index.html中查找,引物由北京擎科公司合成.

表1 carks突变体信息
2.2 方 法
2.2.1 拟南芥基因组的提取和PCR扩增 本实验用Plant Genomic DNA Extraction Kit试剂盒(Biovision).取1 cm2左右的拟南芥嫩叶片,加液氮磨碎,然后加buffer A 400 μL;65 ℃加热10 min,离心10 min,转移上清,加400 μL buffer B混匀;离心10 min,加400 μL buffer C洗涤后离心去废液,加适量buffer D溶解.以提取的基因组DNA为模板,加入引物和2×T5 Super PCR Mix(北京擎科),PCR扩增检测条带.
2.2.2 拟南芥的杂交 为了获取双重突变体,当单基因突变体拟南芥开花期时,选择刚冒白的花朵,除去多余部分,只留柱头.将父本的花粉抖到柱头上,用套子覆盖,第二天重复此授粉过程.由此获得的杂交种子用于双重突变体的PCR筛选和鉴定.
2.2.3 ABA抑制的种子萌发 用MS固体培养基培养种子,ABA处理的浓度为0.3、0.5和1 μmol/L,分别统计萌发的种子数和总数,间隔12 h统计一次,并计算萌发率,生物学重复三次.
2.2.4 ABA抑制的绿芽率 用MS固体培养基培养种子,ABA处理的浓度为0.3、 0.5和1 μmol/L.待种子萌发后,每隔24 h统计种子子叶变绿的个数和种子总数,并计算百分率,生物学重复三次.
3 结 果
3.1 carks突变体的鉴定
PCR鉴定结果表明成功构建了十种双重突变体,如图1所示,左上角第一个株系是双重突变体cark1cark4,记为cark1/4.同理,其余九种双重突变体分别记为cark1/7、cark1/11、cark4/5、cark4/7、cark4/11、cark5/7、cark5/11.提取构建的双重突变体拟南芥的基因组为模板,进行PCR扩增.其中引物LP和RP分别位于T-DNA插入位点的两端,LP为正向引物,RP为反向引物,LB1.3为插入到拟南芥基因组上的T-DNA载体片段的末尾端,且为正向引物.用LP+RP这对引物能扩出条带时,表明没有T-DNA插入;用LB1.3+RP这对引物能扩出条带时,表明有T-DNA插入.所以,用这两对引物同时扩增一个模板时,如果只出现LP+RP的条带,表明是野生型;若只出现LB1.3+RP的条带,表明是突变体;若两者皆有条带,则是杂合植株.由此观之,上述双重突变体的纯合植株已全部构建成功.
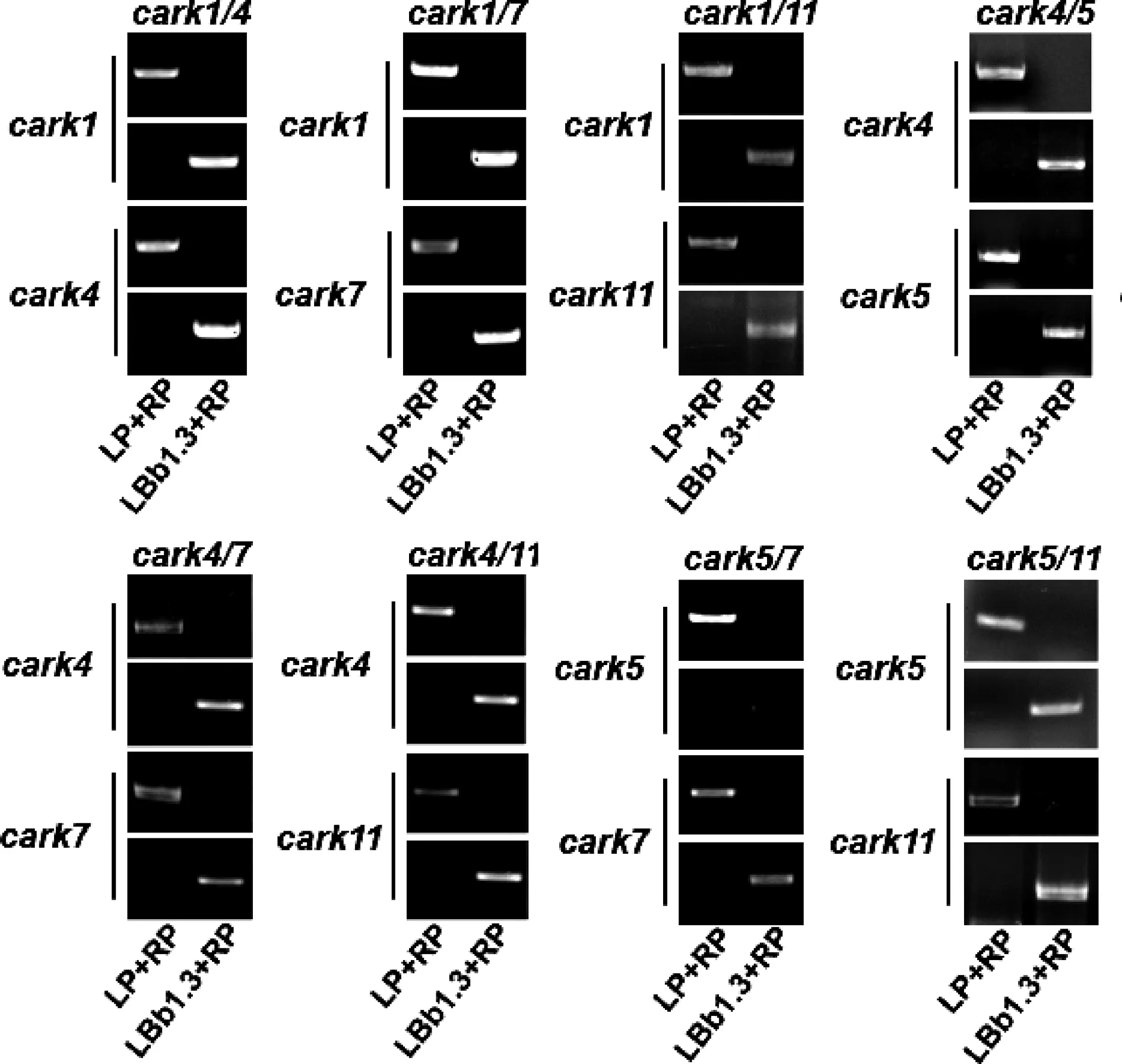
图1 carks双重突变体基因组的PCR鉴定Fig.1 PCR identification of carks double mutant plants
3.2 ABA抑制的种子萌发和子叶变绿分析
在种子萌发和子叶变绿阶段,cark1、cark4、cark5、cark6单基因突变体相较于野生型对ABA不敏感,如图2所示.在MS固体培养基上,cark1、cark4、cark5、cark6突变体和野生型的萌发趋势基本一致(图2a),而用ABA处理后(图2b~d),虽然所有株系的萌发都被抑制,但cark1、cark4、cark5、cark6突变体的萌发率均较野生型高.用0.3 μmol/L的ABA处理所有株系7 d后,野生型的绿芽率只有22%左右(图2e、f),而cark1为76%,cark4为62%,cark5为39%,cark6为46%左右.以上结果表明,CARK1、CARK4、CARK5、CARK6在ABA介导的抑制种子萌发和子叶变绿中起着正调控作用.

图2 carks单基因突变体在种子萌发和子叶变绿时对ABA的敏感分析(Ⅰ) ** P<0.01.Fig.2 carks single gene mutant plants were insensitive to ABA in ABA-mediated seed germination and green shoots (Ⅰ) ** P<0.01.
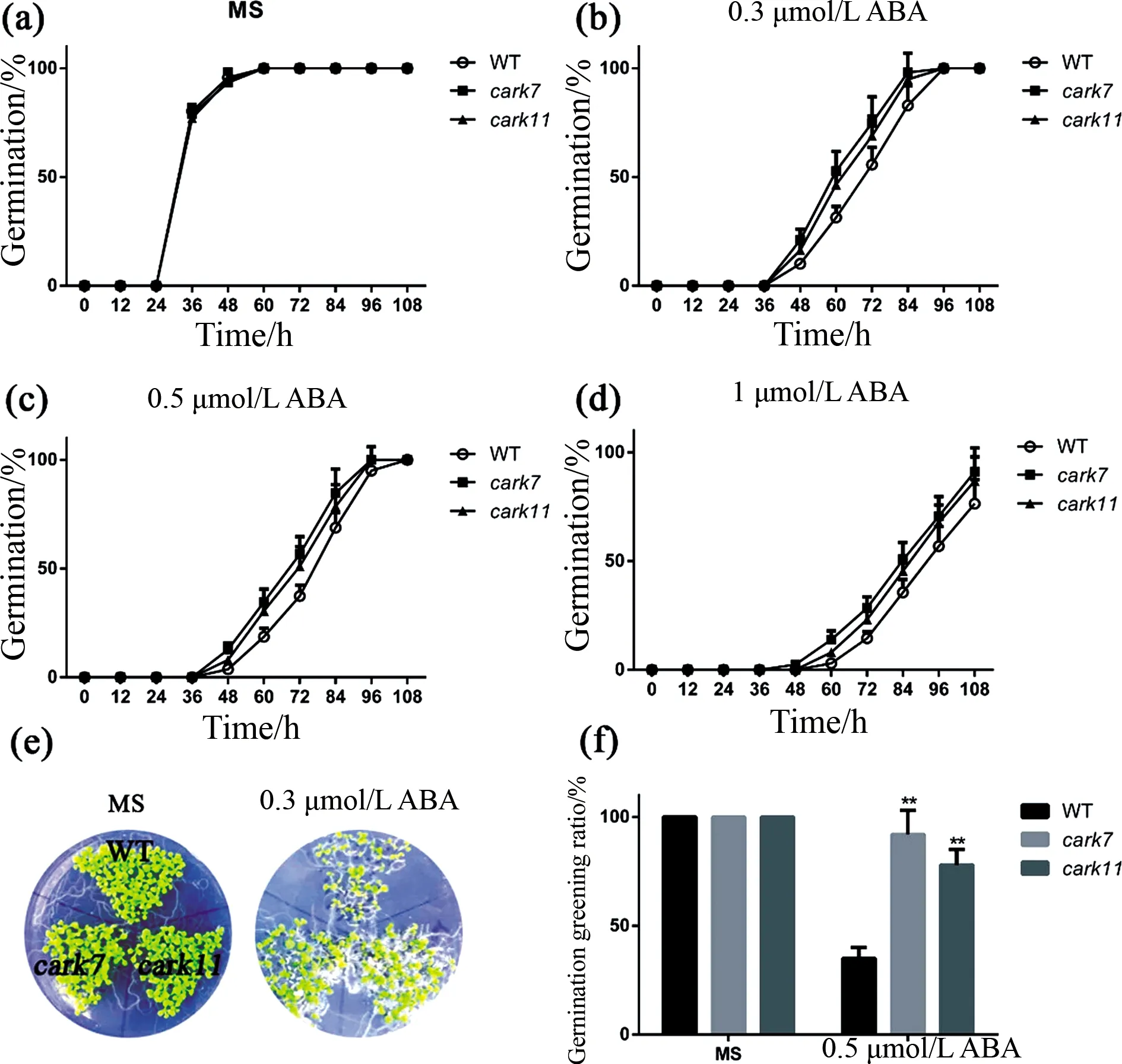
图3 carks单基因突变体在种子萌发和子叶变绿时对ABA的敏感分析(Ⅱ) **P<0.01.Fig.3 carks single gene mutant plants were insensitive to ABA in ABA-mediated seed germination and green shoots (Ⅱ) ** P<0.01.
相似地,在种子萌发和子叶变绿时期,cark7、cark11单基因突变体相较于野生型对ABA不敏感,如图3所示.在MS固体培养基上,cark7、cark11突变体和野生型的萌发基本一致(图3a).用0.3 μmol/L ABA处理后(图3.3b-d),cark7、cark11突变体的萌发率均比野生型高,差异均较大.用0.3 μmol/L的ABA处理8 d后,野生型的绿芽率为35%左右(图3e、f),而cark7为92%,cark11为78%.以上结果表明CARK7和CARK11功能缺失的株系在ABA介导的抑制种子萌发和子叶变绿时对ABA不敏感.
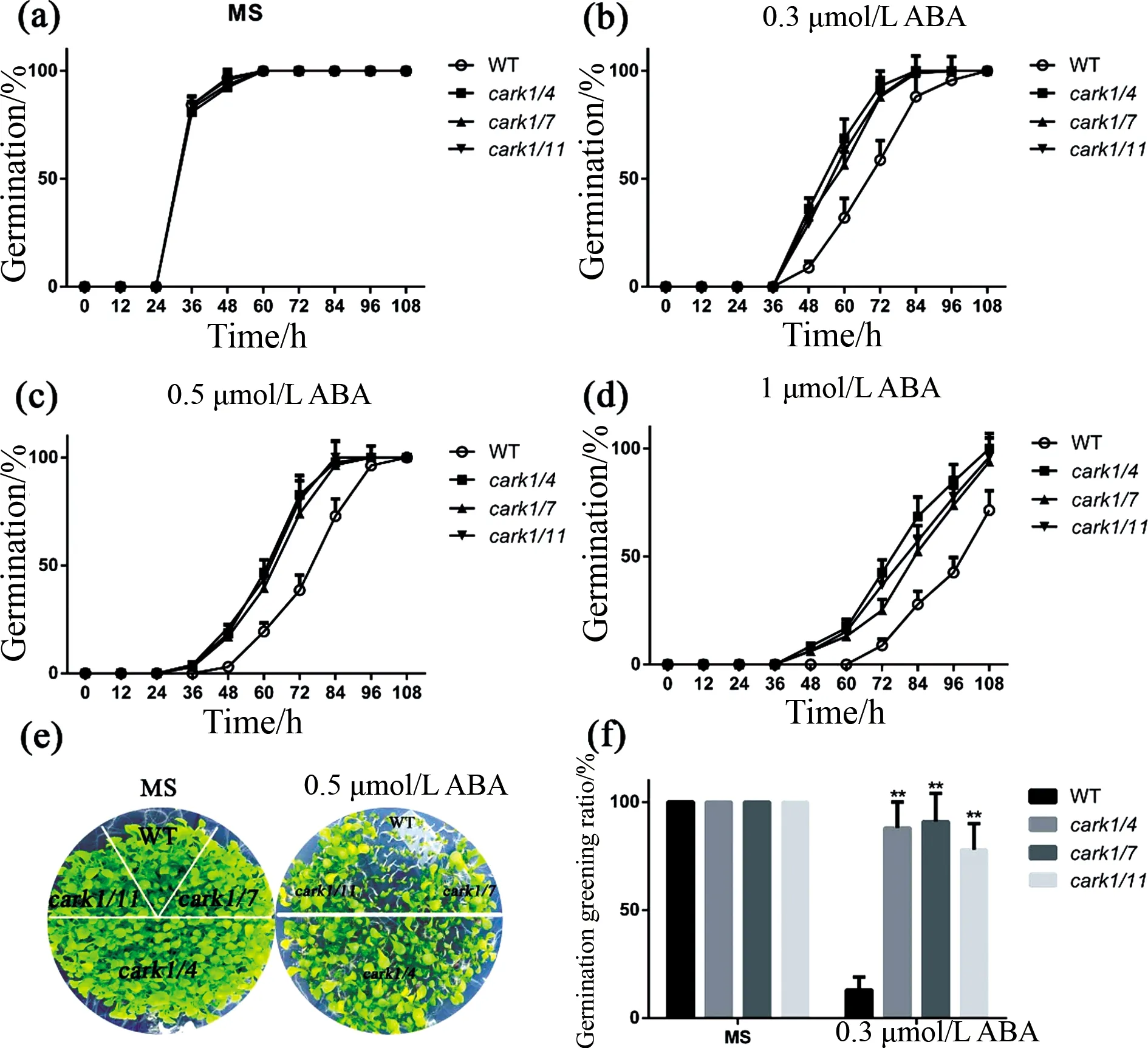
图4 carks双重突变体在种子萌发和子叶变绿时对ABA的敏感性分析(Ⅰ) **P<0.01.Fig.4 carks double mutant plants were insensitive to ABA in ABA-mediated seed germination and green shoots (Ⅰ) ** P<0.01.
cark1/4、cark1/7、cark1/11双重突变体在种子萌发和子叶变绿阶段相较于野生型对ABA极不敏感,如图4所示.cark1/4、cark1/7、cark1/11双重突变体和野生型的萌发在不处理时几乎一致(图4a).用ABA处理时(图4b~d),cark1/4、cark1/7、cark1/11双重突变体的萌发率均比野生型高,且差异均较大.用0.5 μmol/L的ABA处理全部株系,10 d后,野生型的绿芽率只有13%左右(图4e、f),而cark1/4为88%,cark1/7为91%,cark1/11为78%.其余的双重突变体cark4/5、cark4/7、cark4/11、cark5/7、cark5/11在萌发和子叶变绿时同样对ABA不敏感,如图5所示.无处理时,上述双重突变体和野生型的萌发率保持一致(图5a).用ABA处理时(图5b~d),cark4/5、cark4/7、cark4/11、cark5/7、cark5/11双重突变体的萌发率均比野生型高,且差异均很大.用0.5 μmol/L的ABA处理10 d,野生型的绿芽率为20%左右(图5e、f),而cark4/5、cark4/7、cark4/11、cark5/7、cark5/11则分别为81%、89%、76%、79%、85%.以上结果表明,carks双重突变体在种子萌发和子叶变绿阶段对ABA的不敏感性强于carks单突变体.
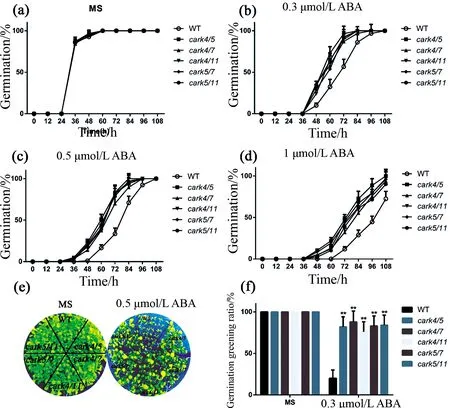
图5 carks双重突变体在种子萌发和子叶变绿时对ABA的敏感性分析(Ⅱ) **P<0.01.Fig.5 carks double mutant plants were insensitive to ABA in ABA-mediated seed germination and green shoots (Ⅱ) ** P<0.01.
4 讨 论
截至目前,已经发现了四个激酶能磷酸化ABA受体.但是它们的功能以及对ABA信号通路的影响是不同的.在正常情况下,TOR(Target of Rapamycin)磷酸化RCAR12的S119位点, 抑制ABA信号通路;在胁迫下,SnRK2s磷酸化TOR的一个亚基Raptor, 从而抑制TOR的激酶活性[11].随后研究者又发现,激酶AEL(ArabidopsisEL1-like)分别磷酸化RCAR11的S109和S156,RCAR12的S136和S182的位点,促进泛素化修饰,从而加剧降解,因此AEL在ABA信号通路中起负调控作用[12].质膜磷酸激酶CEPR2(C-terminally encoded peptide receptor 2)磷酸化被募集到质膜上的RCAR10的S54, 促进RSL1泛素连接酶对RCAR10的泛素化,进而促进26S蛋白酶对其降解[13].本研究的蛋白质磷酸激酶CARK1磷酸化RCAR3的T77位点和RCAR11的T78位点.由此可见,ABA受体不同位点被磷酸化导致其对ABA信号途径的影响不同,从而形成了复杂的调控网络,以应对多变的生态环境.
carks单基因突变体cark1、cark4、cark5、cark6、cark7和cark11在种子萌发和子叶变绿阶段相对于野生型对ABA不敏感(图2和图3),carks双重突变体cark1/4、cark1/7、cark1/11、cark4/5、cark4/7、cark4/11、cark5/7和cark5/11同样也在萌发和子叶变绿阶段相较于野生型对ABA不敏感,且这种不敏感性强于单基因突变体(图4和图5),这说明CARKs家族成员在ABA信号途径中的功能是冗余的.实验室前期的工作表明CARK1能够磷酸化ABA受体[6-7],所以以CARKs基因功能缺失的突变体为材料,探究这些突变体在ABA处理下的表型,从而探讨CARKs在ABA信号通路中的作用.在预实验中,由于cark2株系在萌发时对ABA的耐受性与野生型差异较小,因此在构建双重突变体时未将其作为重点.
结果表明,CARKS存在功能冗余性,接下来可以通过体内外蛋白质互作的方法分析不同的CARK是否会与相同的ABA受体存在相互作用,进而用体外磷酸化实验分析这些CARKs激酶是否磷酸化相同的ABA受体,或者分析这些CARKs激酶在体内对相同的ABA受体稳定性的影响.如果实验结果表明不同的CARKs激酶会磷酸化相同的ABA受体,并且会影响其体内的蛋白水平,那么就找到了其存在功能冗余性的原因.研究CARKs在ABA信号通路中的功能有助于为研究植物应对逆境时的调节机制提供新思路,提升农作物对逆境的适应性,并最终提高农作物的产量.
