随机光学重构超高分辨显微镜的使用研究与共享管理
2021-04-07刘双双方三华
尹 伟, 刘双双, 方三华
浙江大学医学院, 浙江 杭州 310058
近年来,新的荧光探针不断涌现,光学衍射极限不断被突破[1],研究者开发了多种超高分辨率成像方法,主要包括:光激活定位显微技术(photoactivated localization microscopy, PALM)[2]、随机光学重构显微技术(stochastic optical reconstruction microscopy, STORM)[3]、受激发射损耗显微技术(stimulated emission depletion, STED)[4]和结构光照明显微技术(structure illumination microscopy, SIM)[5]。
2006年底,STORM 技术由华裔科学家庄小威首次提出,庄小威研究组发现应用特定波长的激光来激活探针,用另一束波长激光来观察,精确定位漂白荧光分子,反复循环后可得到内源蛋白的高分辨成像,命名为随机光学重构显微技术(STORM)[6]。由庄小威教授与尼康公司合作研发的N-STORM系统,正是基于此原理的超分辨显微镜。
浙江大学医学院公共技术平台于2014年引进一台随机光学重构超高分辨显微镜(Nikon N-STORM),集随机光学重构超高分辨、激光扫描共聚焦、全内反射三大重要技术于一体。仪器配置全面,从三大主要技术功能满足了科学研究的不同需求。本文对随机光学重构超高分辨显微镜的原理、软硬件组成、技术参数、样品制备方法、仪器操作使用、应用维护及共享管理方面进行了详细介绍。
1 随机光学重构超高分辨显微镜的原理
STORM成像原理是利用荧光染料分子“光控开关”或荧光蛋白的“光控转化”性质,达到在一个衍射极限空间内(200~300 nm)随机“点亮”单个荧光分子并进行高精度定位的目的[7]。随机和重构是其两大核心技术,每个采样点只采集部分随机处于“开”的释放荧光状态的分子,而在下一个采样点,新一批光斑改为分子光被采集;重复上万帧使得样品中的光斑至少被采集一次。最后采集得到的光斑经高斯拟合和精确的单分子中心定位算法,计算出中心坐标位置,利用位置信息重构出样品的结构[8]。
2 Nikon N-STORM的组成和技术参数
STORM、共聚焦成像用激光系统:配备激光耦合平台LU4A Laser Module,包含常用红色激光器(647 nm、200 mW)、紫色激光器(405 nm、100 mW)、多线氩离子激光器(Multi-Ar laser、65 mW)和黄色固体激光器(561 nm、150 mW)。
STORM成像光学组件和相机:配备单模光纤,3D-STORM组件,高灵敏度电子倍增相机(Andor ixon DU-897)。
工作站及软件包:惠普工作站,共聚焦软件包(NIS-Elements),超高分辨率图像分析包(NIS-N STORM Analysis)。
超高分辨专用成像物镜: CFI Apochromat TIRF 100X,数值孔径NA=1.49,工作距离WD= 0.12 mm,仪器组成结构见图1。

图1 STORM仪器结构示意图
3 随机光学重构超高分辨显微镜(N-STORM)样品制备
3.1 nSTORM特异荧光抗体标记制备方法
在随机光学重构超高分辨系统中,主要有nSTORM和cSTORM两种成像方式,二者最主要的区别在于染色使用的荧光二抗不同。其中,nSTORM使用的抗体是自制标记有特定比率的活化染料和成像抗体分子,具有波长特异性光学可控开关的性质。以 Rabbit-Cy3-Alexa647抗体为例,标记过程:(1)将商业化的Cy3染料 (PA23001, GE Healthcare)溶于20 μL的DMSO中并混匀,分装为10管,真空离心至只剩染料粉末,保存于-20 ℃。(2)将商业化的Alexa647染料 (A20006, invitrogen)溶于100 μL的DMSO中并混匀,均分为50管,真空离心至只剩染料粉末,保存于-20 ℃。(3)取出Cy3染料和Alexa647染料各自一管,溶于10 μL DMSO中,吹打混匀。(4)将 3 μL Cy3+1 μL Alexa647溶液混入50 μL 无任何染料标记的抗体 (711-005-152)中,充分吹打混匀,放在微震荡器上慢速反应30 min。(5)准备NAP-5凝胶柱:取50%乙醇封存的NAP-5凝胶柱,PBS洗3次。(6)混合液定容:混合液加PBS至200 μL,轻轻混匀。(7)过柱:待柱中液体全部进柱后加入混合液,待混合液全部进柱后再加550 μL PBS,可见到柱中混合液分层,待不滴液时再加300 μL PBS,并以1.5 mL EP管收集此后滴出的抗体混合液。过柱时应呈现两条带,分带清晰且颜色明显者为佳。(8)利用紫外分光度计测量抗体和染料浓度。一般可获得200~300 μg/μL的抗体,总量约300 μL的抗体,其中Cy3∶Alexa647∶antibody的比约2∶0.6∶1为最佳。
3.2 STORM成像Buffer配制
在STORM成像之前,还需要配制成像Buffer,以提供实验所需要的巯基、除氧剂、抗光漂白能力,调整缓冲液pH=7.5左右为宜。Buffer A: 10 mmol/LTris (pH 8.0)+50 mmol/L NaCl;Buffer B: 50 mmol/L Tris-HCl (pH 8.0)+10 mmol/L NaCl + 10% Glucose;Buffer C for live cell: DMEM+75 mmol/L HEPES+1% Glucose;GLOX solution (25 μL)。
根据超高分辨样品不同,可选择不同的Buffer配制方案,成像前将Buffer加入样本槽内,每个八孔板推荐加入500~700 μL左右。溶液需新鲜配制。3种配制方案如下:(1)STORM Imaging Buffer with MEA(拍摄持续时间2 h左右),在冰上将7 μL GLOX、70 μL 1 mmol/L MEA 和620 μL Buffer B加入1.5 mL EP管内。(2)STORM Imaging Buffer with 2-mercaptoethanol(拍摄持续时间1 h左右),在冰上将7 μL GLOX、7 μL 2-mercaptoethanol 和690 μL Buffer B加入1.5 mL EP管内。(3)Live Cell STORM Imaging Buffer with 2-Mercaptoethanol (拍摄持续时间1 h左右),在冰上将7 μL GLOX、3.5 μL 2-mercaptoethanol 和690 μL Buffer C加入1.5 mL EP管内。
4 N-STORM操作流程
4.1 开机顺序
遵循“先开硬件,再进软件”的原则,打开激光台,分别开启所需激光器(先打开激光器电源,再开钥匙)。注意647 nm激光器需先打开硬件控制器开关和钥匙,再通过软件开启。依次开启显微镜Ti-E电源、电动载物台电源、piezo控制器电源、卤素灯电源、汞灯电源、计算机与显示器,启动“NIS-Elements”软件,选择ANDOR with N-STORM模块进入系统。根据自己实验设定和需求选择不同拍摄模式,STORM分为N-STORM、C-STORM、多通道同时连续激活3种拍摄模式,如图2所示。
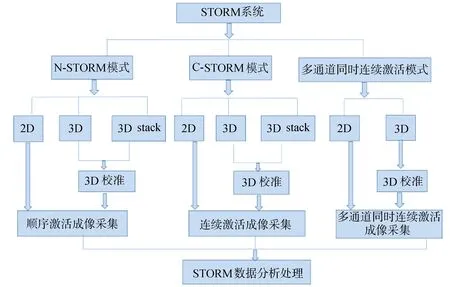
图2 STORM拍摄模式
4.2 成像操作流程
拍摄前预览:将光路切换到右侧光路EMCCD端口,确认3D-STORM 柱透镜的位置。解除激光锁,打开647 nm激光,Live预览模式下找到标本拍摄区域,可拍摄一张宽场图像以作为STORM 图像的对比图。用TIRF照明方式观察标本并切换不同拍摄模式的滤光块后,点击【Live】获取实时预览影像。
Sequential Activation拍摄流程:STORM拍摄主要有2D-STORM和3D-STORM两种模式。为实现3D-STORM超分辨率成像,一般在光路中照相机和物镜中间加入3D柱状透镜,引入非对称性通过拟合来实现三维成像[9]。和2D-STORM拍摄比,3D-STORM操作较为复杂,为方便说明,举例用如下两染料对拍摄(通道1:Alexa405-Alexa647 通道2:Cy3-Alexa647 ),介绍3D-STROM操作:
(1)点击N-STORM面板中的settings按钮,确认拍摄模式为【Sequential Activation】和每次循环拍摄帧数等参数,点击【Edit】进入通道设置,【Activation Frame】通常为1,【Reporter Frame】通常为3,确认好Activator和Reporter的激发波长及通道颜色,点击OK。
(2)在控制面板中选择【3D-STORM】。
(3)TIRF照明器的角度设定,选中647 nm激光器,调节PFS并找到焦面,细微调节照明器角度,使脱焦点尽可能少,背景干净。
(4)将Reporter laser 647 nm功率升至100%。确保Activation laser(405 nm或者561 nm)没有被选中,将功率设置为0.3%~1%。选中Activation laser约停留1 s,再取消选中重复此过程,检查图像有没有因为选中了Activation laser而瞬时变得更亮。
(5)让染料进入暗态。将647 nm激光功率开至100%,荧光信号变为闪烁的单分子点状态。
(6)设置N-STORM拍摄条件:选中所用的荧光染料Activation laser功率设定约0.3%~1%,Imaging laser(此处为647 nm),功率设定皆为100%。【Period Count】设置为5000~20000,自动保存数据,点击【Run Now】。
(7)计算玻片表面至观察目标位置之间的Z轴距离,将3D助透镜推进去(2D-STORM中此步骤不需要进行),首先将焦面从标本面移动到玻片表面并聚焦,然后将焦面聚焦到标本面后点击【OK】。
(8)实时图像采集(图3)过程中,可通过调节光强和ND片来控制每帧上的采集点数。通常点的密度应不浓密到重叠,也不要太过稀疏,如256×256 像素的每帧图片上有分布均匀的100~200个点为最优。
Continuous Activation拍摄:点击N-STORM面板中的settings按钮,确认各参数,模式选择为【Continuous Activation】,在【Interleave Channels】前打勾,固定细胞选【Fixed Cell】,活细胞选【Live Cell】,活细胞对速度要求很高,通常只做一个通道,其余步骤同Sequential Activation。
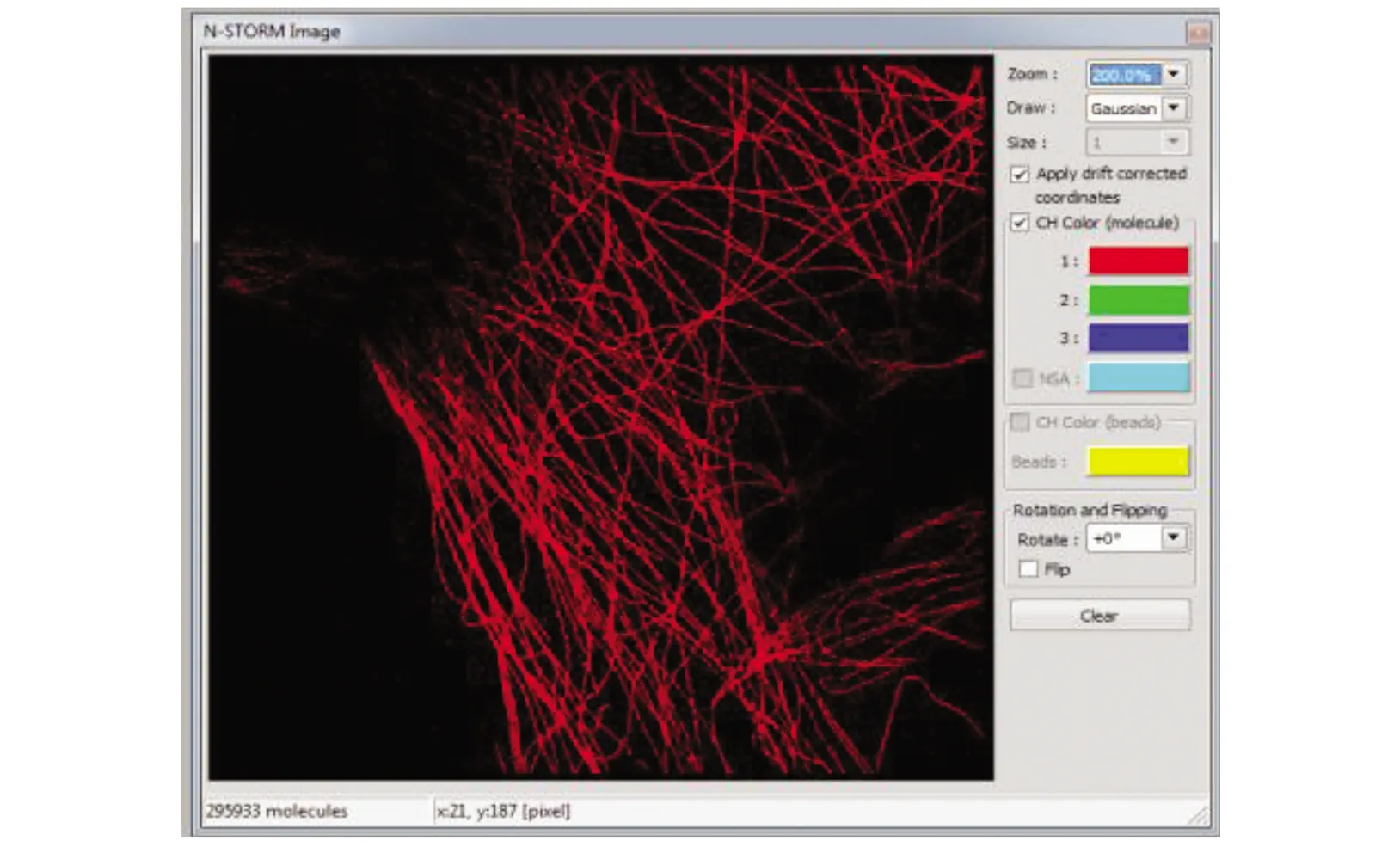
图3 STORM实时图像采集
STORM图像分析处理步骤:(1)点击【Analysis GUI】、【File Open】,打开需要分析的ND2文件。(2)点击小山峰图标检查被认为是信号的亮点的最低荧光值。选择被认定为信号的亮点中最暗的点,读取【Peak Height】的数值,此数值会在下一步中用于设定阈值以区分信号和噪点。分析多通道图像时,每一个通道均需进行这一步。(3)点击筛选信号亮点,根据前一步中确定的信号亮度最小值指定Minimum Height的参数大小,设定好参数后,点击开始STORM分析。(4)勾选【Drift Correction】,设定【Periods】为1,点击【Test】进行试分析,针对当前显示的这个period进行。试分析完成后,会弹出对话框,点击【OK】,对其检查以确保单分子点都被正确的筛选。选择【Start】对整个图像数据进行分析。(5)点击三维框可以展示3D STORM图像,并制作视频文件。图4为重建的STORM双色图像。
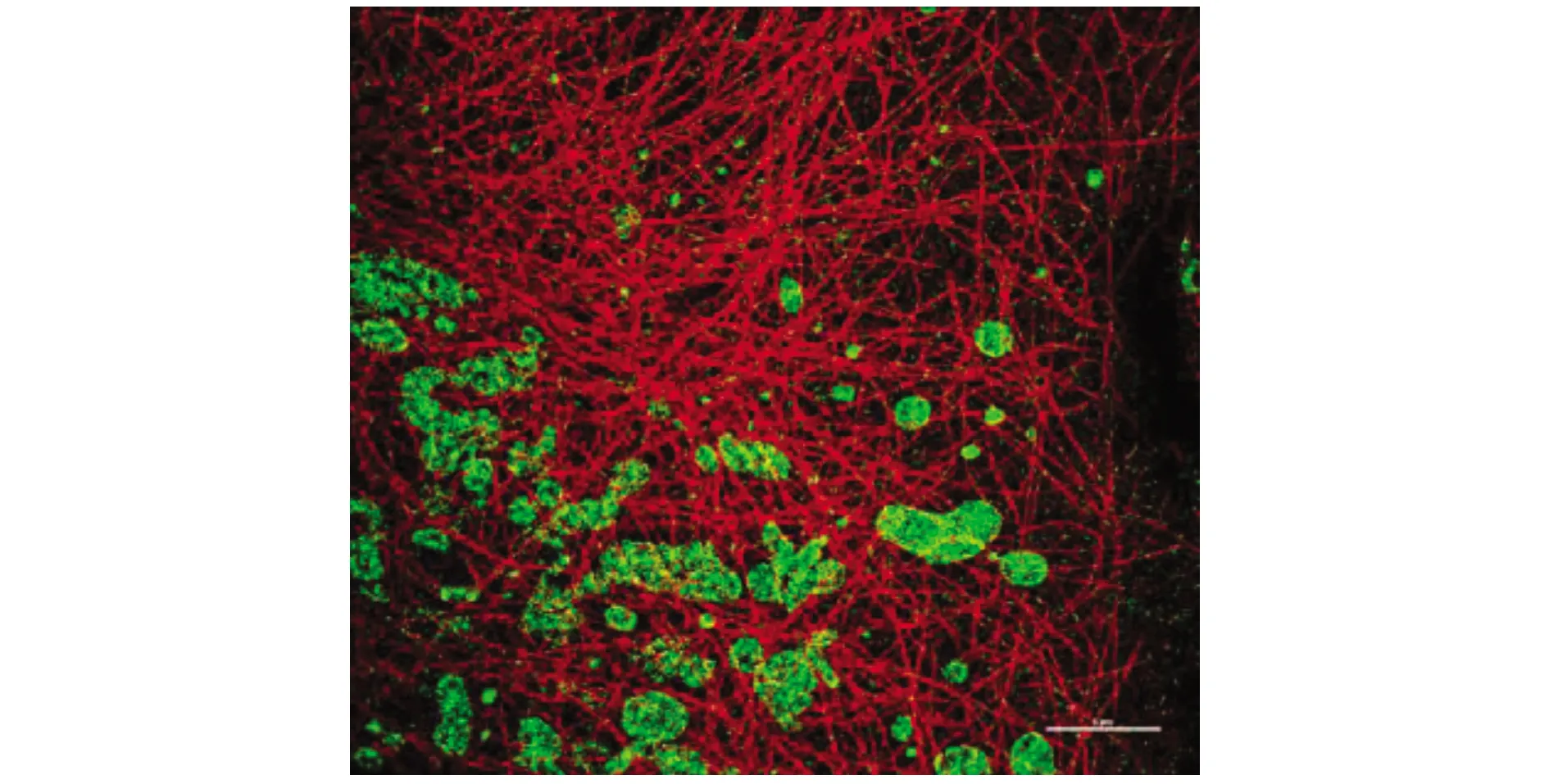
图4 重建的STORM双色图像
STORM日常关机步骤:关闭NIS软件,打开Laser 647软件,将200 mV的激光功率逐渐降至20 mV(200→150→100→50→20),再将“ON”状态打到“OFF”状态,退出软件,关闭647 nm激光器钥匙,关闭647 nm激光器电源。用100%无水乙醇擦拭物镜。然后关闭其余激光器,关闭激光台钥匙,关闭电脑。
5 超高分辨显微镜室的环境要求
(1)实验室要求防震远离辐射[10]。放置超高分辨显微镜的实验室最好在一楼,防止外界震动及周围环境气流影响仪器精密性,密闭远离电磁辐射源并配置专用防震台。
(2)实验室温湿度恒定。实验室内尽量配备空调和除湿机,温湿度保持恒定,温度建议保持在23 ℃左右,温度过高会导致相机报警。湿度建议保持60%左右,配置防潮柜以存放物镜等精密光学元件。
(3)实验室配备遮光系统。安装遮光窗帘,保证荧光样品不被外源光漂白,不受外界光源干扰。
6 日常维护注意事项
(1)保证系统稳定性。为保证超高分辨系统稳定性,显微镜Ti-E电源、电动载物台电源和piezo控制器电源3个硬件处于常开状态,不需要关闭。
(2)遵守仪器开关机流程。制定仪器开/关机流程并上墙,严格遵守,无独立操作资格者在未获得仪器管理员允许下严禁自行操作仪器,避免因操作不当造成仪器硬件损坏。特别注意激光器先开开关,后开钥匙。647 nm激光器除硬件控制外,还有专门的控制软件,通过软件控制功率缓慢上升和逐渐下降。不需要的激光器不开启,汞灯开关原则遵循半小时原则,即开了以后半小时之内勿关,避免短时间内频繁开启。
(3)仪器常规保养。实验完成后,使用无水乙醇或者无水乙醇(30%)与无水乙醚(70%)的混合液清洁物镜、目镜等。定期清洁载物台和显微镜机身的灰尘、油渍。
(4)数据刻录及软件。为保证仪器安全,实验数据应使用刻录光驱刻录DVD,或通过upload上传到公共平台网址对应的预约账户下我的实验结果管理路径,严禁使用U盘或移动硬盘拷贝数据。数据每3个月由管理员定期备份清理,禁止学生随意卸载软件。
7 随机光学重构超高分辨显微镜共享平台管理
(1)共享管理。随机光学重构超高分辨显微镜属于浙江大学医学院公共技术平台的固定资产,医学院公共平台是浙江大学校级实验平台,宗旨是为学校、研究所及附属医院的科研教学工作提供优质、高效和专业的技术服务,平台所属的大型仪器全天候开放共享,为校内外提供专业的测试服务和强大的技术支撑。配备专业技术人员对设备进行维护管理,使用者通过网上预约系统(http://www.cfzsm.zju.edu.cn/)实名预约使用设备。
(2)培训教学。为推广超高分辨技术,管理人员开展大规模常态化仪器线下/线上定期培训、特色定制培训,并拍摄了主管仪器的上机操作培训视频,推出大型仪器在线培训服务。面向校内外用户累计开展30余次技术讲座、上机培训及独立操作资格考核、大型全国性超高分辨培训班等,取得良好反响。该仪器作为研究生必修课《科研技能训练V》的理论和上机实操仪器,每年教学研究生320人。在“双一流”建设背景下,充分培养和提升了研究生的动手能力和科研创新能力,促进课程学习和科研能力培养有机结合,进一步提高了研究生的培养质量。
(3)共享成效。截止目前,该设备年服务机时超过800 h,支撑医学院、药学院、化学系、光电系、动科院、农学院、附属医院、杭州师范大学、江南大学等几十个校内外单位[11-13],为科研工作提供了强有力支撑。支撑高水平致谢文章十余篇,如AdvancedMaterials等,弥补了普通激光共聚焦不能满足高分辨率实验需求和高端成像的缺陷,为几十项973项目、国自然、省自然等基金提供技术支撑。
8 应用及展望
随着生命科学、材料、光学等学科的不断发展,随机光学重构超高分辨显微镜广泛应用于生物新结构和新功能的探索。Gunsolus等[14]使用Alexa Fluor 488对革兰氏阴性细菌表面外膜蛋白标记STORM成像,获得了30~40 nm的定位精度。Fu等[15]利用dSTORM观察人滋养层细胞表面抗原2(Trop2)在不同细胞膜上的聚集分布,揭示了Trop2为一种肺癌的潜在可能性生物标志物和治疗靶点。韩峰课题组利用STORM显微镜观察了GPR124在人脑血管周细胞中的表达和精确分布[16]。唐睿康课题组利用3D-STORM来测定矿化的胶原,通过z-steping不同层面展示及高分辨率三维渲染,得到了矿化胶原纤维的三维超高图片[17]。
随机光学重构超高分辨显微镜具有宽视场成像、分辨率高、可实现多色成像等优点,但同时也存在缺点,如:不适用于活细胞、组织等厚样品、对样品制备要求高,需特殊染料[18,19],成像速度慢,需反复成像进行叠加,以时间换空间,时间分辨率相对较低,通道间串色等。随着超高分辨显微镜新原理和新标记方法不断出现,多种技术的关联使用等,展望未来,随机光学重构超高分辨技术的发展应该能满足生物、材料和医学成像中三维、活体和快速成像的需求,即获得更高的时空分辨率以满足更小尺度更快过程的研究,这就对发展新的超高分辨硬件,如更高输出功率的激光器、开发标记新的探针,以及新的大数据处理算法等提出了全新的挑战。
随机光学重构超高分辨显微镜是高端、集多功能于一体的高精尖设备,该类设备非常昂贵,掌握其使用方法,重视日常维护,加强管理才能确保仪器处于良好状态。本文结合实际工作经验,全面综述了该显微镜的样品制备、拍摄流程、环境要求、日常维护、共享平台管理等,供广大同行管理人员交流探讨。
