吉林蛟河针阔混交林林层结构对生产力的影响
2021-04-07鲁君悦吴兆飞张春雨赵秀海
鲁君悦,吴兆飞,张春雨,赵秀海
北京林业大学国家林业和草原局森林经营工程技术研究中心,北京 100083
物种多样性和林分结构作为森林生态系统的重要特征,对森林生产力有显著影响。大量研究表明,增加物种多样性可以提高森林生产力[1-2],解释这种情况的原因主要为生态位互补假说,该假说认为不同物种由于生态位差异会对资源进行更充分的利用,从而提高森林生产力[3-4]。林分结构变异反映研究区内个体大小组成变化,其可能来源于同种或异种个体间的不对称竞争,也可能由不同物种间的固有差异产生[5]。林分结构对森林生态系统功能有着显著的影响,在森林可持续经营管理中有着广泛的应用,复杂的林分结构可以使树木在空间中形成多元配置,进而提高资源利用效率[6]。大量研究表明,林分结构多样性对生产力有促进作用[7-8],但也有结果显示二者呈不相关或负相关[9-11]。近年来,同时考虑物种多样性和林分结构多样性对生产力影响的研究逐渐成为热点问题,Zhang等认为物种多样性对森林生产力没有直接的影响,而是通过改变林分结构进而作用于森林生产力[12],而吴兆飞等基于东北地区大尺度条件下的数据,证明物种多样性和林分结构多样性的增加都会直接提高森林生产力[13]。
近年来,关于森林生态系统生产力的研究越来越多,但大多数研究都集中在整个群落水平[14-17],没有考虑物种多样性和林分结构多样性与森林生产力之间的关系在不同林层是否存在差异。在天然林中,林冠层对整个群落的地上生物量有很大贡献,而林下层对生物量贡献较小,对生物多样性的贡献很大[18]。研究表明,由于生态位互补效应林冠层物种多样性和树木个体大小差异会对林冠层生物量有积极的促进作用[19],且因林冠层对光照和土壤等一些可利用资源的主导作用,林下层的物种多样性和生产力在很大程度上也会受到林冠层的影响[20],林冠层的物种多样性可能会对林下层的物种多样性有积极的促进作用[21]。因此,了解不同林层物种多样性和林分结构对森林生产力的影响及其作用机制具有重要的意义。
针阔混交林作为东北地区典型的森林植被类型,对维持东北地区森林生态系统功能具有重要意义。本研究以吉林蛟河针阔混交林固定监测样地为研究对象,通过构建结构方程模型,探讨物种多样性和林分结构多样性与森林生产力之间的关系在不同林层之间的差异。研究主要关注以下两个问题:(1)林分结构多样性与森林生产力之间的关系在不同林层是否存在差异?(2)不同林层物种多样性对生产力的作用形式是否相同,林冠层物种多样性是否会对林下层物种多样性产生影响?旨在进一步了解东北针阔混交林生产力影响因素和作用机制,以期为针阔混交林的可持续经营管理提供理论支持。
1 研究区概况与研究方法
1.1 研究区概况
研究区位于吉林省蛟河林业实验区管理局林场内(43°51′—44°05′N、127°35′—127°51′E),属长白山系张广才岭山脉。该地区属于温带大陆季风性气候,年平均气温为3.8℃,最热月为7月,平均气温为21.7℃,最冷月为1月,平均气温为-18.6℃,年均降水量在700—800mm之间,多集中在夏季。土壤为山地暗棕色森林土,土层厚度为20—90cm。样地地势复杂,最低海拔为577.84m,最高海拔为780.67m。植被类型属于长白山植物区系,植物种类丰富,林分结构复杂,是受人为干扰较小的老龄针阔混交林。主要的乔木树种包括红松(Pinuskoraiensis)、千金榆(Carpinuscordata)、白牛槭(Acermandshuricum)、紫椴(Tiliaamurensis)、青楷槭(AcertegmentosumMaxim)、胡桃楸(Juglansmandshurica)。主要灌木树种包括簇毛槭(Acerbarbinerve)和毛榛(Corylusmandshurica)等。
1.2 样地调查与数据获取
2010年夏季,在蛟河实验区管理局的林场内,选择远离市区,受人为干扰极少的老龄针阔混交林,建立了30 hm2500m×600m的固定样地。采用全站仪将每块固定样地划分成750个20m×20m的连续样方,用水泥桩在20m处结点位置进行标记。2010年对样地内所有胸径(DBH)≥1cm的木本植物进行初测,记录其物种名、胸径、树高、冠幅、枝下高及相对位置,同时挂牌标记。2015年进行第一次复测调查。
使用GPS仪器对各样方内四个角位置上的海拔进行测量,取其平均值为该样方的海拔高度。测量坡度时,样方中四个顶角通过其任意三个角的顶点都会组成一个平面,用得到的平面与水平面重叠在一起所产生夹角的平均值就为该样方的坡度。测量样方顶角组成的平面与垂直平面的夹角度数,其平均值为该样方的坡向值。
使用随机取样和网格取样两种方法取土壤样本,以40m×40m网格线交叉点为基点,从八个方向中随机选择一个方向,在2m、8m和15m中随机抽取两个距离,形成2m和8m或2m和15m或8m和15m三种组合方式进行取样。最终共获得540个取样点,于实验室内分析测定土壤速效氮、速效钾、速效磷、有机质含量和土壤pH值。此外,计算每个小样方的胸高断面积密度来代表林分密度。各样方数据统计见表1。
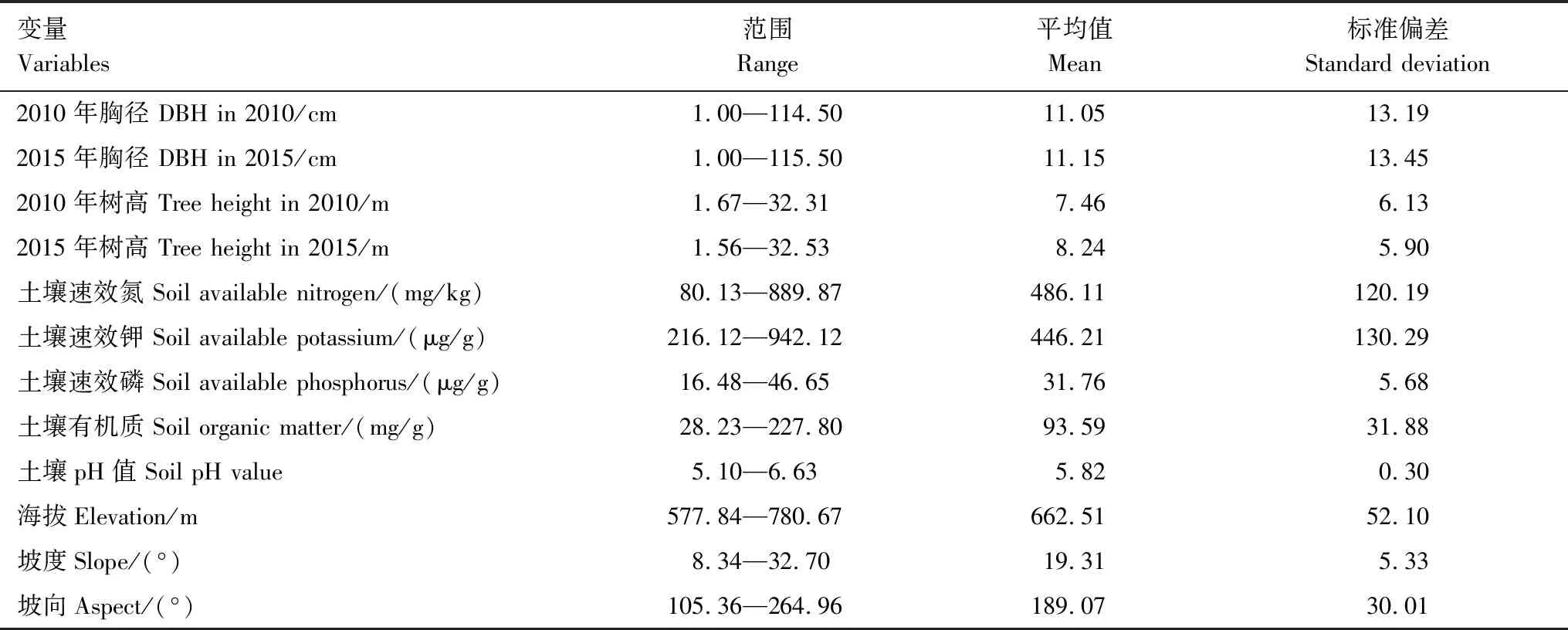
表1 样地内基础变量信息统计表
1.3 林层划分和生产力计算
林冠层和林下层的划分依据林层定性划分方法[22],树高占总体前30%为林冠层,其余个体归为林下层。在分析数据之前对数据进行处理,剔除缺存在异常数据的树木。本研究以样地内胸径(DBH)≥1cm的活立木为研究对象,共38432株,林冠层为11528株,林下层为26904株。每个样方林冠层和林下层相应的林分生产力、物种多样指数及林分结构多样性指数分别根据各层相应的个体进行计算。
以20m×20m样方为单位,根据对象木2010年和2015年的单株胸径,结合吉林省各树种胸径树高式和立木材积公式[23],分别求得所有单木的蓄积,单木蓄积加和得到不同林层的样方蓄积,用5年间的年均蓄积增长量作为蓄积生产力。
1.4 物种多样性及林分结构指标的计算与筛选
物种多样性采用物种丰富度、辛普森指数和香农指数这3个指标作为代表。林分结构多样性采用胸径香农指数、胸径辛普森指数、胸径基尼指数、胸径变异系数这4个指标作为代表。林分结构多样性的计算方法如下:以20m×20m的样方为单位,林冠层以胸径10cm为间隔划分其等级,林下层以胸径1cm为间隔划分其等级,分别计算每个样方内出现的胸径等级数和每个等级内的个体数。按照香农指数和辛普森指数的计算公式,用各林层的胸径等级数代替物种数代入物种香农指数公式和物种辛普森指数公式,就可以计算出各林层胸径香农指数及胸径辛普森指数。各指标计算公式见表2。
1.5 模型构建
在构建结构方程模型前,用Z-score方法对数据进行标准化处理。多重共线性会影响解释变量对响应变量的解释和预测能力,使用方差膨胀因子(VIF)检验各变量之间的多重共线性,当VIF<10时认为变量间没有多重共线性[24]。验证结果表明,本研究解释变量VIF均小于10,不存在多重共线性。基于多重共线性的检验结果,各林层的结构方程模型的基本构建形式如下。林冠层:VI1=a11×BAD1+a12×Diversity1+a13×Structure1+a14×Soil+a15×Terrain+b1。式中:VI1为林分蓄积生产力,BAD1为胸高断面积密度,Diversity1为物种多样性,Structure1为林分结构多样性,Soil为土壤因子,Terrain为地形因子,b1为常数项,a11-a15为相应的解释变量的系数。林下层:VI2=a21×BAD2+a22×Diversity2+a23×Structure2+a24×Soil+a25×VI1+a26×Diversity1+b2。式中VI2为林分蓄积生产力,BAD2为胸高断面积密度,Diversity2为物种多样性,Structure2为群落结构多样性,Soil为土壤因子,VI1为林冠层蓄积生产力,Diversity1为林冠层物种多样性。b为常数项,a21-a26为相应的解释变量的系数。

表2 物种多样性和林分结构多样性计算公式
N是样圆内总个体数;Ns是样圆内物种总数;ni是第i个物种的个体数;Nd是样圆内胸径级数;nj是第j个胸径级的个体数;bak是样方内按大小升序第k个个体的胸高断面积;DBHk是样方内第k个个体的胸径值;μ是样方中所有个体胸径平均值
为研究各生物因子和非生物因子对森林生产力的影响机制,探讨不同林层物种多样性和林分结构影响森林生产力相对作用大小和路径。各林层基于物种多样性和林分结构多样性构建以生产力为响应变量的结构方程模型。林冠层模型中不仅考虑了林分密度与物种多样性、林分结构和生产力之间的关系,此外还考虑了土壤和地形对物种多样性、林分结构、林分密度和生产力的影响。林下层模型中不仅考虑了林分密度与物种多样性、林分结构和生产力之间的关系,此外还考虑了土壤、林冠层生产力和林冠层物种多样性对林下层的影响。
为确定最佳模型,使用以下指标评估结构方程模型的拟合效果,即拟合优度指数(CFI)和标准化残差均方根(SRMR)。CFI接近1时代表拟合非常好,大于0.95小于1时拟合较好,大于0.90可以接受;当SRMR小于0.05时表示模型可接受。通过比较结构方程模型的CFI和SRMR值,确定优度最佳的变量和模型。在R 3.5.1的lavaan包中进行结构方程模型的运算。
2 结果与分析2.1 模型结果及各指标筛选
对750个样方数据进行筛选,剔除存在异常值和缺失值的样方,基于679个20m×20m样方的计算结果表明(表3),林冠层蓄积生产力的范围为0.23—18.75m3/hm2,平均值为5.51m3/hm2,是整个森林蓄积生产力的主要贡献者,而林下层蓄积生产力的范围为0.03—2.63m3/hm2,平均值为0.54m3/hm2,约为林冠层的1/10。林冠层林分密度的范围为0.61—62.84m3/hm2,平均值为24.61m3/hm2,林下层林分密度的范围为0.13—3.24m3/hm2,平均值为1.13m3/hm2,林冠层林分密度远远高于林下层的林分密度。基于679个样方的不同林层物种多样性和林分结构多样性统计结果表明(表4),林冠层物种丰富度的范围为1—13(表2),平均值为7.22,林下层物种丰富度的范围为2—16,平均值为7.29,林下层物种丰富度稍高于林冠层物种丰富度。
通过对变量进行筛选及对模型进行比较后,确定了林冠层模型及林下层模型的最优形式。林冠层的结果表示其结构方程模型与数据匹配度较高:CFI=0.999;SRMR=0.012,林下层的结果表示其结构方程模型与数据匹配度较高:CFI=0.953;SRMR=0.022。在最优模型中,林冠层和林下层均使用物种辛普森指数代表物种多样性,使用胸径变异系数代表林分结构多样性。在单独考虑林冠层结构方程模型时,使用海拔反映地形条件,使用速效氮反映土壤状况,二者均作为独立变量加入到模型当中。在单独考虑林下层结构方程模型时,因林下层树木受到林冠层树木影响较大,所以将林冠层生产力和林冠层物种多样性作为两个独立变量加入模型。
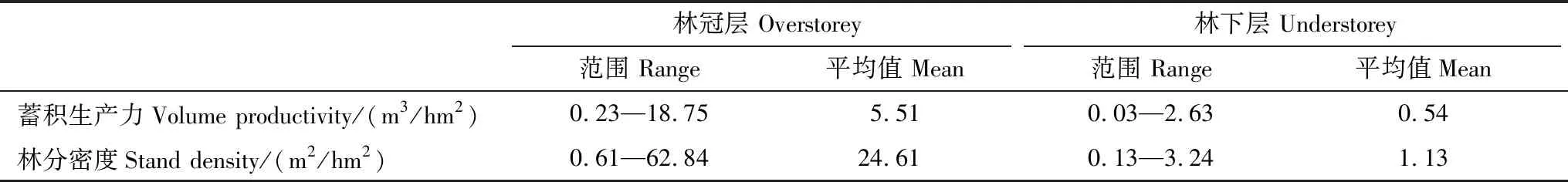
表3 主要变量统计结果
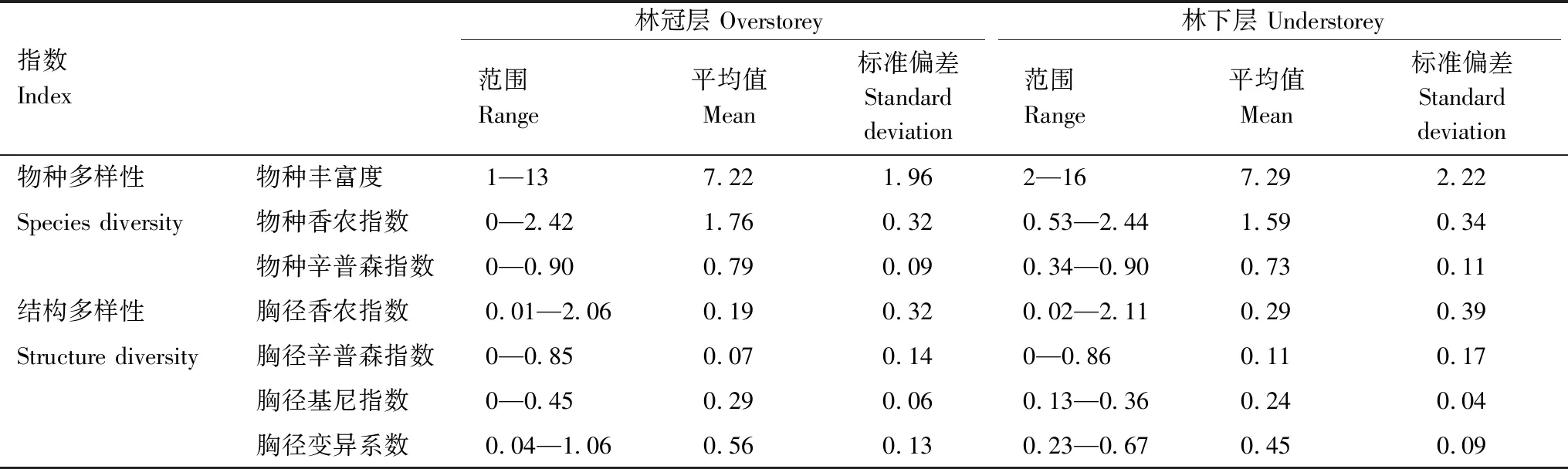
表4 不同林层物种多样性和林分结构多样性统计结果
2.2 林冠层物种多样性和林分结构与生产力关系
林冠层的结果表明(图1),物种多样性对生产力有显著的积极影响,路径系数为0.099。林分结构多样性和生产力之间呈负相关关系,路径系数为-0.138。此外,物种多样性还通过调整林分结构多样性间接作用于生产力。林分密度对生产力的直接影响显著(0.501),还通过调整物种多样性和林分结构多样性间接作用于生产力,且林分密度对生产力的影响高于物种多样性和林分结构多样性对生产力的影响。此外,模型还考虑了海拔和速效氮对生产力的影响,结果显示海拔和速效氮对生产力和物种多样性的影响均不显著,海拔通过影响林分密度和林分结构间接作用于生产力,路径系数分别为0.163和0.125,速效氮通过影响林分结构间接作用于生产力,路径系数为-0.105。
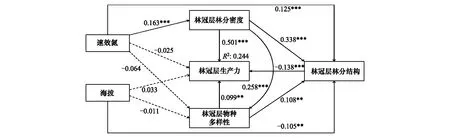
图1 林冠层物种多样性和林分结构对生产力的作用路径图Fig.1 The impact paths of species diversity and stand structure on productivity in overstorey实线表示作用路径显著,虚线表示作用路径不显著;*表示P<0.05,**表示P<0.01,***表示P<0.001
2.3 林下层物种多样性和林分结构与生产力关系
林分结构多样性对生产力有显著的积极影响(图2),路径系数为0.083。物种多样性对生产力没有直接影响,而是通过调整林分结构间接作用于生产力,路径系数为0.084。林分密度对生产力有显著的积极影响,路径系数为0.326。同时,模型还关注了林冠层生产力及林冠层物种多样性对林下层的影响。林冠层物种多样性对林下层生产力没有直接的影响,可以观察到林冠层物种多样性对林下层物种多样性产生积极影响,路径系数为0.147。

图2 林下层物种多样性和林分结构对生产力的作用路径图Fig.2 The impact paths of species diversity and stand structure on productivity in understorey实线表示作用路径显著,虚线表示作用路径不显著;*表示P<0.05,**表示P<0.01,***表示P<0.001
3 讨论
3.1 林分结构和林分密度与生产力之间的关系
作为反映林分结构的重要指标,树木个体大小差异对生产力有重要影响[12]。但是以往的研究大多只考虑整个群落水平上结构多样性与生产力的关系[13-14],本研究利用结构方程模型同时考虑了不同林层林分结构多样性与生产力之间的关系,结果表明在林冠层林分结构多样性和生产力之间呈负相关关系,在林下层林分结构多样性和生产力之间呈正相关关系。但是Ali等通过结构方程模型发现林冠层树木个体大小差异和地上生物量呈正相关关系,林下层树木个体大小差异和地上生物量无显著关系[19],出现不同结果的原因可能是Ali等的研究没有同时考虑物种多样性和树木个体大小差异的关系。
在林冠层,林分结构多样性和生产力之间呈负相关关系可能是优势木与劣势木相互作用的结果。相比劣势木,优势木在光截获和光能利用方面会更强,因此优势木能够捕获更多资源并更有效地利用这些资源,所以优势木的生长速度更快[25-27],而由于较小的劣势木获得的资源有限,它们生长速度会更慢[28]。当树木个体大小差异越来越强时,优势木的较高生长并不能补偿劣势木的较低生长,进而降低了森林生产力[26-27]。相反,在林下层林分结构多样性对生产力的影响是积极的。林分结构多样性反映了树木个体大小的变异程度,结构均匀的林分由于其树木个体大小差异不明显,彼此对资源的竞争相对激烈,降低了对资源的有效利用,进而不利于树木个体生长[14]。同时,林分结构复杂的群落会产生更加异质性的光环境,使得耐阴树种的枝叶更繁密且存活率升高[29],因此促进林下层对森林生产力的贡献[30]。
本研究发现在不同林层林分密度和生产力均为正相关关系,且这种关系在林冠层的作用更强,这也在Xu的研究中证实[31]。由于树种对资源竞争更加剧烈,在林冠层林分结构异质性随林分密度的增加而增加,进而降低了生产力,这与大多数人的研究结果保持一致[11,32]。相比物种多样性,林分密度对森林生产力的影响更大。与本研究结果一致,Vila等的研究也表明林分密度对森林生长产生的影响高于物种多样性[15]。在林冠层,环境条件对生产力无直接影响,而是通过调整林分结构间接影响森林生产力,这和大部分人的研究结果一致,环境条件对生产力没有直接影响,而会通过影响结构多样性作用于生产力[13,16]。
3.2 不同林层物种多样性对生产力的影响及其相互关系
本研究利用结构方程模型分别考虑了不同林层物种多样性与生产力之间的关系,结果表明在林冠层物种多样性对生产力有显著的积极影响,在林下层物种多样性对生产力没有直接影响,而是通过调整林分结构多样性影响生产力。在Zhang等的研究中发现,当只考虑物种多样性时,它与生产力呈显著的正相关关系,但是同时把林分结构多样性加入模型后,物种多样性对生产力无直接影响,而是通过调整林分结构间接作用于森林生产力[12],这和林下层的结果一致。吴兆飞等通过结构方程模型发现当同时考虑物种多样性和林分结构多样时,二者均与生产力之间呈正相关关系,且二者具有较强的相关性[13],这和林冠层的结果保持一致。
在林冠层,物种多样性和森林生产力的正相关关系可能归因于生态位互补效应。由于不同物种对资源的利用存在差异性,通过生态位的分化使得物种间的竞争作用降低[12,14]。物种多样性的增加也有利于提高树种的混交程度,使得各物种可以对资源进行更有效的利用,从而提高森林生产力[33]。在林下层,物种多样性对生产力的影响较林冠层物种多样性对林冠层生产力的影响更弱,其关系不显著,可能与物种的生长发育效应有关。林下层既包括灌木物种,也包括林冠层树木的幼苗更新,它们在应对生物相互作用和资源竞争时具有不同的功能。幼苗更新与树木生长具有不同的生态过程,树木生长时会经历不同的生物力学负荷、环境条件以及基因编程,从而导致树木的结构和功能随之改变[34]。因此,林下层物种多样和生产力之间的关系可能因树木生长发育、高强度竞争和环境异质性的混合效应而减弱[18,35]。此外,生物多样性与生产力关系的大小和方向受周围环境条件和可获得资源的影响[36],林冠层树木具有较高生物量和较大个体,会消耗大量资源,从而降低林下层树木的资源利用率,因此林冠层树木对资源的主导作用可能削弱了林下层物种多样性和生产力的关系[2,21]。这也在Ali等的研究中得到证实:林冠层物种多样性和地上生物量呈正相关关系,林下层物种多样性和地上生物量无显著关系[19]。Zhang等发现在不同林层物种丰富度和地上生物量都具有正相关关系,且这种关系在林冠层表现的更强[21],这与本研究的结果并不完全一致。出现不同结果的原因可能是因为研究地处于不同的温度带,或是所选指标存在差异。
物种多样性在林冠层和林下层呈正相关关系,这和大多数人的研究结果一致[19,21,31]。不同林层物种多样性之间的正相关关系可能是由于植物对气候、土壤和空间利用的程度不同[37]。由于凋落物和透光率的改变,林冠层物种多样性会增加林下层的资源异质性[38],进而促进林下层物种多样性[38-39]。同时,林冠层树木可能会调整其生境,以维持林下层或者较小邻木的适宜性[40]。此外,不同根系对土壤养分的吸收速率不同,这可能也影响了物种生物量积累,使得林下层的物种数量增加[41]。
4 结论
本研究以吉林蛟河针阔混交林为研究对象,利用结构方程模型探讨不同林层物种多样性和林分结构多样性与森林生产力之间的关系。结果表明不同林层林分结构对生产力的作用方向不同,林下层物种多样性对生产力的影响较林冠层物种多样性对生产力的影响更弱,这主要是由于树木生长发育和环境异质性的混合效应所导致的。因此,在森林经营过程中要充分考虑不同林层物种多样性和林分结构多样性与生产力之间的关系,进而提高森林生产力,促进森林的可持续经营和管理。
参考文献(References):
[1] Morin X, Fahse L, Scherer-Lorenzen M, Bugmann H. Tree species richness promotes productivity in temperate forests through strong complementarity between species. Ecology Letters, 2011, 14(12): 1211-1219.
[2] Hooper D U, Chapin III F S, Ewel J J, Hector A, Inchausti P, Lavorel S, Lawton J H, Lodge D M, Loreau M, Naeem S, Schmid B, Setälä H, Symstad A J, Vandermeer J, Wardle D A. Effects of biodiversity on ecosystem functioning: a consensus of current knowledge. Ecological Monographs, 2005, 75(1): 3-35.
[3] Cardinale B J, Matulich K L, Hooper D U, Byrnes J E, Duffy E, Gamfeldt L, Balvanera P, O′Connor M I, Gonzalez A. The functional role of producer diversity in ecosystems. American Journal of Botany, 2011, 98(3): 572-592.
[4] Tilman D, Knops J, Wedin D, Reich P, Ritchie M, Siemann E. The influence of functional diversity and composition on ecosystem processes. Science, 1997, 277(5330): 1300-1302.
[5] Zhang Y, Chen H Y H, Reich P B. Forest productivity increases with evenness, species richness and trait variation: a global meta-analysis. Journal of Ecology, 2012, 100(3): 742-749.
[6] Yachi S, Loreau M. Does complementary resource use enhance ecosystem functioning? A model of light competition in plant communities. Ecology Letters, 2007, 10(1): 54-62.
[7] Lei X D, Wang W F, Peng C H. Relationships between stand growth and structural diversity in spruce-dominated forests in New Brunswick, Canada. Canadian Journal of Forest Research, 2009, 39(10): 1835-1847.
[8] Dănescu A, Albrecht A, Bauhus J. Structural diversity promotes productivity of mixed, uneven-aged forests in southwestern Germany. Oecologia, 2016, 182(2): 319-333.
[9] Long J N, Shaw J D. The influence of compositional and structural diversity on forest productivity. Forestry: An International Journal of Forest Research, 2010, 83(2): 121-128.
[10] Ryan M G, Stape J L, Binkley D, Fonseca S, Loos R A, Takahashi E N, Silva C R, Silva S R, Hakamada R E, Ferreira J M, Lima A M N, Gava J L, Leite F P, Andrade H B, Alves J M, Silva G G C. Factors controllingEucalyptusproductivity: how water availability and stand structure alter production and carbon allocation. Forest Ecology and Management, 2010, 259(9): 1695-1703.
[11] Soares A A V, Leite H G, Souza A L, Silva S R, Lourenço H M, Forrester D I. Increasing stand structural heterogeneity reduces productivity in BrazilianEucalyptusmonoclonal stands. Forest Ecology and Management, 2016, 373: 26-32.
[12] Zhang Y, Chen H Y H. Individual size inequality links forest diversity and above-ground biomass. Journal of Ecology, 2015, 103(5): 1245-1252.
[13] 吴兆飞, 张雨秋, 张忠辉, 何怀江, 张春雨, 赵秀海. 东北温带森林林分结构与生产力关系研究. 北京林业大学学报, 2019, 41(5): 48-55.
[14] 谭凌照, 范春雨, 范秀华. 吉林蛟河阔叶红松林木本植物物种多样性及群落结构与生产力的关系. 植物生态学报, 2017, 41(11): 1149-1156.
[15] Vilà M, Carrillo-Gavilán A, Vayreda J, Bugmann H, Fridman J, Grodzki W, Haase J, Kunstler G, Schelhaas M, Trasobares A. Disentangling biodiversity and climatic determinants of wood production. PLoS One, 2013, 8(2): e53530.
[16] Ali A, Lin S L, He J K, Kong F M, Yu J H, Jiang H S. Climate and soils determine aboveground biomass indirectly via species diversity and stand structural complexity in tropical forests. Forest Ecology and Management, 2019, 432: 823-831.
[17] Zheng L T, Chen H Y H, Yan E R. Tree species diversity promotes litterfall productivity through crown complementarity in subtropical forests. Journal of Ecology, 2019, 107(4): 1852-1861.
[18] Gilliam F S. The ecological significance of the herbaceous layer in temperate forest ecosystems. BioScience, 2007, 57(10): 845-858.
[19] Ali A, Yan E R. The forest strata-dependent relationship between biodiversity and aboveground biomass within a subtropical forest. Forest Ecology and Management, 2017, 401: 125-134.
[20] Barbier S, Gosselin F, Balandier P. Influence of tree species on understory vegetation diversity and mechanisms involved-A critical review for temperate and boreal forests. Forest Ecology and Management, 2008, 254(1): 1-15.
[21] Zhang Y, Chen H Y H, Taylor A R. Positive species diversity and above-ground biomass relationships are ubiquitous across forest strata despite interference from overstorey trees. Functional Ecology, 2017, 31(2): 419-426.
[22] 庄崇洋, 黄清麟, 马志波, 罗芬, 张寅. 林层划分方法综述. 世界林业研究, 2014, 27(6): 34-40.
[23] 吉林省林业厅. 吉林省立木材积、出材率表. 吉林: 吉林省林业厅, 2015.
[24] Fox J. Applied Regression Analysis and Generalized Linear Models. California: Sage Publications, 2015.
[25] Binkley D, Stape J L, Bauerle W L, Ryan M G. Explaining growth of individual trees: light interception and efficiency of light use byEucalyptusat four sites in Brazil. Forest Ecology and Management, 2010, 259(9): 1704-1713.
[26] Binkley D, Campoe O C, Gspaltl M, Forrester D I. Light absorption and use efficiency in forests: why patterns differ for trees and stands. Forest Ecology and Management, 2013, 288: 5-13.
[27] Campoe O C, Stape J L, Nouvellon Y, Laclau J P, Bauerle W L, Binkley D, Le Maire G. Stem production, light absorption and light use efficiency between dominant and non-dominant trees ofEucalyptusgrandisacross a productivity gradient in Brazil. Forest Ecology and Management, 2013, 288: 14-20.
[28] Binkley D, Stape J L, Ryan M G, Barnard H R, Fownes J. Age-related decline in forest ecosystem growth: an individual-tree, stand-structure hypothesis. Ecosystems, 2002, 5(1): 58-67.
[29] Valladares F, Niinemets Ü. Shade tolerance, a key plant feature of complex nature and consequences. Annual Review of Ecology, Evolution, and Systematics, 2008, 39: 237-257.
[30] Parker G G, Davis M M, Chapotin S M. Canopy light transmittance in Douglas-fir-western hemlock stands. Tree Physiology, 2002, 22(2/3): 147-157.
[31] Xu W, Luo W X, Zhang C Y, Zhao X H, vol Gadow K, Zhang Z H. Biodiversity-ecosystem functioning relationships of overstorey versus understorey trees in an old-growth temperate forest. Annals of Forest Science, 2019, 76(3): 64.
[32] Boyden S, Binkley D, Stape J L, 2008. Competition amongEucalyptustrees depends on genetic variation and resource supply. Ecology, 2008, 89(10): 2850-2859.
[33] Fahey R T, Fotis A T, Woods K D. Quantifying canopy complexity and effects on productivity and resilience in late-successional hemlock-hardwood forests. Ecological Applications, 2015, 25(3): 834-847.
[34] Meinzer F C, Lachenbruch B, Dawson T E. Size- and Age-Related Changes in Tree Structure and Function. Dordrecht: Springer, 2011.
[35] Mason N W H, De Bello F, Doležal J, Lepš J. Niche overlap reveals the effects of competition, disturbance and contrasting assembly processes in experimental grassland communities. Journal of Ecology, 2011, 99(3): 788-796.
[36] Fridley J D. Resource availability dominates and alters the relationship between species diversity and ecosystem productivity in experimental plant communities. Oecologia, 2002, 132(2): 271-277.
[37] Taylor A R, Seedre M, Brassard B W, Chen H Y H. Decline in net ecosystem productivity following canopy transition to late-succession forests. Ecosystems, 2014, 17(5): 778-791.
[38] Bartels S F, Chen H Y H. Interactions between overstorey and understorey vegetation along an overstorey compositional gradient. Journal of Vegetation Science, 2013, 24(3): 543-552.
[39] Bartels S F, Chen H Y H. Is understory plant species diversity driven by resource quantity or resource heterogeneity? Ecology, 2010, 91(7): 1931-1938.
[40] Lefcheck J S, Byrnes J E K, Isbell F, Gamfeldt L, Griffin J N, Eisenhauer N, Hensel M J S, Hector A, Cardinale B J, Duffy J E. Biodiversity enhances ecosystem multifunctionality across trophic levels and habitats. Nature Communications, 2015, 6: 6936.
[41] Houle D, Moore J D, Ouimet R, Marty C. Tree species partition N uptake by soil depth in boreal forests. Ecology, 2014, 95(5): 1127-1133.
